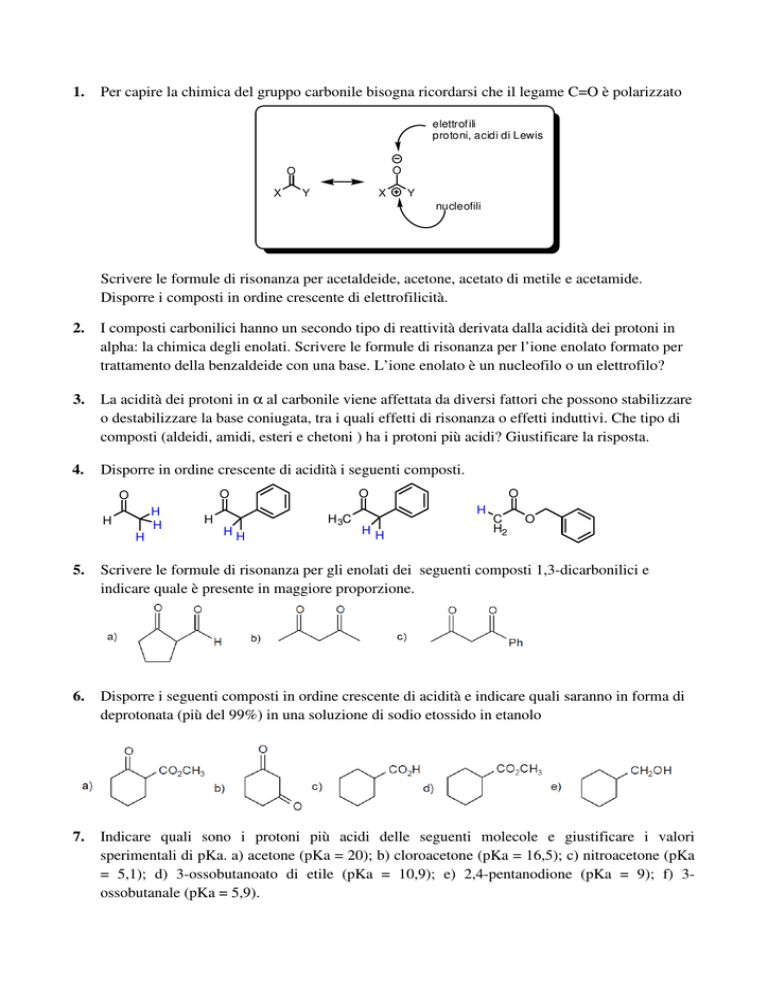
1.
Per capire la chimica del gruppo carbonile bisogna ricordarsi che il legame C=O è polarizzato
elettrof ili
protoni, acidi di Lewis
O
O
X
Y
X
Y
nucleofili
Scrivere le formule di risonanza per acetaldeide, acetone, acetato di metile e acetamide.
Disporre i composti in ordine crescente di elettrofilicità.
2.
I composti carbonilici hanno un secondo tipo di reattività derivata dalla acidità dei protoni in
alpha: la chimica degli enolati. Scrivere le formule di risonanza per l’ione enolato formato per
trattamento della benzaldeide con una base. L’ione enolato è un nucleofilo o un elettrofilo?
3.
La acidità dei protoni in α al carbonile viene affettata da diversi fattori che possono stabilizzare
o destabilizzare la base coniugata, tra i quali effetti di risonanza o effetti induttivi. Che tipo di
composti (aldeidi, amidi, esteri e chetoni ) ha i protoni più acidi? Giustificare la risposta.
4.
Disporre in ordine crescente di acidità i seguenti composti.
O
O
O
H
H
H
H
H
HH
H 3C
O
H
HH
C
H2
O
5.
Scrivere le formule di risonanza per gli enolati dei seguenti composti 1,3-dicarbonilici e
indicare quale è presente in maggiore proporzione.
6.
Disporre i seguenti composti in ordine crescente di acidità e indicare quali saranno in forma di
deprotonata (più del 99%) in una soluzione di sodio etossido in etanolo
7.
Indicare quali sono i protoni più acidi delle seguenti molecole e giustificare i valori
sperimentali di pKa. a) acetone (pKa = 20); b) cloroacetone (pKa = 16,5); c) nitroacetone (pKa
= 5,1); d) 3-ossobutanoato di etile (pKa = 10,9); e) 2,4-pentanodione (pKa = 9); f) 3ossobutanale (pKa = 5,9).
8.
Scrivere un meccanismo ragionevole per la seguente trasformazione
9.
Scrivere i prodotti di condensazione aldolica per le seguenti molecole.
10. Nel 1884 Perkin riuscì a sintetizzare l’acido ciclopropanocarbossilico da dietilmalonato e 1,2dibromoetano. Completare lo schema sintetico.
11. Disegnare i composti ottenuti per reazione della cicloesanone con:
a) Carbonato di dietile, NaH, THF
b) i) LDA (1.1 equiv)/THF, -78°C; ii) (CH3)2C=CH-CH2Br
c) i) morfolina, TsOH, toluene, riflusso; ii) bromuro di benzile; iii) H2O, H+
d) benzaldeide, HCl
e) i) LDA (1.1 equiv)/THF, -78°C, ii) Me3SiCl, iii) EtCHO, TiCl4
12. Indicare i reagenti e condizioni di reazione per le seguenti trasformazioni
a) Dietil malonato acido 4-pentenoico
b) Bromuro di benzile fenilmalonato di etile
c) 3-ossobutanoato di etile 1-fenil-1,4-pentanodione
d) Cicloessanone 2-metilcicloessanone
e) Bromoacetato di etile 3-idrossi-3-metilpentanoato di etile
f) Fenilacetaldeide acido 4-fenil-2-butenoico
g) Pentanale 2-propilbutano-1,3-diolo
h) 3-ossobutanoato di etile 2,8-nonanodione
13. Indicare la ruta di sintesi più adatta per la preparazione delle seguenti molecole.
a) 1-fenil-2-metilpentano-1,3-dione partendo da etil fenil chetone.
b) 3-idrossibutanoato di etile partendo da acetato di etile
c) 2-etil-2,4-dimetil-3-ossopentanoato di etile partendo da 3-pentanone o da metil isopropil
chetone
d) Acido ciclopentanocarbossilico partendo da 1,4-dibromobutano
14. Indicare i reagenti e condizioni di reazione per le seguenti trasformazioni:
15. Giustificare i seguenti dati sperimentali
a) L’acido 2-ossobiciclo[2.2.1]eptano-1-carbossilico non decarbossila dopo riscaldamento.
b) La reazione del 2-metilcicloessanone con ioduro di metile in medio basico fornisce una
miscela di 2,2-dimetilcicloessanone e 2,6-dimetilcicloessanone.
c) La reazione del cicloesanone con i) pirrolidina in medio acido; ii) ioduro di metile e iii)
H2O, H+ fornisce come unico prodotto di reazione la 2,6-dimetilcicloessanone.
d) Nella reazione del cicloesanone con bromoacetato di etile in presenza di etossido sodico in
etanolo si forma l’epossido I e non il prodotto di alchilazione in α. Come si forma
l’epossido? Propone una sintesi alternativa del composto II partendo dalla cicloesanone.
16. Completare le seguenti sequenze sintetiche.
17. La reazione del composto 1 con sodio metossido e formiato di metile in etere etilico fornisce un
prodotto 2 di formula for C15H12O2 con una ressa del 86%. Disegnare il composto ottenuto e
assegnare i segnali più caratteristici di 1H-NMR e 13C-NMR
18. Identificare il composto di formula C4H8O usando gli spettri IR e 1H-NMR