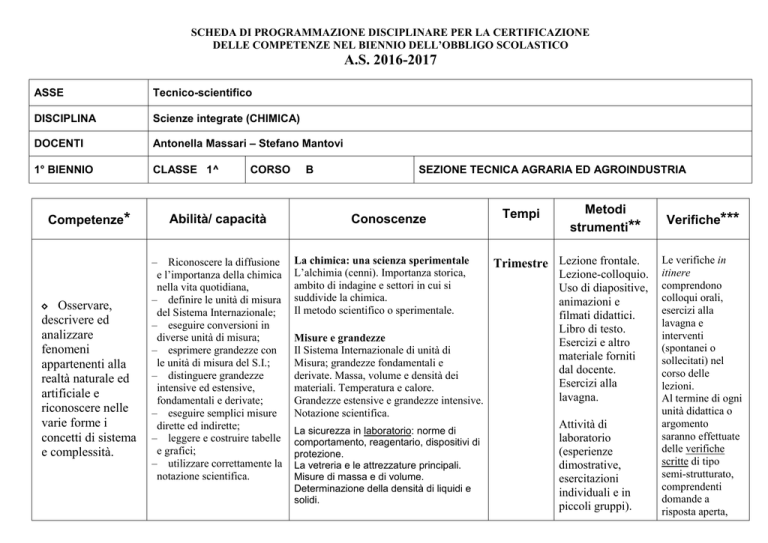
SCHEDA DI PROGRAMMAZIONE DISCIPLINARE PER LA CERTIFICAZIONE
DELLE COMPETENZE NEL BIENNIO DELL’OBBLIGO SCOLASTICO
A.S. 2016-2017
ASSE
Tecnico-scientifico
DISCIPLINA
Scienze integrate (CHIMICA)
DOCENTI
Antonella Massari – Stefano Mantovi
1° BIENNIO
CLASSE 1^
Competenze*
Osservare,
descrivere ed
analizzare
fenomeni
appartenenti alla
realtà naturale ed
artificiale e
riconoscere nelle
varie forme i
concetti di sistema
e complessità.
◊
CORSO
Abilità/ capacità
– Riconoscere la diffusione
e l’importanza della chimica
nella vita quotidiana,
– definire le unità di misura
del Sistema Internazionale;
– eseguire conversioni in
diverse unità di misura;
– esprimere grandezze con
le unità di misura del S.I.;
– distinguere grandezze
intensive ed estensive,
fondamentali e derivate;
– eseguire semplici misure
dirette ed indirette;
– leggere e costruire tabelle
e grafici;
– utilizzare correttamente la
notazione scientifica.
B
SEZIONE TECNICA AGRARIA ED AGROINDUSTRIA
Conoscenze
La chimica: una scienza sperimentale
L’alchimia (cenni). Importanza storica,
ambito di indagine e settori in cui si
suddivide la chimica.
Il metodo scientifico o sperimentale.
Misure e grandezze
Il Sistema Internazionale di unità di
Misura; grandezze fondamentali e
derivate. Massa, volume e densità dei
materiali. Temperatura e calore.
Grandezze estensive e grandezze intensive.
Notazione scientifica.
La sicurezza in laboratorio: norme di
comportamento, reagentario, dispositivi di
protezione.
La vetreria e le attrezzature principali.
Misure di massa e di volume.
Determinazione della densità di liquidi e
solidi.
Tempi
Metodi
strumenti**
Trimestre Lezione frontale.
Lezione-colloquio.
Uso di diapositive,
animazioni e
filmati didattici.
Libro di testo.
Esercizi e altro
materiale forniti
dal docente.
Esercizi alla
lavagna.
Attività di
laboratorio
(esperienze
dimostrative,
esercitazioni
individuali e in
piccoli gruppi).
Verifiche***
Le verifiche in
itinere
comprendono
colloqui orali,
esercizi alla
lavagna e
interventi
(spontanei o
sollecitati) nel
corso delle
lezioni.
Al termine di ogni
unità didattica o
argomento
saranno effettuate
delle verifiche
scritte di tipo
semi-strutturato,
comprendenti
domande a
risposta aperta,
– Classificare le sostanze in
base al loro stato fisico;
– descrivere i passaggi di
stato delle sostanza pure e
disegnare le curve di
riscaldamento e
raffreddamento;
– utilizzare le principali
tecniche di separazione dei
materiali.
Analizzare
qualitativamente e
quantitativamente
fenomeni legati
alle trasformazioni
di energia a partire
dall’esperienza.
Classificazione della materia
Materia e sostanze. I sistemi omogenei e i
sistemi eterogenei. Le sostanze pure e i
miscugli. Le soluzioni (cenni). I principali
metodi di separazione dei miscugli.
Gli stati di aggregazione della materia. I
passaggi di stato.
Laboratorio
Tecniche di separazione dei miscugli
(filtrazione, centrifugazione, estrazione
con solventi, cromatografia e distillazione).
Curve di riscaldamento di sostanze pure.
◊
– Spiegare le differenze tra
una trasformazione chimica
e una trasformazione fisica;
– distinguere un elemento
da un composto;
– descrivere le proprietà di
metalli e non metalli.
Le trasformazioni fisiche e chimiche
della materia
Fenomeni fisici e fenomeni chimici. Le
reazioni chimiche: concetti di reagente e
prodotto. Elementi e composti. Il
linguaggio della chimica: simboli e
formule. La tavola periodica degli
elementi (introduzione).
Laboratorio
Fenomeni che si osservano nelle reazioni
chimiche.
– Definire le tre leggi
ponderali della chimica;
– descrivere il modello
atomico di Dalton;
– utilizzare il modello
cinetico-molecolare per
interpretare le
trasformazioni fisiche e
chimiche.
Le leggi ponderali che governano la
chimica
La conservazione della massa (la legge di
Lavoisier). La composizione dei composti
(la legge di Proust). La legge delle
proporzioni multiple di Dalton. La teoria
atomica di Dalton e le proprietà della
materia. La teoria cinetico-molecolare
della materia.
Laboratorio
Verifica della legge di Lavoisier.
Verifica della legge di Proust.
test a scelta
multipla,
risoluzione di
esercizi e
problemi.
Si valuterà,
inoltre, l’attività di
laboratorio
attraverso
l’elaborazione di
schede tecniche,
relazioni e grafici
e l’osservazione
dell’atteggiamento
e delle abilità
operative
raggiunte.
Si terrà conto,
infine, dell’uso e
cura del quaderno.
– Comprendere l’aspetto
quantitativo legato a una
reazione in accordo con la
legge della conservazione
della massa.
– Spiegare le proprietà delle
principali particelle presenti
in un atomo;
◊ Essere
– confrontare i modelli
atomici;
consapevole delle
–
identificare gli elementi
potenzialità e dei
della tavola periodica
limiti delle
mediante il numero atomico
tecnologie nel
– calcolare la massa
contesto culturale e molecolare di un composto.
sociale in cui
vengono applicate.
Stechiometria
Bilanciamento delle reazioni chimiche.
Significato dei coefficienti stechiometrici.
La struttura dell’atomo
La natura elettrica della materia. Le
particelle fondamentali dell’atomo. I
modelli atomici di Thomson e Rutherford.
Numero atomico e numero di massa.
Isotopi. Massa atomica di un elemento.
Massa molecolare.
– Rappresentare la
configurazione elettronica di
un atomo o di uno ione;
– spiegare la struttura
elettronica a livelli di
energia dell’atomo;
– definire i concetti di
“orbita” e “orbitale”.
Gli elettroni nell’atomo
La doppia natura della luce (cenni).
L’atomo di Bohr. Il modello atomico a
orbitali. Livelli e sottolivelli. La
configurazione elettronica completa ed
esterna degli elementi.
– Spiegare la relazione tra
struttura
elettronica
e
posizione degli elementi
sulla tavola periodica;
– scrivere le strutture di
Lewis degli elementi;
– descrivere le principali
proprietà periodiche.
Il sistema periodico
La moderna tavola periodica; periodi,
gruppi e principali famiglie di elementi
chimici. I simboli di Lewis. Le proprietà
periodiche degli elementi. Metalli, non
metalli e semimetalli.
Laboratorio
Analisi chimica qualitativa: il saggio alla
fiamma e il saggio delle perle al borace.
Laboratorio
Uso di tavole periodiche interattive.
Pentamestre
– Descrivere e comparare i
diversi legami chimici;
– prevedere il tipo di legami
esistenti tra atomi uguali e
diversi;
– rappresentare la struttura
di Lewis di una molecola o
di uno ione
– prevedere la forma delle
molecole con la teoria
VSEPR;
– stabilire la polarità di una
sostanza in base alla
struttura della sua molecola;
– confrontare la natura dei
legami chimici tra atomi e
tra molecole.
– Assegnare il numero di
ossidazione ad ogni
elemento;
– classificare i composti in
base alla famiglia di
appartenenza;
– ricavare la formula di un
composto dal suo nome;
– attribuire alla formula di
un composto il nome
tradizionale e quello IUPAC
– caratterizzare in modo
operativo i sistemi acidi e
basici;
– classificare le principali
reazioni chimiche.
I legami chimici
I legami chimici e la stabilità energetica. I
gas nobili e la regola dell’ottetto. I legami
primari: il legame ionico, il legame
covalente e il legame metallico. Le
strutture di Lewis di molecole e ioni.
La forma delle molecole e la teoria
VSEPR. La polarità delle molecole. I
legami secondari: forze di van der Waals
e legame idrogeno.
Laboratorio
Utilizzo dei modelli molecolari.
Comportamento delle sostanze in
presenza di forze elettriche. Solubilità e
miscibilità delle sostanze.
Nomenclatura dei composti chimici
Il numero di ossidazione, leggere e
scrivere le formule.
La
classificazione
dei
composti
inorganici e i diversi tipi di nomenclatura
(tradizionale e IUPAC).
I composti binari e ternari, le reazioni di
formazione dei principali composti.
Come si classificano le reazioni
chimiche.
Laboratorio
Reazioni di sintesi di ossidi, idrossidi, acidi
e sali.
Caratterizzazione di sistemi acidi e basici:
determinazione del pH con la cartina
indicatrice e il piaccametro digitale.
Riconoscimento di sostanze a carattere
acido e basico: prove su prodotti di uso
comune.
* Le competenze elencate sono da intendersi valide per il primo biennio.
** Metodi e strumenti sono da intendersi validi per l’intero programma.
*** La modalità e lo svolgimento delle verifiche sono gli stessi per l’intero programma.