COMPITO DI CHIMICA DEL 12FEBBRAIO 2013
1)Un campione solido, di massa 124.5 g, contenente magnesio, alluminio e zinco viene trattato, in
un primo tempo, con un eccesso di soluzione acquosa di acido cloridrico. Si sviluppano 107.8 L di
idrogeno misurati a 24°C e 720 torr. La soluzione viene poi trattata con acido solfidrico: precipitano
77.2 g di solfuro di zinco. Calcolare la composizione percentuale in peso della miscela iniziale.
Soluzione
Indico con x le mol di Mg nel campione, con y quelle di Al e con z quelle di Zn.
Reazione del campione con HCl:
x
Mg + 2HCl → MgCl2 + H2
y
Al + 3HCl → AlCl3 + 3/2 H2
z
Zn + 2HCl → ZnCl2 + H2
le moli di idrogeno che si ottengono sono:
nH2 = PV/RT = (720/760) atm∙107.8 L/(0.0821 L atm K-1 mol-1∙297.16 K) = 4.19 mol
Dalla stechiometria delle reazioni ho:
nH2 = x + (3/2) y + z = 4.19 mol
Dal trattamento con acido solfidrico ho:
ZnCl2 + H2S → ZnS↓ + …..
nZnS = 77.2 g/97.45 g mol-1 = 7.92∙10-1 mol
nZnS = nZn z = 7.92∙10-1 mol
Ho il seguente sistema con due equazioni in due incognite:
x + (3/2) y + 7.92∙10-1 = 4.19 mol
24.3x + 26.98 y + 65.38∙7.92∙10-1 = 124.5 g
x + (3/2) y = 3.4
24.3x + 26.98 y = 72.72
24.3x + 36.45 y = 82.62
24.3x + 26.98 y = 72.72
9.47 y = 9.9 y = 1.05 mol = nAl
x = 1.83 mol = nMg
% Mg = (1.83 mol∙24.3 g mol-1/124.5 g)∙100 = 35.7%
% Al = (1.05 mol∙26.98 g mol-1/124.5 g)∙100 = 22.8%
% Zn = (7.92∙10-1 mol∙65.38 g mol-1/124.5 g)∙100 = 41.6%
2)Calcolare la pressione osmotica, a 35°C, di una soluzione ottenuta miscelando 500 mL di una
soluzione 0,25 M di solfato di alluminio con un ugual volume di una soluzione 0,30 M di cloruro di
calcio. [NB. Considerare il solfato di calcio completamente insolubile]
Soluzione
500 mL Al2(SO4)3 0.25 M
500 mL CaCl2 0.30 M
n = 0.125 mol
n = 0.150 mol
Al2(SO4)3 2 Al+3 + 3 SO420.125
0.250
0.375
CaCl2
0.150
Ca2+
0.150
+ 2 Cl–
0.300
Ca2+ + SO42- CaSO4
0.150
0.375
--0.225
0.150
1
Vtot = 1.0 L
[ ]tot = (0.250 + 0.225 + 0.300) = 0.775 M
π = []tot RT = 0.775 * 0.0821 * 308 = 19.6 atm
3)Nelle stesse condizioni di temperatura e pressione, facendo reagire 5 g di sodio metallico con
acqua, si liberano 9400 cal e facendo reagire 10 g di ossido di sodio con acqua si liberano 10200 cal.
Sapendo che l’entalpia molare di formazione dell’acqua è -68000 cal/mol, calcolare l’entalpia
molare di formazione dell’ossido di sodio.
Soluzione:
Scrivo le reazioni coinvolte:
(I) Na + H2O → NaOH + ½ H2
(II) Na2O + H2O → 2NaOH
(III) H2 + ½ O2 → H2O
(IV) 2Na + ½ O2 → Na2O
Noto che
(IV) = 2∙(I) – (II) + (III)
Applicando la legge di Hess si ricava:
ΔH(IV) = 2∙ΔH(I) – ΔH(II) + ΔH(III)
Calcolo ΔH(I)
Le moli di sodio sono: nNa = 5 g/22.99 g mol-1 = 2.17∙10-1 mol
ΔH(I) = -9400 cal/2.17∙10-1 mol = -4.322∙104 cal mol-1
Analogamente calcolo ΔH(II)
Le moli di ossido di sodio sono: nNa2O = 10 g/61.98 g mol-1 = 1.61∙10-1 mol
ΔH(II) = -10200 cal/1.61∙10-1 mol = -6.322∙104 cal mol-1
ΔH(IV) = 2∙(-4.322∙104 cal mol-1) – (-6.322∙104 cal mol-1) + (-6.80∙104 cal mol-1) = -9.122∙104 cal mol-1
4)In un recipiente di volume V = 5.0 L vengono introdotti 52.2 L (misurati a 80°C e P = 1 atm) di
ossido di azoto gassoso e 26.1 L (misurati a 80°C e P = 1 atm) di bromo gassoso.
Il recipiente viene termostatato alla temperatura T*alla quale avviene la reazione:
2NO(g) + Br2(g) 2NOBr(g)
che porta alla formazione di NOBr con una resa del 40%. Calcolare quante moli di ossido di azoto
bisogna aggiungere nel recipiente per ottenere 1.35 moli di NOBr.
Soluzione:
nNO = PV/RT = 1 atm∙52.2 L/(0.0821 L atm K-1 mol-1∙353.16 K) = 1.8 mol
nBr2 = PV/RT = 1 atm∙26.1 L/(0.0821 L atm K-1 mol-1∙353.16 K) = 0.9 mol
Calcolo la costante di equilibrio:
2NO(g) + Br2(g) 2NOBr(g)
Inizio
1.8
0.9
Δ
-2x
-x
+2x
Equilibrio
1.8-2x
0.9-x
2x
Poiché la resa in NOBr è del 40% ed i reagenti sono in proporzioni stechiometriche ho:
x/0.9 = 0.4 x = 0.36
per cui all’equilibrio ho:
nNO = 1.8 – 0.72 = 1.08 mol
nBr2 = 0.9 – 0.36 = 0.54 mol
nNOBr = 0.72 mol
Calcolo Kc
Kc=(1/V)-1 n2NOBr/(n2NO∙nBr2) = 5∙0.722/(1.082∙0.54) = 4.115
2
Se devo ottenere 1.35 mol di NOBr aggiungendo al sistema NO posso scrivere:
2NO(g) + Br2(g) 2NOBr(g)
Inizio
1.8+y
0.9
Δ
-2x
-x
+2x
Equilibrio
1.8+y-2x
0.9-x 2x
con 2x = 1.35 mol x = 0.675 mol per cui
nNO = 1.8 + y – 1.35 = 0.45 mol + y
nBr2 = 0.9 – 0.675 = 0.225 mol
nNOBr = 1.35 mol
Kc=(1/V)-1 n2NOBr/(n2NO∙nBr2) = 5∙1.352/(n2NO∙0.225) = 4.115
nNO = √[5∙1.352/(0.225∙4.115)] = 3.14 mol
Le moli di NO da aggiungere sono y = nNO – 0.45 = 3.14 – 0.45 = 2.69 mol
5)Si mescolano 50.0 mL di una soluzione 0,20 M di cloruro di manganese (II) con 50.0 mL di
ammoniaca 0.20 M. Determinare se si forma un precipitato e calcolare la quantità minima di
cloruro di ammonio che si deve aggiungere affinché il precipitato formatosi si ridisciolga
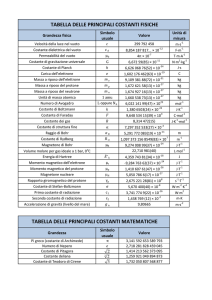
completamente. [Kbammoniaca = 1.810–5; I valori dei Kps delle sostanze poco solubili sono riportati
nella tabella allegata]
Soluzione
50 mL MnCl2 0.2 M
50 mL NH3 0.2 M
[Mn2+] = 0.1 M
[NH3] = 0.1 M
[OH–]2 = 1.8 10–6 M
Qps = [Mn2+] [OH–]2 = 1.8 10–7>Kps Si forma precipitato diMn(OH)2
Kps= [Mn2+] [OH–]2 = 4.57 10–14
mM(NH4Cl) = 53.5 g/mol
M
m(NH4Cl) = 14.2 g
6)Una soluzione acquosa di cloruro di cerio (III) (E° = –2,48 V) e cloruro di cesio (E° = –2,92 V)
entrambi di concentrazione 0,01 M viene sottoposta ad elettrolisi a 25°C. Determinare il valore
della concentrazione in soluzione degli ioni cerio alla quale inizia la precipitazione degli ioni cesio.
[CeCl3] = 0.01 M
E° = – 2.48V
[CsCl] = 0.01 M
E° = – 2.92V
3
A E = -3.04V iniziano a precipitare gli ioni Cs+ per cui
[Ce3+] = 4.24 10–29 M
4
5