Prova 2 (50 punti)
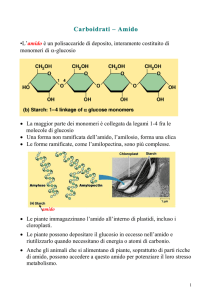
L’amilasi
L'α-amilasi è una glicoproteina monomerica calcio dipendente (MW 56KDa) responsabile della
digestione dell'amido. Nell'uomo sono presenti l'amilasi salivare e quella pancreatica; entrambe
catalizzano l'idrolisi casuale dei legami glicosidici α(1,4) formando maltosio, glucosio,
oligosaccaridi ed α-destrine.
Il test di Lugol- Lo iodio in soluzione acquosa forma con l'amido un complesso ad alta sensibilità
e specificità. Il complesso iodio-amido è blu-violetto, mentre le amilodestrine ed il maltosio, in
presenza di iodio, sono rispettivamente rosa o incolori.
Materiali e strumenti
1.Autopipetta a volume variabile da 1000 µL
2.Autopipetta a volume variabile da 100 o 200 µL
3.Soluzione di amido 10 g/L (eppendorf A)
4.Lugol (flaconcino con L)
5.Puntali per le autopipette
6.Eppendorf e portaeppendorf
7.Pipette Pasteur
8.Soluzione tampone a pH 5 (eppendorf 5)
9.Soluzione tampone a pH 7 (eppendorf 7)
10.Soluzione tampone a pH 8 (eppendorf 8)
11.Tavoletta bianca (schema posizioni dosaggio)
12.Contenitore per lavaggi e rifiuti
PRIMA DI EFFETTUARE QUALSIASI OPERAZIONE ASCOLTA ATTENTAMENTE LE
ISTRUZIONI E NON TOCCARE LE AUTOPIPETTE.
Procedura dosaggio.
In un eppendorf prepara questa miscela: 750 µL di soluzione tampone e 100 µL di soluzione d'amido,
predisponi il cronometro e seleziona 20 µL sull'autopipetta. Appena sei pronto predisponi sullo schema 4
o 5 gocce di Lugol, prelevate con la pipetta Pasteur, poi chiama il coordinatore della prova che
aggiungerà alla miscela 50 µL di soluzione enzimatica. Fai immediatamente scattare il cronometro; ogni
20 sec preleva dalla miscela 20 µL e saggiali sulla tavoletta bianca con una goccia di Lugol. Ripeti la
stessa procedura ogni 20 sec finchè avrai raggiunto il punto di scolorimento (quindi l'idrolisi completa
dell'amido). Annota il tempo impiegato. Calcola la concentrazione finale dell'amido ed i µg di amido nella
miscela (3 punti). Calcola la velocità della reazione come unità relative, i µg di amido idrolizzato in 1
minuto (5 punti).
Ripeti la prova in doppio e riporta nella seguente tabella i dati ottenuti:
Concentrazione
finale amido (g/L)
tempo
U.E. (µg di amido/min)
µg di amido nella miscela
A questo punto ripeti la prova sostituendo al tampone a pH 7 il tampone a pH 5 (5 punti), poi ripeti col
tampone a pH 8 (5 punti) quindi riporta nella tabella tutti i dati ottenuti.
Tampone pH 5
tempo
Tampone pH 7
U.E.
tempo
Osservazione gocce __________________
Tampone pH 8
U.E.
tempo
U.E.
(3 punti)
Riporta in grafico i dati raccolti. (5 punti)
Quali conclusioni puoi trarre? (3 punti)
......................................................................................................................................................................
....................................................................................................................................................
In bocca il pH è circa 7, nello stomaco 2,5 quindi....(3 punti)
......................................................................................................................................................................
..........................................................................................................................................
Ciascuna delle risposte corrette alle domande seguenti vale 3 punti (un punto di
penalizzazione per la risposta errata). Fai una crocetta sulla risposta esatta o completa se
richiesto.
1) Devi preparare una soluzione di tampone sodio fosfato 10 mM a pH 7 che contenga 0,1 mM
Ca2+ (per stabilizzare l'amilasi). Scegli il modo corretto di preparare la soluzione fra le opzioni
seguenti e calcola il volume di soluzione 10 mM di CaCl2 (Y) e la quantità di Na2HPO4 (X) che
devi utilizzare.
La massa molecolare del Na2HPO4 è 141,96 g/mol.
a.) Aggiungi Y ml di 10 mM CaCl2 a 40 ml di acqua distillata e porta il pH a 7,0.Sciogli X gr di
Na2HPO4 e porta il volume a 50 ml.
b.) Sciogli X gr di Na2HPO4 in 40 ml di acqua distillata. Aggiungi Y ml di 10 mM CaCl2 a 5 ml di
acqua distillata. Mescola le due soluzioni e aggiusta il pH a 7,0 con HCl. Porta il volume a 50
ml.
c.) Sciogli X gr di Na2HPO4 in 40 ml di acqua distillata. A questo, aggiungi Y ml di 10 mM CaCl2.
Porta il volume a 50 ml, non è necessario aggiustare il pH perchè l'acqua distillata ha già pH
7,0.
d.) Sciogli X gr di Na2HPO4 in 45 ml di acqua distillata. Aggiungi Y ml di 10 mM CaCl2 a 5 ml di
acqua distillata. Mescola le due soluzioni e aggiusta il pH a 7,0 con HCl.
a
b
c
d
(3 punti)
X = _________gr di Na2HPO4
(3 punti)
Y=__________ml 10mM di CaCl2
(3 punti)
2) L'amido viene trattato con dimetilsolfato che aggiunge un gruppo metilico ad ogni OH libero; poi viene
idrolizzato e tutti i legami glicosidici vengono scissi. Quanti tipi di molecole di glucosio metilato si
ottengono?
a
b
c
d
4
1
3
2
3) L'amilasi commerciale purificata ha un'attività specifica di 7000 UE/mg. Se solubilizzi 25 µg di
enzima in 2,5 mL qual è la molarità della soluzione enzimatica?
a
b
c
d
1,78
µM
0,0178
mM
0,178 µM
0,0000178 M
4) In un'industria dolciaria per preparare lo sciroppo base è necessario idrolizzare 1 Kg di amido
al minuto; quanto enzima commerciale serve?
a
b
c
d
143 g
143 mg
14,3 mg
0,143 g
COGNOME E NOME_________________________________________________________
REGIONE____________________________________________
PUNTEGGIO ________________________