SOS AMBIENTE:
LA NATURA RISPONDE
- Biotecnologie Agrarie per l’Ambiente Utilizzo di piante transgeniche (Arabidopsis thaliana) in grado di mettere in
evidenza la presenza di metalli pesanti nel suolo
!
SPERIMENTA IL BIOLAB
Centro Università degli Studi di Milano - Scuola per la diffusione delle Bioscienze
Indice
1. PREREQUISITI 3
2. INTRODUZIONE TEORICA: LE PIANTE TRANSGENICHE PER IL 4
MONITORAGGIO AMBIENTALE 4
2.1 – I bioindicatori 4
2.2 -­ Destino dei contaminanti di suolo/aria/acqua nella catena alimentare 5
2.3 -­ I metalli pesanti nell’ambiente: il caso del cadmio 7
2.4 -­ Come studiare l’inquinamento ambientale: analisi chimico-­Bisica 9
e bioindicazione 9
2.5 -­ La pianta che utilizziamo: Arabidopsis thaliana 11
2.6 -­ I geni reporter 12
3. SCOPO DELL' ESPERIMENTO 18
3.1 -­ Il costrutto genetico utilizzato per trasformare Arabidopsis 18
3.2 -­ Allevamento delle piante 19
4. PARTE SPERIMENTALE 20
4.1 -­ Saggio istochimico 20
4.2 -­ Estrazione dell’RNA e dosaggio spettrofotometrico del RNA totale 20
4.3 – Analisi dell’espressione del gene reporter 21
5. APPENDICI 22
5.1 -­ Legislazione: livelli inquinanti del Cadmio 22
5.2 -­ Le tecniche utilizzate 24
5.3 -­ Note di sicurezza 25
1. PREREQUISITI
Per affrontare questa esperienza è necessario avere delle nozioni preliminari ri-­‐
guardanti:
la struttura di DNA e RNA
!
la duplicazione del DNA
!
la retrotrascri-­‐
zione e il cDNA
il ruolo delle piante nella ca-­‐
tena alimentare
!
!
3
2. INTRODUZIONE TEORICA: LE PIANTE TRANSGENICHE PER IL MONITORAGGIO AMBIENTALE
2.1 – I bioindicatori
I bioindicatori (o indicatori biologici) sono organismi o comunità di organismi che forniscono informazioni sulla qualità ambientale e sui livelli di inquinamento, perché rispondono a de-­‐
terminate condizioni am-­‐
bientali con variazioni che possono essere identi[icate e talvolta quanti[icate. Queste variazioni spesso riguardano il tasso di mor-­‐
talità, di crescita o di ri-­‐
produzione della specie bioindicatrice: ad esempio la qualità delle acque dolci può essere monitorata stu-­‐
diando la composizione di comunità di invertebrati, così come la diminuzione della fertilità e del numero ! Fig. 2.1.1 -­‐ Licheni danneggiati: l’inquinamento ne ha causato di specie di licheni è indice lo scolorimento e il distacco del “corpo” dal substrato.
di inquinamento atmosfe-­‐
rico. Altre variazioni sono di tipo morfologico e funzionale: ad esempio, sempre nei licheni, l’inquinamento atmosferico ne causa lo scolorimento e la riduzione del “corpo” ([ig. 2.1.1).
Oltre a utilizzare organismi naturali per lo studio della qualità ambientale, sono stati messi a punto organismi transgenici (sia vegetali che animali). L’utilizzo del-­‐
le piante transgeniche come bioindicatori presenta alcuni vantaggi, legati princi-­‐
palmente alla loro natura di organismi complessi, sedentari, naturalmente adatti alla crescita su suolo, il cui allevamento è relativamente facile e poco costoso. Inoltre, le piante rappresentano il principale punto di ingresso nella catena ali-­‐
mentare umana e animale per numerosi inquinanti e/o composti tossici. I bioin-­‐
dicatori vegetali transgenici sono stati ottenuti utilizzando un approccio di inge-­‐
gneria genetica che ha permesso di inserire in alcune specie uno o più geni, detti geni reporter (vedi paragrafo 2.6), la cui espressione produce un segnale biochi-­‐
mico facilmente identi[icabile e misurabile (ad esempio attraverso la colorazione di un substrato) ed è subordinata alla presenza di un particolare contaminante. I bioindicatori vegetali transgenici sono stati inizialmente utilizzati per monitora-­‐
re danni al DNA dovuti a inquinamento nucleare: in piante transgeniche di Arabi-­
dopsis thaliana la sequenza del gene reporter GUS (la cui espressione è rilevabile grazie a una colorazione blu dei tessuti vegetali opportunamente trattati) è inter-­‐
4
rotta da quella di un altro gene, ma vie-­‐
ne ripristinata in caso di ricombinazio-­‐
ne omologa, dovuta a inquinamento nucleare ([ig. 2.1.2). Queste stesse pian-­‐
te sono state inoltre utilizzate con suc-­‐
cesso per monitorare gli effetti geno-­‐
tossici di metalli pesanti, di alcuni erbi-­‐
cidi, delle specie reattive dell’ossigeno e dell’esposizione a stress salino. Que-­‐
sto tipo di bioindicatore non è però speci[ico per il tipo di contaminante, e non può essere utilizzato per il moni-­‐
toraggio della presenza nell’ambiente di una particolare sostanza. !
Fig. 2.1.2 -­‐ Piante di Arabidopsis: le zone blu devono il colore al prodotto del gene GUS e indicano che è avvenuta ricombinazione omologa causata da radiazioni.
Diversamente, sono state sviluppate piante di Arabidopsis transgeniche in grado di monitorare in modo speci[ico la concentrazione biodisponibile di metalli nel suolo. Tali bioindicatori sono stati costruiti integrando stabilmente nel genoma della pianta un vettore in cui l’espressione del gene reporter GUS è posta sotto il controllo del promotore di un gene speci[ica-­‐
mente indotto dalla presenza di metallo nel mezzo di crescita. Queste piante non solo sono in grado di indicare la presenza del metallo nel mezzo di crescita, ma forniscono un segnale la cui intensità è dipendente dal livello di conta-­‐
minazione. I risultati ottenuti a livello speri-­‐
mentale con questo approccio sono incorag-­‐
gianti, ma sono necessarie ulteriori prove, in condizioni più simili a quelle di campo, per valutare la reale applicabilità di queste piante come bioindicatori.
Più recentemente sono state prodotte piante transgeniche di Arabidopsis in grado di evi-­‐
denziare la presenza di seleniato o cromato nel mezzo di crescita. Fig. 2.1.3 -­‐ La colorazione delle pian-­‐
!tine di Arabidopsis, dovuta agli anto-­‐
In[ine, un particolare esempio di bioindicato-­‐ ciani, indica la presenza di tritolo.
re vegetale è rappresentato da piante di Ara-­
bidopsis transgeniche in grado di evidenziare la presenza di mine di terra: in esse è stato inserito un gene per la sintesi degli antociani la cui espressione è controllata da un promotore sensibile al tritolo ([ig. 2.1.3).
2.2 -­ Destino dei contaminanti di suolo/aria/acqua nella catena alimentare
Le piante verdi, e più in generale gli organismi autotro[i, sono il punto di partenza delle catene alimentari da cui dipende l’esistenza di tutti gli altri organismi etero-­‐
tro[i; sono pertanto de[inite produttori, in quanto catturano l'energia dall'esterno e la rendono disponibile nell'ecosistema ([ig. 2.2.1).
5
Le piante, attraverso le radici, assorbono vari elementi presenti nel terreno, che si diffondono poi nell’intera pianta, incluse le parti eduli.
Alcuni di questi elementi sono inqui-­‐
nanti che arrivano alle piante come conseguenza delle intense attività an-­‐
tropiche, in particolare agricola ed in-­‐
dustriale; la contaminazione dei vege-­‐
tali ha come tramite principale il ter-­‐
reno e l’acqua, e in molti casi esiste una relazione con la concentrazione degli elementi presenti.
Le sostanze tossiche che entrano nella catena alimentare, se non possono es-­‐
sere metabolizzate dagli organismi, vanno accumulandosi man mano che passano da un livello tro[ico all’altro (consumatori primari, secondari, ter-­‐
ziari ...): tale processo di accumulo è detto biomagniLicazione. Ne conse-­‐
gue che i predatori sono gli organismi maggiormente esposti a tali sostanze Fig. 2.2.1 -­‐ Livelli tro[ici in un ecosistema.
tossiche persistenti. È un esempio no-­‐
to, ad esempio, l’accumulo di DDT che negli anni ’50-­‐’60 ha determinato il !
declino in popolazioni di aquile, poiché determinava un’eccessiva fragilità del guscio delle loro uova ([ig. 2.2.2).
! Fig. 2.2.2 -­‐ L’accumulo di DDT nell’ecosistema.
Tra gli inquinanti ricordiamo qui i metalli, che sono generalmente caratterizzati da una distribuzione non uniforme in tutti i tessuti dei vegetali; in particolare de-­‐
stano preoccupazione i metalli pesanti, pericolosi in quanto tendono a bioaccu-­‐
mularsi nella pianta e mostrano anche elevata biomagni[icazione.
6
Tra le fonti di contaminazione agricola si possono annoverare:
-­‐ uso di letame o re[lui zootecnici: contengono sostanze chimiche inquinanti che sono cedute al terreno e quindi assorbibili dalle piante;
-­‐ trattamenti [itosanitari ripetuti contenenti metalli: il rischio è legato, oltre che all’applicazione stessa, al destino di questi nel terreno, e alla possibilità che ven-­‐
gano successivamente assorbiti dalle piante;
-­‐ deposizione aeriforme o precipitazioni di sostanze provenienti da zone urbane o industriali;
-­‐ uso di biomasse di origine urbana o industriale, come compost o fanghi: utilizza-­‐
te come ammendanti, possono risultare molto pericolose per il loro contenuto di metalli (l’uso di tali prodotti è rigidamente normato);
-­‐ uso di acque irrigue contaminate. 2.3 -­ I metalli pesanti nell’ambiente: il caso del cadmio
I metalli pesanti, una classe di metalli la cui densità supera i 5 g cm-­‐3, possono es-­‐
sere classi[icati in essenziali o non essenziali per le piante e molti altri organismi. Piccole quantità di metalli pesanti essenziali, quali ferro (Fe), rame (Cu) e zinco (Zn), sono necessari alla crescita delle piante in quanto cofattori in molte attività enzimatiche e interazioni con ligandi. Diversamente, i metalli pesanti non essen-­‐
ziali, come cadmio (Cd), mercurio (Hg) e piombo (Pb), non sono richiesti per la crescita delle piante e in molti casi possono esercitare effetti tossici; infatti, questi metalli possono entrare all’interno delle cellule, attraverso gli stessi sistemi di trasporto usati dai metalli pesanti essenziali, e alterare le funzioni cellulari inter-­‐
agendo principalmente con gli atomi di zolfo e azoto delle catene laterali degli amminoacidi. Tuttavia, in condizioni [isiologiche, anche livelli di metalli pesanti essenziali superiori a quelli ottimali possono in[luenzare negativamente il meta-­‐
bolismo e la [isiologia degli organismi viventi. Altri danni dovuti ai metalli pesanti sono di natura genotossica, causando l'alte-­‐
razione dell'integrità strutturale e funzionale !
del DNA attraverso la modi[icazione delle basi azotate, la rottura della doppia elica e riarrangiamenti. Questi danni sono conse-­‐
guenza dell’azione ossidante sul DNA eserci-­‐
tata dall’ossigeno attivo ed altri radicali libe-­‐
ri prodotti in reazioni redox catalizzate dai metalli. Inoltre, alcuni composti del piombo possono interferire con l'attività mitotica e causare la rottura dei cromosomi.
Tra la classe dei metalli non essenziali, il cadmio è uno di quelli di maggior impatto rispetto sia all’esposizione delle piante sia all’accumulo nella catena alimentare umana ([ig 2.3.1). La sua rilevanza come contami-­‐
nante ambientale e la sua mobilità relativa-­‐
mente alta nel sistema suolo-­‐pianta hanno 7
Fig. 2.3.1 -­‐ Un’insolita “carta d’identità” del cadmio.
r e s o q u e s t o m e t a l l o t o s s i c o i l p i ù s t u d i a t o n e l l e p i a n t e .
Il cadmio è un elemento biopersistente: una volta assorbito da un organismo, rimane in esso per molti anni (dell'ordine di decine per gli uomini) prima di veni-­‐
re espulso. Le proprietà tossicologiche del cadmio derivano dalla sua somiglianza chimica con lo zinco, un micronutriente essenziale per piante, animali ed esseri umani.
Come per altri elementi, l’accumulo nella pianta stessa è determinato dalla sua capacità di assorbimento dal terreno (uptake) e dall’ef[icienza di traslocazione dalle radici alle altre parti della pianta. L’assorbimento dal terreno dipende dal pH del suolo e dal suo contenuto in sostanza organica.
Fig. 2.3.2 1. Penetrazione attraverso la parete cellulare.
2. Concentrazione nel vacuo-­‐
lo.
3. Traslocazione vascolare.
4. Trasferimento nelle cellule della foglia.
!
Il cadmio è un metallo non essenziale e non esiste un meccanismo speci[ico di uptake, ma l’ingresso nelle cellule vegetali avviene attraverso gli stessi sistemi di trasporto utilizzati dai cationi essenziali come Zn++, Ca++ e Fe++.
Le radici delle piante contribuiscono a rendere gli ioni metallici maggiormente disponibili per l’uptake acidi[icando la rizosfera (dal greco rhiza = radice e sphai-­
ra = campo d’azione, in[luenza. Regione di suolo, generalmente ristretta a pochi millimetri, che circonda la radice e in cui si hanno interazioni tra radici-­‐suolo adiacente-­‐organismi associati) e producendo acidi organici come il citrato che agisce chelando i metalli ([ig. 2.3.2-­‐1).
Il cadmio nel citosol si lega a complessi a basso peso molecolare che vengono tra-­‐
sportati successivamente all’interno di un vacuolo ([ig. 2.3.2-­‐2).
La traslocazione riguarda invece lo spostamento alle foglie ed ai frutti attraverso lo xilema ([ig. 2.3.2-­‐3 e 4).
8
Negli organismi vegetali l’esposizione ad elevate concentrazioni di Cd++ comporta l’inibizione della crescita sia delle radici che della parte aerea della pianta, la comparsa di clorosi fogliare, l’alterazione del bilancio idrico, l’inibizione dell’aper-­‐
tura stomatica ed una diminuzione della biosintesi della cloro[illa. La tossicità del cadmio potrebbe essere legata a interferenze con numerosi processi come il me-­‐
tabolismo dei carboidrati, l’assorbimento e riduzione del nitrato, la catalisi enzi-­‐
matica, il bilanciamento idrico e la fotosintesi. Si pensa che la maggior parte di questi effetti sia legata all’estrema capacità del cadmio di legare i gruppi sul[idri-­‐
lici delle proteine, portando all’inattivazione enzimatica. Inoltre, l’accumulo di cadmio induce stress ossidativo, come evidenziato dalla formazione di specie reattive dell’ossigeno, quali l’anione superossido e il perossido d’idrogeno.
Le piante mettono comunque in atto una serie di meccanismi per contrastare l’as-­‐
sorbimento del metallo e, quindi, difendersi dagli effetti tossici:
-­‐ modi[icano il pH della rizosfera producendo mucillagini da parte delle radici,
-­‐ immobilizzano lo ione nella parete cellulare,
-­‐ producono [itochelatine, particolari peptidi intracellulari che legano il metallo ai gruppi S-­‐H della cisteina ed impediscono la circolazione del Cd++ nel citosol,
-­‐ compartimentalizzano il Cd++ immobilizzandolo in una area del vacuolo;
-­‐ producono proteine da stress come l’ubiquitina che esercita una azione protetti-­‐
va sulle membrane riparando velocemente i danni alle proteine cellulari.
Alcune piante evidenziano capacità di tolleranza, sopportano cioè una elevata concentrazione del metallo senza evidenziare effetti sul loro metabolismo.
L'assorbimento di cadmio da parte degli esseri umani avviene principalmente at-­‐
traverso il cibo. Le derrate alimentari ricche in cadmio possono notevolmente aumentare la concentrazione di cadmio nel corpo umano. Alcuni esempi sono fe-­‐
gato, funghi, crostacei, mitili, polvere di cacao ed alghe secche.
Il cadmio è trasportato al fegato principalmente tramite il sangue. Nel fegato si lega alle proteine per formare complessi che arrivano poi ai reni. Quì il cadmio si accumula, danneggiando i meccanismi di [iltrazione. Ciò causa l'escrezione di pro-­‐
teine essenziali e di zuccheri ed un ulteriore danno renale. Occorre molto tempo prima che il cadmio accumulato nei reni sia espulso dal corpo umano.
2.4 -­ Come studiare l’inquinamento ambientale: analisi chimico-­Lisica e bioindicazione
L’inquinamento ambientale può essere valutato secondo due approcci:
-­‐ misurando alcuni parametri chimico-­‐[isici, ad esempio determinando la quantità di un inquinante nel mezzo (suolo, acqua, aria) oppure misurando una variazione di temperatura;
-­‐ attraverso lo studio di bioindicatori.
I due approcci sono complementari, presentando ciascuno dei vantaggi e degli svantaggi, che sono riassunti nella seguente tabella.
9
ANALISI CHIMICO-­‐FISICA
ANALISI CON BIOINDICATORI
VANTAGGI
-­‐ evidenzia i fattori inquinanti uno per uno
-­‐ evidenzia il tipo di inquinamento (organico, inorganico, ecc…)
-­‐ è precisa (al millesimo o al milione-­‐
simo di grammo/litro)
-­‐ è facilmente confrontabile con altre situazioni (tabelle legislative di rife-­‐
rimento)
-­‐ rileva gli effetti ambientali e biologici dell’inquinamento
-­‐ evidenzia anche gli effetti degli in-­‐
quinanti non segnalati
-­‐ rileva una situazione media nel tem-­‐
po
-­‐ è sensibile agli effetti sinergici degli inquinanti
SVANTAGGI
-­‐ non evidenzia necessariamente tutti i fattori inquinanti (limiti di sensibilità degli strumenti)
-­‐ non rileva gli effetti ambientali del-­‐
l’inquinamento
-­‐ rileva una situazione istantanea nel tempo
-­‐ non permette di prevedere gli effetti sinergici degli inquinanti
-­‐ non rileva la quantità di inquinante realmente biodisponibile ma la quan-­‐
tità totale
-­‐ non sempre evidenzia la natura degli inquinanti
-­‐ il livello di precisione è limitato dalla variabiltà insita nei sistemi biologici
-­‐ non è sempre formalizzabile in tabel-­‐
le legislative
Da notare come alcuni svantaggi dell’utilizzo di bioindicatori siano superati con la messa a punto di piante transgeniche in grado di rispondere in modo speci[ico a un inquinante, ad esempio il cadmio. Inoltre, attraverso la misurazione del quanti-­‐
tativo della sostanza con metodi analitici, è possibile fare un’analisi diretta del-­‐
l’accumulo di sostanze inquinanti nei tessuti degli organismi (bioaccumulo).
10
2.5 -­ La pianta che utilizziamo: Arabidopsis thaliana
!
Fig. 2.5.1 -­‐ Arabidopsis thaliana. Dalla foto in alto a sinistra, in senso orario: [iori, disegno della piantina, granuli di polline, tassonomia.
Arabidopsis thaliana (o Thale Cress oppure arabide comune; [ig. 2.5.1) è una pian-­‐
ta annuale che cresce nei sentieri o sui muri dei giardini e fa parte della stessa famiglia del cavolo e della senape. Cresce inoltre in diversi habitat, dal Polo Artico all'equatore con notevoli capacità di adattamento. Si tratta di una specie cosmo-­‐
polita in grado di sopravvivere in una vasta gamma di ambienti e di adattarsi alle diverse condizioni esterne, presentando numerose varietà locali.
Arabidopsis thaliana è diventata negli ultimi anni un organismo modello per lo studio della genetica e della biologia molecolare e cellulare delle piante, poiché possiede una serie di vantaggi: piccole dimensioni (che la rendono ideale negli spazi ristretti dei laboratori e delle serre negli istituti di ricerca), ciclo vitale breve (circa sei settimane), elevata produttività di semi ([ino a 10.000 semi per pianta), ridotte dimensioni del suo genoma (circa 125 milioni di paia di nucleotidi, in soli cinque cromosomi). Un ulteriore vantaggio di Arabidopsis è la semplicità con la quale si possono produrre piante transgeniche, tramite il processo di trasforma-­‐
zione genetica, sfruttando il batterio Agrobacterium tumefaciens per incorporare nuovo DNA nel genoma della pianta (vedi [igura 2.5.2)
In[ine, Arabidopsis è la prima pianta da [iore di cui sia stato sequenziato il geno-­‐
ma, grazie a una ricerca avviata nel 1991 dalla Commissione europea e basata sul-­‐
la collaborazione di laboratori di 15 paesi, tra cui Stati Uniti e Giappone (Nature 408, 791, 14 December 2000).
11
!
Fig. 2.5.2. La produzione di piante transgeniche realizzata mediante tecniche di ingegneria genetica su Agrobacterium. Nella [igura viene prodotta una pianta resistente alla piralide, grazie all’introduzione del gene Bt, di Bacillus thuringensis.
2.6 -­ I geni reporter
I geni reporter sono geni che i ricercatori utilizzano per studiare il livello di espressione di un gene di interesse e/o l’attività del suo promotore. Un buon gene reporter è quello il cui prodotto proteico è facilmente individuabile e misurabile in cultura. Per introdurre un gene reporter in una cellula, viene costruito un vettore (in ge-­‐
nere un plasmide) in cui il reporter è posizionato a valle del gene che si vuole stu-­‐
diare, e sotto il controllo dello stesso promotore. Quando il promotore viene atti-­‐
vato, viene trascritto il gene reporter di cui si può vedere e misurare il prodotto, ottenendo informazioni sul livello di trascrizione del gene d’interesse.
Il vettore deve contenere un gene marcatore selezionabile, per consentire di mo-­‐
nitorare l’avvenuto inserimento del gene reporter nella cellula trasformata. Per il biomonitoraggio, il gene reporter viene utilizzato direttamente per valutare un determinato parametro ambientale. Nel vettore il gene reporter viene inserito sotto il controllo di un promotore sensibile alle variazioni del parametro ambien-­‐
tale che si vuole studiare ([ig. 2.6.1). 12
Fig. 2.6.1 -­‐ Gene reporter utilizzato come bioindicatore, in quanto sotto il controllo di un pro-­‐
motore sensibile a una condizione ambientale.
Caratteristiche dei geni reporter
-­‐ codi[icano un prodotto la cui attività è facilmente rilevabile e quanti[icabile (in genere proteine visibili e monitorabili con metodi istochimici, immunologici, spettrofotometrici, [luorimetrici, luminometrici ecc).
- vengono posti a valle di una sequenza promotore che normalmente regola l’espressione di un gene diverso e che viene scelta in base allo scopo dell’in-­‐
dagine:
1) un promotore particolarmente “forte” se si vuole studiare l’espressione ubi-­‐
quitaria del gene reporter , oppure un promotore tessuto-­‐speci[ico
2) un promotore la cui attività dipende da una determinata condizione ambien-­‐
tale
-­‐ l’attività della proteina codi[icata dal gene reporter indica l’avvenuta attiva-­‐
zione del promotore
-­‐ devono codi[icare per un’attività enzimatica assente nella specie in esame e facilmente distinguibile da ogni altra attività enzimatica simile presente nella cellula
-­‐ l’attività della proteina codi[icata dal gene reporter non deve presentare com-­‐
petizione né interferenza con altre attività enzimatiche cellulari
-­‐ il saggio deve essere semplice, rapido, sensibile e riproducibile
Ci sono geni reporter il cui prodotto è dosabile senza sacri[icare l’organismo stu-­‐
diato, in quanto è secreto nei liquidi biologici (ad es. in urine, latte, sudore o altri secreti). Esistono inoltre geni reporter il cui prodotto proteico è intracellulare. Nella tabella che segue, sono riportati alcuni esempi di geni reporter con prodotti intracellulari.
13
Gene reporter Prodotto dell’atti-­‐
vità del gene
Substrato
Attività
GUS= uidA
β -­‐ g l u c u r o n i d a s i β-­‐glucuronidi
batterica
indicatore blu
β-­‐gal=lacZ
β -­‐galattosidasi
Indicatore blu
GFP
green [luorescent radiazione blu (in F l u o r e s c e n z a protein
Aequorea è emes-­‐ verde
sa dalla proteina equorina in pre-­‐
senza di ioni Ca++)
Luc
luciferasi della luc-­‐ Luciferina-­‐ATP-­‐ Emissione di luce ciola (Photinus py-­ ossigeno-­‐Mg++
verde/gialla
ralis)
Lux A e Lux B
luciferasi batterica
Luciferina (FMHH2) / aldei-­‐
de alifatica a ca-­‐
tena lunga / ossi-­‐
geno
Emissione di luce blu/verde
Ruc
luciferasi da Renilla Luciferina (Celen-­‐
reniformis
terazina) / ossi-­‐
geno / ioni Ca++
Emissione di luce blu
Galattosidi
Descrizione dell’attività dei prodotto dei geni reporter più utilizzati
Tra i più noti prodotti dei geni reporter sopra elencati descriviamo brevemente i seguenti.
1) GFP (Green Fluorescent Protein): è in grado di emettere luce di colore verde acceso se colpita da radiazione a speci[ica lunghezza d’onda; la sua scoperta, la sua modi[ica e il suo utilizzo hanno valso il premio Nobel per la chimica nel 2008 a Osamu Shimomura, Martin Chal[ie e Roger Y.Tsien. Nella medusa Aequorea victoria ([ig. 2.6.2), che vive lungo le coste del Paci[ico del Nord America, Shimomu-­‐
ra aveva scoperto già nel 1962 sia la proteina “aequori-­‐
na”, che mostrava vivida [luorescenza blu in presenza di ioni Ca++, sia la GFP, che aveva bisogno solo di luce blu o di raggi UV, ma non di ioni Ca++, per brillare di luce ver-­‐
de. La GFP infatti non emette luce in seguito a reazioni chimiche catalizzate da enzimi, ma “cambia” il colore della bioluminescenza da blu a verde nella medusa Ae !
quorea victoria. Nella proteina è presente una porzione Fig. 2.6.2 -­‐ La medusa di 3 amminoacidi, detta [luoroforo, ben protetta all’in-­‐ Aequorea victoria.
terno di una struttura a “barile” ([ig. 2.6.3): quando la radiazione blu (475 nm) o ultraviolettea (395 nm) col-­‐
14
pisce questo [luoroforo, alcuni suoi elettroni assorbono quest’energia per passare a un livello energetico superiore (stato eccitato) per poi ricadere nello stato fon-­‐
damentale emettendo radiazione a energia inferiore di colore verde (505 nm).
Fig. 2.6.3 -­‐ La struttura della GFP e meccanismo di eccitazioni degli elettroni.
Nel 1988 Chal[ie, lavorando sull’organismo modello Caenorhabditis elegans (Ne-­‐
matode), intuì che il gene per la GFP avrebbe potuto essere usato come gene re-­‐
porter di espressione per studiare la localizzazione e le funzioni di speci[iche pro-­‐
teine nelle cellule viventi. Nel 1994 Chal[ie e altri riuscirono a trasformare il bat-­‐
terio E. coli facendogli esprimere la GFP e in seguito a far produrre la stessa pro-­‐
teina da parte di sei speci[ici neuroni di C. elegans. Tuttavia la GFP wild type aveva dei limiti: era scarsamente foto-­‐stabile, presentava un doppio picco di eccitazione (luce blu a 475nm e UV a 395nm) e dif[icoltà nell’assumere una corretta confor-­‐
mazione (folding) a 37°C. A questi limiti Tsien riuscì ad ovviare modi[icando la proteina così da ottenere una [luorescenza più brillante nel verde e in colori di-­‐
versi dello spettro (azzurro, ciano, blu, giallo). Con l’utilizzo di queste GFP diverse si possono seguire più processi biologici contemporaneamente nello stesso indi-­‐
viduo in vivo. Infatti questi marcatori sono estremamente meno tossici di quelli tradizionali quali la [luorescina e la rodamina, così da poter diventare, oltre che reporter di espressione a bassa tossicità, anche ottimi bio-sensori, ad esempio:
-­‐ per l’individuazione di arsenico nell’acqua dei pozzi attraverso batteri resistenti all’arsenico e modi[icati in modo da poter esprimere la GFP in presenza dell’ele-­‐
mento tossico;
-­‐per l’individuazione di metalli pesanti (cadmio, zinco) o dell’esplosivo TNT (tri-­‐
nitrotoluene) sempre usando batteri modi[icati.
Resta il mistero ancor oggi (2009) da scoprire di quale sia la funzione [isiologica della GFP nella medusa da cui è stata isolata.
2) luciferasi
La luciferasi della lucciola è un enzima in grado di catalizzare la produzione di lu-­‐
ce a partire dall’ossidazione della proteina luciferina in presenza di ATP, ossigeno e ioni di Mg++ ([ig. 2.6.4).
Il metodo che utilizza il gene della luciferasi ha i vantaggi di essere molto sensibi-­‐
le, di non avere nessuna interferenza (perché la maggior parte delle cellule non ha attività di luciferasi), di essere altamente dinamica (possibilità di determinare bassi e alti livelli di espressione, la saturazione è a livelli molto alti di espressio-­‐
ne), di richiedere un saggio rapido e a bassi costi. Il gene migliore è quello della lucciola nord americana Photinus pyralis, la cui proteina non è tossica, non richie
15
!
!
Fig. 2.6.4 -­‐ Schema della reazione catalizzata dalla luciferasi della lucciola e Photinus pyralis.
de modi[icazioni post-­‐traduzionali e quindi funziona sia in cellule procariotiche che eucariotiche. In generale il vettore contenente il gene reporter viene trasfettato nelle cellule. Dopo un certo tempo le cellule sono lisate, nell'estratto cellulare si introducono: luciferina (il substrato della luciferasi), Mg e un eccesso di ATP. L'enzima luciferasi eventualmente espresso, catalizza la carbossilazione ossidativa della luciferina causando luminescenza (luce 560nm). Questo effetto può essere quanti[icato con un luminometro. La quantità di luce emessa è correlata direttamente con l'attività del promotore.
La luciferasi da Renilla reniformis, un Celenterato, è una ossigenasi che, in presen-­‐
za di ioni Ca++ e ATP eccita una luciferina, la Coelenterazina, che è il substrato del-­‐
l’enzima e produce luce blu ([ig. 2.6.5). !
!
Fig. 2.6.5 -­‐ Schema della reazione catalizzata dalla luciferasi di R. reniformis e foto della medusa.
Le attività della luciferasi della lucciola e di quella di Renilla possono essere com-­‐
binate in un unico saggio che utilizza entrambi i geni reporter.
3) β-­galattosidasi: enzima di Escherichia coli che fa apparire blu le cellule che lo esprimono se cresciute in presenza di un substrato chiamato X-­‐gal. La β-­‐galattosi-­‐
dasi scinde X-­‐gal in galattosio e 5-­‐bromo-­‐4-­‐cloro-­‐3-­‐idrossindolo, la cui forma os-­‐
sidata è responsabile del colore.
4) β-­glucuronidasi: enzima di Escherichia coli utilizzato nel saggio GUS, la tecni-­‐
ca di biologia molecolare vegetale più diffusa al mondo, ideata da R.A. Jefferson. L’enzima beta-­‐glucuronidasi è in grado di scindere derivati dell’acido glucoronico; se l’enzima viene fornito di speci[ici substrati incolori e non [luorescenti è in gra-­‐
do di renderli colorati o [luorescenti, dunque visibili all'operatore. Come substra-­‐
to di reazione si possono usare diverse sostanze. Per la colorazione istochimica viene utilizzato prevalentemente il 5-­‐bromo-­‐4-­‐cloro-­‐3-­‐indolil glucuronide (X-­‐Gluc -­‐ [ig. 2.6.6) che per idrolisi forma un precipitato indaco insolubile; per i saggi 16
!
Fig. 2.6.6 -­‐ Schema della reazione catalizzata dalla beta-­‐glucoronidasi su X-­‐Gluc.
quantitativi il p-­‐nitrofenil β-­‐D-­‐glucuronide (saggi spettrofotometrici) e il 4-­‐metilumbelliferil-­‐beta-­‐D-­‐glucuronide (saggi [luorimetrici).
Un organismo è adatto per il saggio GUS se non ha una propria attività beta-­‐glu-­‐
curonidasica o se questa attività è suf[icientemente bassa e il “rumore di fondo” è accettabile. Per questa ragione il saggio non può essere utilizzato nella maggior parte dei vertebrati e in molti molluschi. Nelle piante superiori, nei muschi, nelle alghe, nei funghi e in quasi tutti i batteri non c'è attività GUS endogena, per cui la tecnica può essere usata pro[icuamente.
17
3. SCOPO DELL' ESPERIMENTO
Lo scopo dell’esperimento è quello di valutare, attraverso piante di Arabidopsis thaliana geneticamente modi[icate, la presenza di cadmio nel suolo. 3.1 -­ Il costrutto genetico utilizzato per trasformare Arabidopsis
Tutte le esperienze saranno condotte con piante di Arabidopsis thaliana geneti-­‐
camente modi[icate che esprimono il gene reporter GUS (GUS = β-­‐Glucuronidasi, enzima di Escherichia coli , poco espresso nelle piante -­‐ [ig. 3.1.1).
Fig. 3.1.1 -­‐ Reazione catalizzata dalla beta-­‐glucoronidasi su X-­‐Gluc ed effetto fenotipico su pian-­‐
tine di Arabidopsis transgeniche.
La sua espressione è regolata dal promotore di un gene coinvolto nelle risposte delle piante alla presenza di cadmio ([ig. 3.1.2): Arabidopsis diventa quindi un bio-­‐
indicatore in grado di mettere in evidenza la presenza del metallo nel suolo.
Fig. 3.1.2 -­‐ Il costrutto genetico utilizzato.
18
3.2 -­ Allevamento delle piante
Le piante di Arabidopsis utilizzate sono ottenute in laboratorio seguendo diverse passaggi, indicati di seguito.
Sterilizzazione dei semi
I semi sono stati incubati in una soluzione 0,01 % (v/v) di tween 20 e mantenuti in agitazione a temperatura ambiente per un periodo di 20 min., al termine del quale è stato aggiunto un pari volume di ipoclorito di sodio (candeggina commer-­‐
ciale al 4 % di cloro attivo) quale agente sterilizzante; l’incubazione è stata pro-­‐
tratta, nelle medesime condizioni di temperatura e agitazione, per un ulteriore periodo di 5 min. Al termine del trattamento i semi sono stati lavati 2 volte con acqua distillata sterile per essere in[ine risospesi in 1 ml di acqua distillata sterile.
Semina, allevamento e trattamenti
La semina è avvenuta su piastra e in condizioni di sterilità. I semi sono stati depo-­‐
sti direttamente sulla super[icie di un opportuno terreno agarizzato (terreno completo, addizionato o meno con CdCl2 10 µM, composizione riportata in tabel-­‐
la) e lasciati crescere per 10 giorni in una camera di crescita mantenuta a 23 °C, con un fotoperiodo di 16 h.
NH4NO3
20,61 mM
CaCl2
2,99 mM
MgSO4
150 µM
MgCl2
-­‐
KNO3
18,79 mM
KH2PO4
1,25 mM
H3BO3
100 µM
Na2-­‐EDTA
100 µM
MnCl2
100 µM
ZnCl2
29,91 µM
Fe2(CH4O6)3
184 µM
CoCl2
0,110 µM
CuCl2
0,100 µM
(NH4)6Mo7O24
1,030 µM
KI
5 µM
saccarosio
10 g l-­‐1
agar
8 g l-­‐1
19
4. PARTE SPERIMENTALE
L’espressione del gene reporter GUS è analizzata in due modi:
-­‐ saggio istochimico;
-­‐ estrazione del RNA, retrotrascrizione e ampli[icazione del trascritto del gene GUS.
4.1 -­ Saggio istochimico
Il substrato commerciale utilizzato per questo tipo di saggio è l’acido 5-­‐bromo-­‐4-­‐cloro-­‐3-­‐indolil-­‐β-­‐D-­‐glucuronico (X-­‐Gluc). L’enzima β-­‐glucuronidasi è in grado di scindere questa molecola liberando una molecola di acido glucuronico e una molecola di 5-­‐bromo-­‐4-­‐cloro indaco, che in seguito a una reazione di dime-­‐
rizzazione ossidativa forma un precipitato insolubile e colorato (5,5’-­‐dibromo-­‐
4,4’-­‐dicloro indaco).
Al termine del periodo di crescita le plantule sono trasferite in eppendorf e tratta-­‐
te con la soluzione di colorazione contenente X-­‐Gluc. I tubi sono incubati per una notte a 37 °C e in assenza di luce. Al termine del periodo di incubazione si proce-­‐
de alla decolorazione dei tessuti con etanolo al 96 % (v/v) e quindi all’osserva-­‐
zione delle piante, con il [ine di evidenziare eventuali colorazioni indaco ([ig. 4.1.1). !
Fig. 4.1.1 -­‐ Piantine di Arabidopsis transgeniche in cui è espresso il gene GUS
4.2 -­ Estrazione dell’RNA e dosaggio spettrofotometrico del RNA totale
Viene estratto RNA a partire dalla macerazione di plantule di Arabidopsis cresciu-­‐
te in terreno con cadmio e in terreno di controllo senza cadmio.
Allo scopo di veri[icare la qualità del RNA estratto, un’aliquota della preparazione, viene sottoposta a separazione elettroforetica su gel di agarosio all’1 % in tam-­‐
pone TBE 1x . Al termine della corsa, il gel viene analizzato su transilluminatore UV.
20
4.3 – Analisi dell’espressione del gene reporter
Attraverso la tecnica RT-­‐PCR vengono prodotti cloni parziali di cDNA codi[icanti per il gene GUS e per un gene di controllo, S16. Quest’ultimo codi[ica per rRNA della subunità minore dei ribosomi di plastidi e mitocondri e serve come control-­‐
lo per veri[icare che la RT-­‐PCR abbia funzionato. Questa procedura combina la re-­‐
azione della trascrittasi inversa con una normale tecnica di ampli[icazione del DNA, per sintetizzare speci[iche molecole di cDNA, impiegando come stampo mRNA. Le coppie di primer utilizzate per l’ampli[icazione e le rispettive temperature di appaiamento (o annealing), indicate con (Ta) sono riportate in tabella.
Oligo
Sequenza
Num. di basi
GUSforw
ATTACGGCAAAGTGTGGGTC
20
GUSrev
CAGAAAAGCCGCCGACTTCG
20
S16forw
GGCGACTCAACCAGCTACTGA
21
S16rev
CGGTAACTCTTCTGGTAACGA
21
Ta (°C)
58
54
I prodotti di PCR vengono quindi visualizzati mediante corsa elettroforetica su gel di agarosio.
!
Fig. 4.3.1 -­‐ Foto dei risultati attesi. La foto del gel ([ig. 4.3.1) evidenzia il pro[ilo di espressione del gene GUS e del gene di riferimento S16 in piante cresciute in terreni completi in presenza (Cd) o assenza (C) di cadmio. 21
5. APPENDICI
5.1 -­ Legislazione: livelli inquinanti del Cadmio
Non esiste una de[inizione uf[iciale di metallo leggero o pesante da parte della IUPAC, l'autorità internazionale che [issa e aggiorna la nomenclatura e la termino-­‐
logia degli elementi e composti chimici, o da parte di organismi simili. Nonostante questo, numerosi articoli e pubblicazioni parlano genericamente di "metalli pe-­‐
santi" e "leggeri" omettendo una chiara de[inizione o dando de[inizioni in contra-­‐
sto tra loro basate sulla densità, sul peso atomico o altre proprietà chimiche.
Spesso all'aggettivo pesante è associato il concetto di tossicità anche se di per sé la densità di un metallo non ha un legame diretto con effetti sul corpo umano. La tossicità di una qualunque sostanza dipende dalla sua natura (esatto composto chimico) e dalla sua quantità. Un composto chimico può essere tossico pur essen-­‐
do formato da atomi di elementi chimici che presi singolarmente non lo sono, e viceversa. Inoltre una certa sostanza può essere ben tollerata o addirittura neces-­‐
saria se al di sotto di una certa quantità (minimum).
Metalli indicati come "pesanti" messi tipicamente in correlazione alla loro tossici-­‐
tà e bioaccumulazione nella catena alimentare sono: mercurio, cromo, cadmio, arsenico, piombo e recentemente uranio. Vediamo il caso del cadmio:
− Il cadmio è l'elemento chimico di numero atomico 48. Il suo simbolo è Cd. Non è un metallo di transizione, (perché gli elementi di transizione sono de[initi come gli elementi che al massimo numero di ossidazione formano almeno uno ione con un sottoguscio d parzialmente riempito), è tossico relativamente raro; tenero, bianco-­‐argenteo con ri[lessi azzurrognoli. Si trova nei minerali dello zinco e trova largo impiego per tre quarti nelle pile al nichel-­‐cadmio, mentre il quarto rimanen-­‐
te è principalmente usato per produrre pigmenti, rivestimenti e stabilizzanti per materie plastiche.
− Il cadmio non riveste alcun ruolo biologico nel corpo umano. Sia lui che i suoi composti sono tossici per[ino a basse concentrazioni e tendono ad accumularsi negli organismi e negli ecosistemi. La dose massima assumibile dal nostro corpo secondo l’OMS/FAO è di 7 μg/kg di peso corporeo alla settimana (Provisional To-­‐
lerable Weekly Intake, PTWI). − L'inalazione di polveri di cadmio provoca rapidamente problemi alle vie respira-­‐
torie ed ai reni, spesso fatali per insuf[icienza renale. L'ingestione provoca imme-­‐
diato avvelenamento e danneggia il fegato e i reni. I composti del cadmio sono cancerogeni. Oltre a danneggiare i reni causano anche osteoporosi e osteomala-­‐
chia.
− Nel maneggiare il cadmio e i suoi composti è importante lavorare sotto una cappa aspirante in modo da non inalarne i vapori.
− L'esposizione a lungo termine al cadmio dei lavoratori dei bagni galvanici per cadmiatura produce seri problemi di tossicità.
22
La normativa di riferimento oltre a quella italiana è fornita dall’OMS e dalle Diret-­‐
tive dell’UE I limiti massimi del Cadmio nelle acque sono:
-­‐ 5 μg/lt (acque potabili)
-­‐ 10 μg /lt (acque minerali)
Questa differenza è stata oggetto di polemiche perché autorizza in pratica ad im-­‐
bottigliare acque minerali con dosi di Cd maggiori di quelle ammesse nelle acque potabili
I limiti massimi di Cd negli alimenti sono i seguenti (Reg. CE n. 466/2001 e modi-­‐
[iche successive):
Cadmio (mg/kg peso fresco)
Alimenti
Carni di bovini, ovini, suini, pollame escluse frattaglie
0,05
Carne di cavallo
0,2
Fegato di bovini, ovini, suini, pollame
0,5
Rognoni di bovini, ovini, suini, pollame
1
Muscolo di pesce
0,05
Muscolo di sogliola cuneata, anguilla, alice, pesce gallo, 0,1
sgombro, cefalo, sarago fasciato, sardina, sardinops, tonno
Crostacei, escluse carni scure di granchio, testa o torace di 0,5
aragosta e analoghi grossi crostacei
Molluschi bivalvi
1
Cefalopodi (senza visceri) 1
Cereali, esclusi crusca, germi di frumento e riso
0,1
Crusca, germi di grano e riso
0,2
Germogli di soia
0,2
Ortaggi e frutta, esclusi ortaggi a foglia; erbe aromatiche, 0,05
tutti i tipi di funghi, ortaggi a stelo, ortaggi da radice e pa-­‐
tate
Ortaggi a foglia, erbe aromatiche, sedano rapa e tutti i 0,2
funghi coltivati
Ortaggi a stelo, ortaggi da radice e patate, escluso sedano 0,1
rapa. Nel caso delle patate ci si riferisce a patate sbucciate
23
5.2 -­ Le tecniche utilizzate
PCR (Polymerase Chain Reaction)
Si tratta di una tecnica innovativa che consiste nell’ampli[icazione speci[ica di tratti di DNA mediante reazioni a catena della DNA polimerasi. Il principio è molto semplice. Data una sequenza di DNA a doppio [ilamento e due corte sequenze oli-­‐
gonucleotidiche (primer), di cui una complementare ad un tratto di [ilamento ad una estremità del DNA da ampli[icare (forward primer) e l’altra complementare ad un altro tratto posto all’altra estremità (reverse primer), in presenza di una DNA polimerasi termostabile e di una miscela di desossinucleotidi trifosfati in appropriate condizioni di reazione, è possibile far copiare numerosissime volte il tratto compreso tra i due primer, semplicemente facendo variare ciclicamente la temperatura di reazione.
Infatti, raggiunta la temperatura di denaturazione (circa 95°C), la doppia elica si apre (fase di denaturazione), rendendo disponibile lo stampo per una eventuale sintesi delle catene complementari. Quando la temperatura si abbassa, in virtù delle loro minori dimensioni e della loro concentrazione, i primer si legheranno (fase di appaiamento o annealing) al DNA stampo prima che si rinaturi e, in pre-­‐
senza di una DNA polimerasi con un optimum di temperatura elevato (circa 72°C), inizierà la sintesi di DNA a partire dai primer (fase di sintesi del DNA o ex-­‐
tension), procedendo lungo i [ilamenti singoli.
Al termine del primo ciclo di PCR da una doppia elica di DNA se ne ottengono due. Ripetendo il ciclo "denaturazione – annealing – extension" numerose volte (in ge-­‐
nere da 20 a 30), si ottiene una massiccia ampli[icazione speci[ica di un dato trat-­‐
to di DNA che può quindi essere analizzato e studiato in dettaglio.
Il metodo di analisi del DNA mediante PCR presenta vantaggi molto evidenti:
-­‐ è molto rapido (da 60 a 90 minuti),
-­‐ la manualità è semplicissima,
-­‐ è automatizzato,
-­‐ i risultati sono visualizzabili con facilità mediante elettroforesi del DNA
Le Taq polimerasi
Il successo della PCR è stato possibile grazie anche all’uso di una DNA polimerasi termostabile estratta da batteri termo[ili (che vivono ad elevate temperature). Una DNA polimerasi utilizzata nelle reazioni della PCR è la Taq polimerasi, estrat-­‐
ta dal batterio Thermos aquaticus. L’isolamento di DNA polimerasi termostabili ha sollevato gli operatori dall’ingrato compito di aggiungere enzima fresco ad ogni ciclo di reazione!
La scelta dei primer
Per ogni PCR, è necessario usare due primer (forward e reverse). La scelta della coppia di primer è critica per una buona riuscita della PCR, ovvero per ottenere ampli[icazione speci[ica di un tratto di DNA. I primer devono essere “disegnati” a livello di sequenze uniche nel genoma (presenti una sola volta), in modo che pos-­‐
sano appaiarsi al DNA solo nella zona di interesse e non in altre zone.
RT-­PCR (Reverse Transcription Polymerase Chain Reaction)
Nella RT-­‐PCR l’ampli[icazione è preceduta da una retrotrascrizione, in cui l’enzi-­‐
ma trascrittasi inversa sintetizza molecole di cDNa a partire da RNA. La reazione 24
avviene a una temperatura compresa tra 40°C e 50°C, a seconda dell’enzima uti-­‐
lizzato. Si ottiene così un ibrido RNA-­‐DNA, da cui si rimuove l’RNA mediante una RNAsi. Quindi si procede con una PCR normale.
Elettroforesi
È una tecnica che consente di separare in base alle loro dimensioni (peso moleco-­‐
lare) molecole dotate di carica, facendole migrare su un gel in presenza di un campo elettrico. Il gel è costituito generalmente da agarosio e può essere immagi-­‐
nato come una rete tridimensionale attraverso le cui maglie migrano le molecole sotto l’azione di un campo elettrico. Il campo elettrico è generato da un apparec-­‐
chio, detto alimentatore o power supply. Le molecole di DNA sono cariche negati-­‐
vamente per la presenza di gruppi fosfato e migrano dal polo negativo verso il po-­‐
lo positivo.
Per un certo intervallo di pesi molecolari, la velocità di migrazione è funzione del peso molecolare: tanto più grande è la molecola, tanto minore è la velocità di mi-­‐
grazione. E viceversa, tanto più piccola è la molecola di DNA, tanto più velocemen-­‐
te migra. Le molecole di DNA di diversa lunghezza vengono pertanto separate in base alla diversa velocità di migrazione.
Per poter determinare la lunghezza delle molecole di DNA in esame precedente-­‐
mente separate mediante elettroforesi, viene “caricato” sul gel anche il cosiddetto marcatore di peso molecolare, ossia una miscela di frammenti di DNA di cui è no-­‐
to il peso molecolare. Confrontando la posizione dei frammenti a peso molecolare noto con quella dei frammenti di DNA in esame, è possibile calcolare il peso mole-­‐
colare di questi ultimi, ossia la loro lunghezza.
La separazione elettroforetica dura circa 30 min. -­‐ 1 ora. Al termine, i vari fram-­‐
menti di DNA, essendo incolori, possono essere visualizzati, immergendo il gel in un colorante. Il DNA delle diverse classi di peso molecolare è visibile sotto forma di bande distinte: sono le cosiddette bande di DNA .
In genere in laboratorio le bande si visualizzano esponendo il gel alla luce ultra-­‐
violetta. Questo è dovuto al fatto che, durante la preparazione del gel, all’agarosio è stato aggiunto il bromuro di etidio, una sostanza che ha la proprietà di legarsi al DNA e di emettere [luorescenza se esposta a luce UV. Il bromuro di etidio va ma-­‐
neggiato con estrema cautela in quanto è un agente intercalante del DNA e, come tale, ha proprietà mutagene.
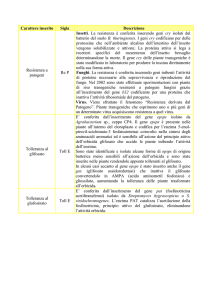
5.3 -­ Note di sicurezza
Qui di seguito sono elencate alcune norme elementari di sicurezza, che devono essere tassativamente rispettate.
− Entrando in laboratorio, individuare le vie di fuga, indicate dalla segnaletica verde;
− in laboratorio indossare sempre il camice. Il camice deve essere chiuso sul da-­‐
vanti, con maniche lunghe e polsini ad elastico. Al termine delle attività, prima di lasciare il laboratorio, togliersi il camice. In ogni caso, non uscire dal laboratorio, per recarsi in altre aree (biblioteca, uf[ici, bar, ecc.), senza aver prima tolto il ca-­‐
mice;
− non introdurre in laboratorio borse, zaini o altro materiale non necessario;
25
− spegnere i telefoni cellulari;
− in laboratorio è vietato mangiare, bere, fumare, portare oggetti alla bocca ed applicare cosmetici;
− se sono lunghi, legare i capelli;
− seguire scrupolosamente le indicazioni riportate nei protocolli di esperimento.
Utilizzazione del forno a microonde
− Non accendere il forno se è vuoto;
− non utilizzare il forno con materiali in[iammabili;
− non utilizzare il forno con recipienti sigillati (potrebbero esplodere): svitare i tappi delle bottiglie, rimuovere i coperchi;
− non utilizzare il forno con oggetti metallici o metallizzati: (es. bottiglie coperte di stagnola) e con carta d’argento;
− non riempire eccessivamente i recipienti: il liquido bollendo, potrebbe traboc-­‐
care;
− proporzionare la potenza e il tempo di riscaldamento al contenuto in acqua di quanto viene riscaldato. In particolare, nel caso di soluzioni acquose, il liquido po-­‐
trebbe surriscaldarsi oltre il punto di ebollizione, senza che appaiano bollicine. Ciò può portare al traboccamento improvviso di liquido bollente. Per prevenire questo pericolo, mescolare il liquido prima di scaldarlo e lasciarlo riposare per qualche minuto prima di togliere il recipiente dal forno;
− in caso di incendio del contenuto del forno, tenere chiusa la porta, spegnere il forno, staccare la spina dalla presa di corrente lasciando che il fuoco si estingua per soffocamento.
Utilizzazione dell’apparecchiatura per elettroforesi
− Assicurarsi che l’alimentatore sia spento, prima di collegare i morsetti;
− assicurarsi che il coperchio della vaschetta sia correttamente posizionato, prima di collegare i morsetti;
− prima di rimuovere il coperchio della cella elettroforetica, spegnere l’alimenta-­‐
tore e staccare i morsetti.
Utilizzazione della centrifuga
− Chiudere accuratamente il tappo delle provette, per evitare la fuoriuscita di li-­‐
quido e la formazione di aerosol;
− assicurarsi che il rotore sia bilanciato: provette di ugual peso devono essere in-­‐
serite negli alloggiamenti diametralmente opposti;
− chiudere il coperchio della centrifuga prima di avviarla;
− non cercare di aprire il coperchio prima del completo arresto del rotore. In caso di fuoriuscita dei liquidi dalle provette, avvertire il personale docente.
Smaltimento dei riLiuti
− Tutto il materiale monouso (puntali, provette, pipette ecc.) va messo in appositi contenitori per ri[iuti;
− cercare di ridurre al minimo il materiale da eliminare, visto i costi elevati del loro smaltimento.
26
Manipolazione dell’etidio bromuro (sostanza mutagena)
− Usare i guanti “disposable”;
− evitare di spargere il prodotto sul banco di lavoro;
− terminata l’utilizzazione del prodotto o delle sue soluzioni, provvedere allo smaltimento tenendo presente che le soluzioni di etidio bromuro vanno raccolte nell’apposito contenitore.
Manipolazione del fenolo
− Lavorare sotto cappa chimica;
− usare i guanti “disposable”;
− evitare di spargere il prodotto sul banco di lavoro.
27