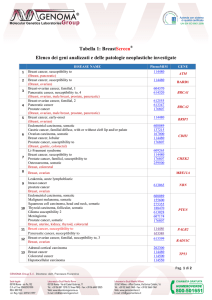
Registro Tumori Canton Ticino
Istituto Cantonale di Patologia
IL TUMORE DELLA MAMMELLA
Epidemiologia
Il tumore della mammella è la neoplasia di gran lunga più frequente tra le donne nel mondo, in
particolare nei paesi industrializzati, rappresentando più del 20% del complesso delle diagnosi
tumorali.
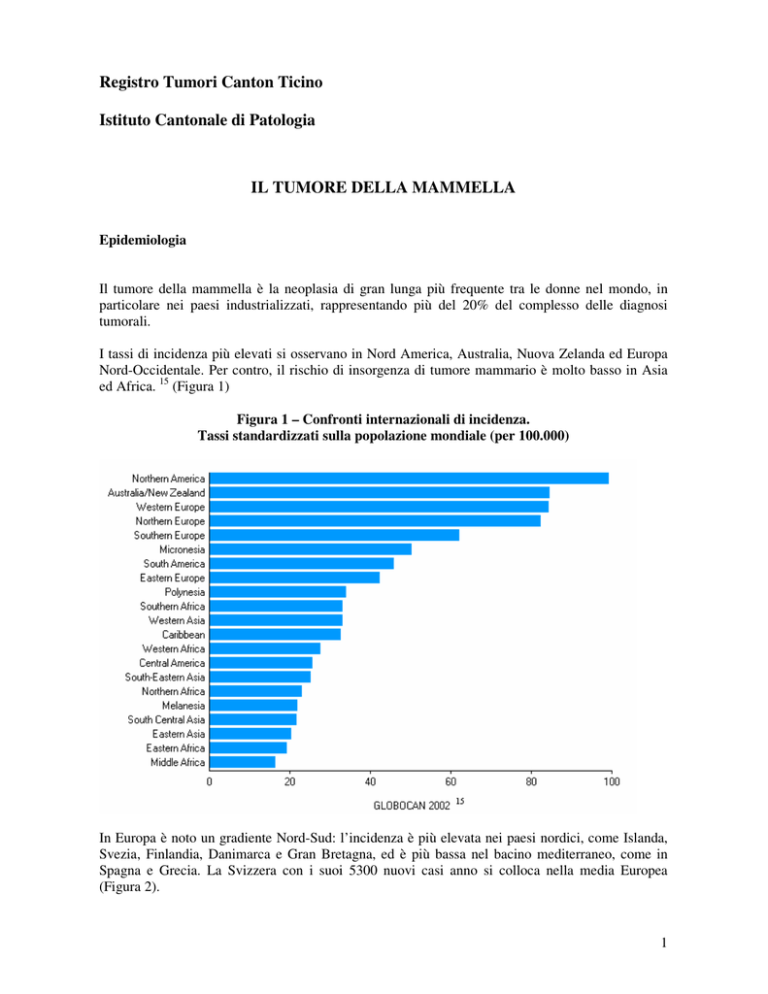
I tassi di incidenza più elevati si osservano in Nord America, Australia, Nuova Zelanda ed Europa
Nord-Occidentale. Per contro, il rischio di insorgenza di tumore mammario è molto basso in Asia
ed Africa. 15 (Figura 1)
Figura 1 – Confronti internazionali di incidenza.
Tassi standardizzati sulla popolazione mondiale (per 100.000)
In Europa è noto un gradiente Nord-Sud: l’incidenza è più elevata nei paesi nordici, come Islanda,
Svezia, Finlandia, Danimarca e Gran Bretagna, ed è più bassa nel bacino mediterraneo, come in
Spagna e Grecia. La Svizzera con i suoi 5300 nuovi casi anno si colloca nella media Europea
(Figura 2).
1
Figura 2 – Confronti europei di incidenza.
Tassi standardizzati sulla popolazione mondiale (per 100.000)
In Ticino ogni anno circa 250 donne ammalano di tumore mammario, dato che espresso in termini
di tasso di incidenza standardizzato sulla popolazione europea è pari a 115 casi ogni 100.000
abitanti (periodo di riferimento 2002-2005).
Dal confronto dei tassi di incidenza con alcuni Registri Tumori di zone limitrofe, si osserva che il
Ticino si colloca ad un livello inferiore rispetto alla realtà ginevrina, ma in media rispetto al dato
nazionale e a quello italiano. 1, 2 (Figura 3).
Figura 3 – Confronti di incidenza con alcuni Registri Tumori di zone limitrofe.
Tassi standardizzati sulla popolazione europea (per 100.000) – Donne
2
I trend di incidenza evidenziano in Ticino, come nel resto della Svizzera e negli altri paesi
occidentali, un andamento crescente. 2 Tale scenario può essere in parte spiegato dal vero aumento
del rischio di insorgenza di tumori della mammella nella popolazione; tuttavia, è anche il risultato
dell'
anticipazione diagnostica dei tumori trovati prima grazie alla maggiore sensibilità degli
strumenti diagnostici, o segnalati prima (e con maggior frequenza) dalle persone in conseguenza
della loro accresciuta attenzione alla propria e altrui salute (screening spontaneo). (Figura 4A)
Figura 4A – Trend di incidenza in Ticino e Svizzera.
Tassi standardizzati sulla popolazione europea (per 100,000)
Se si considera l’andamento dei tassi di incidenza specifici per classi d’età, spicca il dato delle
donne tra i 50 e i 69 anni, popolazione target dello screening mammografico. (Figura 4B)
Figura 4B – Trend di incidenza per classi d’età in Ticino e Svizzera.
Tassi specifici per età (per 100,000)
A differenza dei trend di incidenza che sono in aumento, i tassi di mortalità in Ticino e in Svizzera
sono in diminuzione (Figura 5). Questo scenario è confermato anche quando si considerano le
diverse classi d’età (dato del solo Ticino).
3
Figura 5 – Trend di mortalità in Ticino e Svizzera.
Tassi standardizzati sulla popolazione mondiale (per 100.000)
Un ultimo aspetto non meno importante è rappresentato dai dati di sopravvivenza. Nonostante
l‘elevato rischio di insorgenza, i tumori della mammella sono caratterizzati da una buona prognosi,
con livelli di sopravvivenza che superano l'
80% a 5 anni dalla diagnosi.
La Figura 6 mostra la sopravvivenza a 5 anni dalla diagnosi dei casi diagnosticati in Europa
dall’inizio degli anni ’80 all’inizio degli anni ’90: il trend è ovunque in aumento, a conferma degli
importanti progressi dei metodi di cura e diagnosi (per immagini, chirurgici e di anatomo patologia) e della diffusione dei programmi di screening che si sono realizzati negli ultimi decenni.
Tale aumento è più evidente nell’Europa Nord-Occidentale rispetto all’Europa dell’Est, dove si
osservano i livelli più bassi. 7
Figura 6 – Trend di sopravvivenza in Europa.
Sopravvivenza relativa a 5 anni dalla diagnosi (%)
EUROCARE 3 Study
4
Il Registro Tumori ha collaborato con l'
Associazione Svizzera Registri Tumori (ASRT) alla
conduzione di uno studio ad hoc sulla sopravvivenza di circa 11300 casi di tumore al seno
diagnosticati in Svizzera tra il 1988 e il 1998. 16 La casistica ticinese comprendeva 626 casi di
carcinoma mammario relativi al periodo 1996-98. Dall’analisi è emerso che in Ticino circa la metà
dei casi è diagnosticata quando le dimensioni del tumore sono inferiori o uguali a 2 cm (pT1), dato
che è nettamente superiore rispetto alla media nazionale (49.7% vs 43.0%); per contro, la
percentuale di carcinomi di grandi dimensioni, ben oltre i 5 cm (pT4), è di poco inferiore alla media
nazionale (9.6% vs 10%). Questi risultati si traducono in una proporzione di sopravviventi a 5 anni
dalla diagnosi pari all'
84%, raggiungendo il 90% nel gruppo delle donne tra 45 e 54 anni, dati in
linea con i Registri Tumori di Ginevra e Basilea e superiori a quelli ottenuti nel resto della Svizzera.
Sulla base di tali differenze intercantonali è stato avviato alla fine del 2006 un secondo studio molto
più dettagliato con lo scopo di valutare la relazione tra i risultati di sopravvivenza e l’offerta
sanitaria rivolta alla popolazione di riferimento. Il progetto è finanziato da parte di OncoSuisse e
della Lega Cancro Svizzera.
5
Eziologia
Le cause precise dell’insorgenza del carcinoma della mammella non sono ancora note. Si conosce,
invece, una serie di cosiddetti fattori di rischio, in presenza dei quali aumentano le probabilità di
insorgenza di tali neoplasie. 26, 48, 67, 69 Oltre all’età che rappresenta, come nella maggioranza dei
tumori, il fattore di rischio più importante (l’80% dei tumori del seno colpisce donne con età
superiore ai 50 anni), qui di seguito sono riportati i principali fattori di rischio, schematizzati anche
in Figura 7.
Fattori riproduttivi ed ormonali
Numerosi studi hanno mostrato una relazione tra i fattori riproduttivi e il rischio di insorgenza di
tumore mammario. In particolare, il rischio aumenta con il decremento dell’età al primo menarca,
con l’aumento dell’età alla prima gravidanza portata a termine, con il decremento del numero di
figli e con l’aumento dell’età alla menopausa. 6, 22 Un ruolo protettivo è, invece, rappresentato
dall’allattamento: anche se l’associazione non è forte, sembra ridurre il rischio di insorgenza di
tumori mammari.
Un ulteriore aspetto importante da esaminare è il ruolo dei contraccettivi orali: da alcuni studi è
emerso che il loro uso passato e prolungato (più di 10 anni) in età molto giovani sembra aumentare
il rischio di carcinoma mammario nel periodo post-menopausa. 71 Tuttavia, è noto che entro i 10
anni successivi al momento della cessazione, il rischio sembra essere simile rispetto a quello delle
donne che non ne hanno mai fatto uso. 30
Infine, come dimostrato in numerosi studi di coorte e caso-controllo, anche la terapia ormonale
sostitutiva post-menopausa per periodi superiori o uguali a 5 anni è correlata ad un lieve aumento
del rischio di tumore mammario. Per contro, non sono disponibili sufficienti dati per valutare
l’effetto della dose e del tipo di composizione dei farmaci assunti nella variazione del rischio. 30
Fattori dietetici
Le donne che hanno seguito una dieta di tipo occidentale (in particolare in relazione alle neoplasie
post-menopausali), presentano un rischio maggiore di tumore mammario. I grassi saturi (contenuti
in prevalenza nelle carni rosse o nel burro) ne sarebbero infatti i principali responsabili. Per contro,
le fibre (contenute nei vegetali e nei cereali non raffinati) hanno una funzione protettiva in quanto
riducono il riassorbimento intestinale degli estrogeni. Tuttavia l’associazione tra il rischio e la dieta
sembra essere piuttosto debole. 10, 49, 65-67
Infine, anche l’obesità dopo la menopausa rappresenta un fattore di rischio importante dei tumori
mammari (RR 1.1-2.0), oltre alle note conseguenze sul sistema cardio-vascolare. 26
Fattori antropometrici
Numerosi fattori antropometrici possono avere un ruolo importante nel rischio di tumore
mammario. L’aumento dell’altezza è associato ad un aumento del rischio sia prima sia dopo la
menopausa. L’aumento del peso (misurato dall’indice di massa corporea - BMI) diminuisce il
rischio prima della menopausa, ma lo aumenta dopo la menopausa. 20
Fattori familiari e predisposizione genetica
Le donne con una storia familiare di tumore mammario hanno un rischio maggiore di ammalarsi.
Sulla base di 52 studi epidemiologici è emerso che avere un parente di primo grado (madre, sorella,
figlia) con carcinoma mammario aumenta il rischio di circa l’80%, averne due di primo grado
aumenta il rischio di circa tre volte; in caso di 3 o più parenti di primo grado con carcinoma
mammario il rischio diventa quadruplo rispetto alla popolazione generale, ovvero senza familiarità.8
Tali risultati devono essere considerati come una predisposizione dei componenti di una famiglia a
sviluppare il tumore e non vanno confusi con la vera e propria ereditarietà, che interessa un numero
6
molto limitato di casi di neoplasia mammaria. La predisposizione genetica consiste principalmente
nella mutazione dei geni BRCA1 e BRCA2. Si stima che nei paesi occidentali circa il 10% dei
tumori mammari sia dovuto a tali mutazioni genetiche. Nonostante la rarità di tali alterazioni, le
famiglie nelle quali si siano verificati più casi di neoplasia mammaria può essere utile eseguire i test
genetici necessari a identificare la presenza della mutazione, per poter predisporre un piano di
prevenzione e diagnosi precoce particolarmente accurato.
Fattori ambientali
Gli effetti cancerogeni sulla salute dell’esposizione acuta o prolungata nel tempo a radiazioni
ionizzanti (di origine ambientale, industriale o medica) sono stati valutati in modo approfondito in
numerosi studi epidemiologici condotti in particolare sulla popolazione sopravvissuta ai disastri
nucleari avvenuti in Giappone durante la seconda guerra mondiale o a Chernobyl nel 1986. 67
Anche i pazienti esposti in giovane età a radiazioni per la sorveglianza e cura di alcune malattie (per
esempio, la radioterapia eseguita nell’area toracica per malattia di Hodgkin o per mastite post-parto,
radiografie del torace ripetute nel tempo per alcune malattie polmonari, come la tubercolosi)
presentano un rischio maggiore di sviluppare un tumore (nella fattispecie un tumore mammario)
negli anni successivi all’esposizione. 67
Consumo di tabacco e alcool
Mentre i dati epidemiologici circa il ruolo del fumo di tabacco sono ancora inconsistenti, il
consumo di alcool sembra essere associato positivamente al rischio di insorgenza di tumore
mammario: un’analisi congiunta di 53 studi epidemiologici condotta su più di 58000 donne con
tumore mammario ha mostrato che un consumo giornaliero di circa 50 g di alcool è associato ad un
rischio relativo pari a 1.5 (intervalli di confidenza: 1.3-1.6). 9 Anche con un consumo giornaliero di
18 g di alcool esiste un piccolo ma statisticamente significativo aumento del rischio relativo rispetto
al gruppo di donne non consumatrici di alcool. 31
Malattie benigne della mammella
La malattia fibrocistica della mammella è associata ad un aumento del rischio di sviluppare nel
tempo un carcinoma. Tale rischio varia rispetto al tipo istologico considerato: i maggiori livelli sono
stati osservati per la malattia fibrocistica proliferativa (RR: 2.0-4.0) e per l’iperplasia duttale atipica
(RR>4.0). 26
Pregressa storia di carcinoma mammario
Le donne già colpite da un carcinoma della mammella in-situ o invasivo sono più esposte al rischio
di un nuovo tumore invasivo (RR 2.0-4.0). 26
7
Figura 7. Fattori di rischio e fattori protettivi associati ad un aumento ( ) o diminuzione ( )
del rischio di insorgenza di tumore mammario.
Fattori riproduttivi e ormonali
-Menarca precoce
-Menopausa tardiva
-Nulliparità
-Età avanzata alla prima gravidanza portata a termine
-Decremento del numero di figli
-Allattamento
-Contraccettivi orali
-Terapia ormonale sostitutiva post-menopausa
Fattori dietetici e antropometrici
-Aumento del peso / Obesità (post-menopausa)
-Aumento dell’altezza
-Dieta occidentale
-Elevato apporto di fibre, frutta e verdura fresche
-Consumo di alcool
-Attività fisica
TUMORE DELLA MAMMELLA
Fattori ambientali
-Radiazioni ionizzanti al momento dello
sviluppo della mammella
Fattori familiari e genetici
-Storia familiare: parenti di primo grado con
carcinoma mammario
-Mutazione dei geni BRCA1 e BRCA2
Malattie benigne della mammella
- Malattia fibrocistica proliferativa
- Iperplasia duttale atipica
Pregressa storia di carcinoma mammario
8
Prevenzione Primaria
In generale la prevenzione primaria consiste nell’identificazione e successivamente riduzione o
eliminazione dell’esposizione ai fattori di rischio che determinano l’insorgenza della malattia.
Come precedentemente illustrato, nel caso del tumore mammario numerosi sono i fattori che
possono aumentare il rischio di ammalarsi (Figura 7). Nonostante la lista di tali fattori sia
relativamente lunga, meno del 30-40% dei casi di tumore mammario può essere attribuito ai
principali fattori di rischio. Infatti, la maggior parte delle donne con uno o più fattori di rischio non
necessariamente sviluppa un tumore mammario, con l’eccezione della piccola percentuale di donne
appartenenti a famiglie con la sindrome dei tumori ereditari. 26
Il tumore della mammella è una neoplasia per cui non sempre è possibile intervenire in termini di
prevenzione primaria. L’età del primo menarca e della menopausa, la durata dell’allattamento, il
numero di figli, l’età alla prima gravidanza portata a termine, l’esposizione a radiazioni ionizzanti,
sono tutti fattori poco o per nulla gestibili. Esistono poi alcuni fattori, come l’uso di contraccettivi
orali, il consumo di alcool, la dieta e l’attività fisica, su cui è possibile intervenire. Le donne che
consumano molte bevande alcoliche dovrebbero limitarne o cessarne l’uso; le donne che soffrono di
obesità dovrebbero cercare di dimagrire, seguendo una dieta ricca di verdure e frutta fresca,
favorendo l’attività fisica e riducendo il consumo di grassi animali.
Infine, per quanto riguarda la pregressa storia di carcinoma mammario (in situ o invasivo), la
presenza di malattie benigne della mammella (come la malattia fibrocistica proliferativa e
l’iperplasia duttale atipica) e la presenza di mutazioni genetiche, sono in studio sistemi di
prevenzione primaria, quali la mastectomia sottocutanea o radicale con ricostruzione estetica
(approccio più diffuso in USA) o la farmavigilanza (approccio più conservativo). 21 Quest’ultima
consiste nell’assunzione regolare di un farmaco non steroideo con proprietà antiestrogeniche, il
Tamoxifen, che può causare alcuni effetti avversi, quali vampate di calore, nausea e vomito,
oligomenorrea, amenorrea, iperplasia endometriale, cisti ovariche, fibromi, secchezza e perdite
vaginali, prurito vulvare, dolore osseo e tumorale, ipercalcemia, depressione, vertigini, mal di testa,
alopecia, rash, disturbi epatici, cataratta, leucopenia, trombocitopenia, neutropenia, trombosi venosa
profonda ed embolia polmonare. 53 Eric Wooltorton ha condotto un’analisi su alcuni studi clinici
che analizzano il ruolo del tamoxifene nella chemioprevenzione del cancro della mammella. 72 Per
il trial, chiamato National Surgical Adjuvant Breast and Bowel Project (NSABP), sono state
arruolate 13.388 donne ad alto rischio (cioè quelle con un rischio a 5 anni superiore a 1,67%), di
oltre 35 anni di età, a cui è stato assegnato in modo casuale il tamoxifene o il placebo, da assumere
per un periodo di 5 anni. 54 I risultati del trial hanno mostrato che il cancro della mammella invasivo
era meno comune nel gruppo del tamoxifene rispetto al gruppo del placebo (3,4 vs 6,8 per 1000
donne/anno, RR 0,51 95% IC 0,39-0,66). Tuttavia, 2 studi più piccoli, l’Italian Tamoxifen
Prevention Study, con 5.408 donne arruolate, ed il Royal Marsden Hospital Tamoxifen Randomized
Chemoprevention Trial, con 2.471 donne, non sono giunti alle stesse conclusioni (RR 0,92 e 0,94,
rispettivamente). 39 Alla luce di tali risultati, è possibile affermare che si tratta di sistemi preventivi
ancora in valutazione, sia in termini di efficacia sia in termini di rapporto tra i rischi e i benefici
legati alla terapia con tamoxifene.
Prevenzione Secondaria
Poiché non esiste (o è di difficile realizzazione) una prevenzione primaria vera e propria del
carcinoma della mammella, è importante ricorrere alla prevenzione secondaria, che si identifica con
la diagnosi precoce di un tumore, cioè la sua individuazione in una fase iniziale, limitata per
dimensioni e localizzazione, che consente un intervento terapeutico tempestivo e una riduzione del
rischio di insorgenza metastasi e/o di somministrazione di terapia ad alte dosi. Oltre agli importanti
progressi dei metodi di diagnosi (per immagini, chirurgici e di anatomo - patologia) che si sono
realizzati negli ultimi decenni, lo strumento principale di prevenzione secondaria dei tumori
mammari è rappresentato dallo screening mammografico. Si tratta di un’iniziativa di prevenzione
che consiste nell’offrire gratuitamente alla popolazione (donne tra 50-69 anni) una mammografia
9
con cadenza biennale, con lo scopo di diagnosticare la malattia in una fase molto precoce del suo
sviluppo, prima cioè che si manifesti.
E’ attualmente in discussione la possibilità di ampliare la finestra d’età per lo screening
mammografico e portare il limite inferiore a 40 anni. Recenti evidenze suggeriscono che, con una
mammografia di buona qualità e un intervallo temporale più ravvicinato, il beneficio in termini di
riduzione percentuale della mortalità nelle donne in età 40-49 potrebbe essere equivalente a quello
ottenibile nelle donne oltre i 50 anni. D’altra parte nelle donne più giovani il rapporto costi-benefici
potrebbe risultare meno favorevole, a causa della minore incidenza di tumori, della maggiore
proporzione di lesioni benigne e di possibile sovradiagnosi. Ecco perché il vantaggio di uno
screening prima della menopausa è ancora molto dubbio, considerati anche i risultati non ancora
soddisfacenti di alcuni studi randomizzati che hanno evidenziato una riduzione della mortalità, però
non significativa. 3, 58, 60
E’, infine, in valutazione anche la possibilità di estendere i programmi di screening mammografico
alla fascia di età 70-74 anni, in considerazione della maggiore attesa di vita delle donne, della
elevata incidenza e mortalità dei carcinomi mammari e della crescente disponibilità di trattamenti
efficaci. Tuttavia, non sono presenti ancora evidenze scientifiche sufficienti circa l’efficacia dello
screening mammografico nelle donne anziane. 33
Attualmente in Svizzera sei cantoni dispongono di un programma di screening: Friborgo, Ginevra,
Giura, Vaud, Vallese e, dal 2007, Neuchâtel; nel cantone di San Gallo è ancora in valutazione la
possibilità di attivarne uno. Nel quadro di questi programmi di screening tutte le donne fra i 50 e i
69 anni residenti nel cantone sono invitate a eseguire una mammografia ogni due anni. Le donne
decidono in tutta autonomia se approfittare di questa prestazione, sapendo che i costi per le
mammografie di screening sono coperti dagli assicuratori malattia e dai cantoni. La Lega svizzera
contro il cancro raccomanda e sostiene gli screening mammografici, effettuati secondo le norme di
qualità europee, aderendo così alla posizione dell’Organizzazione Mondiale della Sanità (OMS). La
Lega svizzera contro il cancro ritiene, quindi, che i benefici dei programmi di screening prevalgano
sugli svantaggi e che i programmi di screening rivestano grande importanza anche dal profilo
sociale.
A parte i cantoni citati sopra in cui è attivo un programma di screening, nel resto della Svizzera,
invece, esiste unicamente una forma di screening spontaneo od opportunistico, che si basa su
controlli regolari promossi dall’iniziativa personale delle donne.
Come è possibile valutare il buon funzionamento di un programma di screening attraverso il
contributo di un Registro Tumori?
Innanzitutto è bene sottolineare l’importanza della dimensione temporale nella valutazione di un
programma di screening: sono necessari molti anni per poter cominciare a misurarne i benefici.
In generale, laddove è presente un programma di screening ciò che si dovrebbe osservare è l’iniziale
aumento dell’incidenza, dovuto alla scoperta di un numero maggiore di forme in situ o invasive di
piccole dimensioni, andamento che col passare del tempo dovrebbe raggiungere una certa stabilità,
per poi cominciare a diminuire. Ad oggi i trend di incidenza sono ovunque ancora in aumento, ad
eccezione di quanto recentemente riportato in uno studio americano su base di popolazione (dati di
9 Registri Tumori, SEER) che evidenzia a partire dal 2003 un decremento significativo del trend di
incidenza tra le donne di età uguale o superiore a 50 anni e soprattutto dei tumori che presentano
recettori estrogenici positivi. 59 Dopo aver analizzato tutti i possibili fattori potenzialmente
responsabili del decremento di incidenza osservato gli autori sostengono che sia attribuibile
soprattutto al drastico calo dell’uso della terapia ormonale sostitutiva tra le donne americane nel
periodo post-menopausale. Tale fenomeno è avvenuto in conseguenza dei risultati pubblicati di uno
studio clinico randomizzato che evidenziano un rischio maggiore di insorgenza di tumore
mammario nelle donne che hanno assunto terapia ormonale sostitutiva dopo la menopausa.
Un secondo effetto di un programma di screening non meno importante è rappresentato dal
decremento della mortalità. 31 Alcuni studi hanno quantificato tale fenomeno, come la Review
condotta da Goetsche e Nielsen su sei studi clinici randomizzati avviati in Nord-America e Nord10
Europa. 25 Gli autori hanno stimato globalmente una riduzione significativa della mortalità pari al
20% a 13 anni dalla diagnosi (rischio relativo di 0.80 con intervalli di confidenza: 0.73-0.88).
Parallelamente ci si aspetta un miglioramento della sopravvivenza: come noto, le prospettive di
guarigione / remissione variano a seconda dello stadio della malattia (metastasi, dimensioni del
tumore) e, quindi, dalla sua aggressività. Le condizioni più favorevoli si osservano nella fase
precoce, quando il tumore è di piccole dimensioni, i linfonodi non sono compromessi e non
sussistono indizi di una particolare aggressività del tumore. Per tale motivo, le visite preventive
sono tanto importanti, come pure l’auto-esame del seno per la scoperta di alterazioni sospette e
insolite del tessuto mammario da sottoporre a ulteriori analisi, con la consapevolezza di migliorare
l’efficacia delle terapie e la probabilità di sopravvivenza in caso di lesioni tumorali.
Infine, tra gli indicatori e standards utili per la valutazione di processo dei programmi di screening
del cancro della mammella, qui di seguito ne sono riportanti due, che possono essere facilmente
ricavati nell’ambito dell’attività di un Registro Tumori: 23
– la proporzione di tumori in situ, che deve variare tra il 10-20% della totalità dei casi;
– la proporzione di casi con diametro del tumore <=10mm, che deve essere uguale o superiore al
25% dei casi.
In Ticino, dove è presente uno screening mammografico di tipo opportunistico, la proporzione di
carcinomi in situ è più bassa rispetto a ciò che è stato osservato dai Registri Tumori Americani su
base di popolazione (6% vs 16.2%) e rispetto ai risultati ottenuti nell’ambito di programmi di
screening controllati che osservano solo le donne tra 50-69 anni, come quello del Canton Vaud
(20.3). 23, 56 Anche la proporzione dei carcinomi invasivi con diametro 1cm osservata in Ticino è
ben al di sotto delle direttive europee (15% vs 25%).
In conclusione, dal momento che la maggior parte dei tumori della mammella colpisce persone che
non presentano nessun fattore di rischio, tutte le donne dovrebbero sottoporsi regolarmente ad una
visita senologica e, a partire da una certa età (oltre i 50 anni), ad esame mammografico, al fine di
essere consigliate da un medico competente nella prevenzione del tumore della mammella.
11
Referenze
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
AIRT – Associazione Italiana Registri Tumori, http://www.registri-tumori.it/
ASRT – Associazione Svizzera Registri Tumori, http://asrt.ch/
Armstrong K, Moye E, Williams S, Berlin JA, Reynolds EE. Screening Mammography in
Women 40 to 49 Years of Age: A Systematic Review for the American College of Physicians.
Ann Intern Med. 2007;146:516-526.
Berrino F, Capocaccia R, Esteve J, et al. (eds) Survival of cancer patients in Europe: the
EUROCARE-2 study. IARC Scientific Publication No. 151. Lyon: IARC, 1999.
Brewster A, Helzlsouer K. Breast cancer epidemiology, prevention, and early detection.
Current Opinion in Oncology 2001; 13:420-25.
Clavel-Chapelon F and the E3N-EPIC Group. Differential effects of reproductive factors on
the risk of pre- and postmenopausal breast cancer. Results from a large cohort of French
women. Br J Cancer 2002; 86:723-7.
Coleman MP, Gatta G, Verdecchia A, Estive J, Sant M, Storm H, Allemani C, Ciccolallo L,
Santaquilani M, Berrino F and the EUROCARE Working Group. EUROCARE-3 summary:
cancer survival in Europe at the end of the 20th century. Ann of Oncol 2003; 14 (Supplement
5): v128–v149.
Collaborative Group on Hormonal Factors in Breast Cancer (CGHFBC). Familial breast
cancer: collaborative reanalysis of individual data from 52 epidemiological studies including
58209 women with breast cancer and 101986 women without the disease. Lancet 2001;
358:1389-99.
Collaborative Group on Hormonal Factors in Breast Cancer (CGHFBC). Alcohol, tobacco and
breast cancer – collaborative reanalysis of individual data from 53 epidemiological studies,
including 58515 women with breast cancer and 95067 women without the disease. Br J
Cancer 2002; 87:1234-45.
Dai Q, Shu X, Jin F. Consumption of animal foods, cooking methods, and risk of breast
cancer. Cancer Epidemiol Biomarkers Prev 2002; 11:801-8.
DSS
Ufficio
di
Promozione
e
Valutazione
Sanitaria,
http://www.ti.ch/DSS/DSP/SezS/UffPVS/
Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Tamoxifen for early breast
cancer: an overview of the randomised trials. Lancet 1998; 351:1451-67.
Emery J, Lucassen A, Murphy M. Common hereditary cancers and implications for primary
care. Lancet 2001; 358:56-63.
European Network of Cancer Registries (ENCR). Eurocim version 4.0, European incidence
database V2.3, ICD-10 dictionary. Lyon: IARC, 2001.
Ferlay J, Bray F, Pisani P, Parkin DM. GLOBOCAN 2002, Cancer Incidence, Mortality and
Prevalence Worldwide. IARC CancerBase No. 5, version 2.0. Lyon: IARCPress, 2004.
Fish T, Pury P, Probst N, Bordoni A, Bouchardy C, Frick H, Jundt G, De Weck D, Perret E,
Lutz JM. Variation in survival after diagnosis of breast cancer in Switzerland. Ann Oncol.
2005 Dec;16(12):1882-8.
Fisher B, Constantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast cancer:
report of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer
Inst 1998; 90:1371-88.
Fisher B, Dignam J, Wolmark N, et al. Tamoxifen in treatment of intraductal breast cancer:
National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial.
Lancet 1999; 353:1993-2000.
Forum svizzero sul cancro del seno, http://www.europadonna.ch/
Friedenreich CM. Review of anthropometric factors and breast cancer risk. Eur J Cancer Prev
2001; 10:15-32.
Gail MH et al. Weighing the risks and benefits of tamoxifen treatment for preventing breast
cancer. J Natl Cancer Inst 1999; 91: 1829-46.
12
22. Gao Y-T, Shu X-O, Dai Q, et al. Association of menstrual and reproductive factors with
breast cancer risk: results from the Shanghai breast cancer study. Int J Cancer 2000; 87:295300.
23. Giordano L, Giorgi D, Frigerio A, Brevetti P, Paci E, Putrella M, Ponti A, Sassoli de’ Bianchi
P e il gruppo di lavoro sugli indicatori del GISMa. Process indicators and standards for the
evaluation of breast cancer screening programmes. Operative Report. Epidemiol Prev. 2006
Mar-Apr;30(2 Suppl 1):5-9, 11-47. Italian.
24. Goodman MT, Tung KH, Wilkens LR. Comparative epidemiology of breast cancer among
men and women in the US, 1996 to 2000. Cancer Causes Control. 2006 Mar;17(2):127-36.
25. Gotzsche PC, Nielsen M. Screening for breast cancer with mammography (Review).
JohnWiley & Sons, Ltd, 2006.
26. Greenwald P, Kramer BS, Weed DL. Cancer Prevention and Control. New York; Marcel
Dekker Inc., 1995.
27. Hecht SS. Tobacco smoke carcinogens and breast cancer. Environ Mol Mutagen 2002;
39:119-26.
28. Hermon C, Beral V. Breast cancer mortality rates are levelling off or beginning to decline in
many western countries: analysis of time trends, age-cohort and age-period models of breast
cancer mortality in 20 countries. Br J Cancer 1996; 73:955-60.
29. Holford TR. The estimation of age, period and cohort effects for vital rates. Biometrics 1983;
39:311-24.
30. International Agency for Research on Cancer. Hormonal Contraception and Post-menopausal
Hormonal Therapy. IARC Press Release n. 72. Lyon, 1999.
31. International Agency for Research on Cancer. Mammography screening can reduce deaths
from breast cancer. IARC Press Release n. 139. Lyon, 2002.
32. International Agency for Research on Cancer. Breast and colorectal cancers are associated
with alcohol consumption, says IARC. IARC Press Release n. 175. Lyon, 28 mar 2007.
33. Jonsson H, Törnberg S, Nyström L, Lenner P. Service screening with mammography of
women aged 70-74 years in Sweden. Effects on breast cancer mortality. Cancer Detect Prev.
2003;27(5):360-9.
34. Key TJ, Verkasalo PK, Banks E. Epidemiology of breast cancer. The Lancet Oncology 2001;
2:133-40.
35. Kim H-J, Fay MP, Feuer EJ, Midthune DN. Permutation tests for joinpoint regression with
applications to cancer rates. Statistics in Medicine 2000; 19:335-51.
36. Kropp S, Chang-Claude J. Active and passive smoking and risk of breast cancer by age 50
years among German women. Am J Epidemiol 2002; 156:616-26.
37. Levine M. Clinical practice guidelines for the care and treatment of breast cancer: adjuvant
systemic therapy for node-positive breast cancer. CMAJ 2001; 164: 213.
38. Levine M. Clinical practice guidelines for the care and treatment of breast cancer: adjuvant
systemic therapy for node-positive breast cancer (summary of the 2001 update). The Steering
Committee on Clinical Practice Guidelines for the Care and Treatment of Breast Cancer.
CMAJ 2001; 164: 644-6.
39. Levine M et al. Chemo prevention of breast cancer. CMAJ 2001; 164: 1681-90.
40. Ligue fribourgeoise contre le cancer, http://www.liguecancer-fr.ch/
41. Ligue genevoise contre le cancer, http://www.lgc.ch/
42. Ligue jurassienne contre le cancer, http://www.liguecancer-ju.ch/
43. Ligue neuchâteloise contre le cancer, http://www.lncc.ch/
44. Lega ticinese contro il cancro, http://www.legacancro-ti.ch/
45. Lega svizzera contro il cancro, http://www.swisscancer.ch/
46. Ligue valaisanne contre le cancer, http://www.lvcc.ch/
47. Ligue vaudoise contre le cancer, http://www.lvc.ch/
48. McPherson K, Steel CM, Dixon JM. Breast cancer – epidemiology, risk factors, and genetics.
BMJ 2000; 321:624-8.
49. Missmer SA, Smith-Warner S, Spiegelman D. Meat and dairy food consumption and breast
cancer: a pooled analysis of cohort studies. Int J Epidemiol 2002; 31:78-85.
13
50. Morabia A. Smoking (active and passive) and breast cancer: epidemiological evidence up to
June 2001. Environ Mol Mutagen 2002; 39:89-95.
51. National Cancer Institute (NCI). Joinpoint Regression Program. Version March 2002.
52. Nolvadex. In: Medwatch 2002 Safety Information Summaries. Washington: US Food and
Drug Administration; 2002.
53. Nolvadex. In: Compendium of pharmaceuticals and specialties. Ottawa: Canadian
Pharmacists Association; 2002.
54. Nolvadex. Tamoxifen citrate. Wilmington (DE): Astra Zeneca Pharmaceuticals 2002.
55. Olivotto J, Levine M. Clinical practice guidelines for the care and treatment of breast cancer:
the management of ductal carcinoma in situ. CMAJ 2001; 165: 912-913.
56. Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture. Eur J
Cancer 2001; 37:S4-S66.
57. Programme vaudois de dépistage du cancer du sein. Rapport d’activité. Fondation pour le
dépistage du cancer du sein, 2005.
58. Qaseem A, Snow V, Sherif K, Aronson M, Weiss KB, Owens. Screening Mammography for
Women 40 to 49 Years of Age: A Clinical Practice Guideline from the American College of
Physicians. Ann Intern Med. 2007 Apr 3;146(7):511-5.
59. Ravdin PM, Cronin KA, Howlader N, Berg CD, Chlebowski RT, Feuer EJ, Edwards BK,
Berry DA. The decrease in breast-cancer incidence in 2003 in United States. N Engl J Med.
2007 Apr 19;356(16):1670-4.
60. Ringash J. Preventive health care, 2001 update: screening mammography among women aged
40–49 years at average risk of breast cancer. CMAJ 2001;164(4):469-76
61. Rockhill et al. Validation of the Gail et al. model of breast cancer risk prediction and
implications for chemoprevention. J Natl Cancer Inst 2001; 93: 358-66.
62. Sainsbury JRC, Anderson TJ, Morgan DAL. Breast cancer. BMJ 2000; 321:745-9.
63. Sant M, Capocaccia R, Verdecchia A, et al. Survival of women with breast cancer in Europe:
variation with age, year of diagnosis and country. Int J Cancer 1998; 77:679-83.
64. Sant M and the Eurocare Working Group. Differences in stage and therapy for breast cancer
across Europe. Int J Cancer 2001; 93:894-901.
65. Smith-Warner S, Spiegelman D, Adami H-O. Types of dietary fat and breast cancer: a pooled
analysis of cohort studies. Int J Cancer 2001a; 92:767-74.
66. Smith-Warner S, Spiegelman D, Yaun S-S. Intake of friuts and vegetables and risk of breast
cancer. A pooled analysis of cohort studies. JAMA 2001b; 285:769-76.
67. Stewart BW, Kleihues P. World Cancer Report. Lyon; IARC Press, 2003.
68. Terry PD, Rohan TE. Cigarette smoking and the risk of breast cancer in women: a review of
the literature. Cancer Epidemiol Biomarkers Prev 2002; 11:953-71.
69. Tyczynski JE, Bray F, Parkin DM. Breast Cancer in Europe. ENCR Cancer Fact Sheets, Vol.
2, December 2002.
70. Vainio H, Bianchini F. (eds.) Breast cancer screening. IARC Handbooks of Cancer
Prevention. Lyon: IARCPress, 2002.
71. Van Hoften C, Burger H, Peeters PHM. Long-term oral contraceptive use increases breast
cancer risk in women over 55 years of age: the DOM cohort. Int J Cancer 2000; 87:591.
72. Wooltorton E. Tamoxifen for breast cancer prevention: safety warning. JAMC 2002; 164 (4).
14