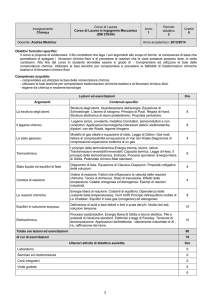
394/98
A.A. 1998/99
UNIVERSITA' DEGLI STUDI DITRIESTE
_____________________________________________________________________
CORSO DI LAUREA
PROGRAMMA DEL CORSO DI
DOCENTE
INGEGNERIA CHIMICA,
ELETTRONICA, ELETTRICA E DEI
MATERIALI
CHIMICA
L. KUCICH-PODDA
MISURE
Sistema metrico - Cifre significative
STECHIOMETRIA
Nomenclatura dei composti chimici e formule di struttura - Leggi di conservazione
della massa, delle proporzioni definite e delle proporzioni multiple - Legge degli
equivalenti
REAZIONI ED EQUAZIONI CHIMICHE
Reazioni per spostamento o combinazione - Reazioni per ossido-riduzione - Numero
di ossidazione - Bilanciamento - Impieghi industriali: riduzione di minerali di ferro in
altoforno
Atomo: Natura e costituenti dell'atomo - Numero atomico e numero di massa - Nucleo
- Modello di Bohr-Sommerfeld - Modello quantistico - Teoria ondulatoria - Teoria di
De Broglie - Equazione d'onda di Schrodinger - Principio di Pauli e Hund Costruzione di atomi
LEGAMI CHIMICI
Legami covalenti (omeopolare, eteropolare, ad elettroni delocalizzati) - Ibridizzazione
e risonanza - Legame elettrostatico (ionico, dipolare, idrogeno) - Legame metallico Teoria degli orbitali molecolari (cenni)
TAVOLA PERIODICA DEGLI ELEMENTI
Descrizione e correlazione fra proprietà chimiche e fisiche
STATO GASSOSO
Modello cinetico di gas ideale - Teoria cinetica dei gas - Leggi di Boyle, Charles,
Guy-Lussac - Equazione di stato di gas ideale - Legge di Dalton, di Graham e
principio di Avogadro - Gas reali ed equazione di Van der Waals - Stato critico
STATO SOLIDO
Solidi metallici, ionici, covalenti, molecolari, a legame idrogeno - Difetti reticolari Struttura e proprietà fisiche
STATO LIQUIDO
Struttura - Pressione interna e tensione di vapore, tensione superficiale, viscosità Proprietà fisiche
CAMBIAMENTI DI STATO
Equazione di Clausius-Clapeyron - Fusione, evaporazione, liquefazione,
solidificazione - Diagrammi di stato dell'acqua e della CO2 - Principio di Le
Chatellier
TERMODINAMICA
Stati e funzioni di stato - I principio della termodinamica - Entalpia e calore di
reazione - Legge di Hess - Entropia e II principio - Energia libera ed equazione di
Gibbs-Helmotz
CINETICA CHIMICA
Velocità e meccanismo di reazione - Energia di attivazione - Catalisi - Applicazioni
industriali: produzione di acido solforico
EQUILIBRIO CHIMICO
Equilibri tra le fasi: diagramma di stato ad uno o due componenti - Regola delle fasi Legge dell'azione di massa e costante di equilibrio - Relazione fra Kp e Kc - Fattori
variabili dell'equilibrio - Applicazioni industriali: equilibrio omogeneo - metodo di
Huber-Bosch per la produzione di ammoniaca; equilibrio eterogeneo - produzione di
calce viva - Elettroliti - Grado di dissociazione e coefficente di Van't Hoff - Acidi e
basi di Arrhenius - Dissociazione dall'acqua e pH - Determinazione del pH di
soluzioni di elettroliti - Indicatori - Titolazioni acido-base - Acidi e basi di Bronsted e
di Lewis - Idrolisi salina - Tamponi - Prodotto di solubilità e sua applicazione in
analisi chimica - Effetto ione a comune
SOLUZIONI
Soluzioni gassose - Soluzioni liquide - Solvatazione - Modi per esprimere la conc. di
soluzioni - Tensione di vapore di soluzioni e legge di Roult - Ebullioscopia e
crioscopia - Pressione osmotica - Soluzioni solide
ELETTROCHIMICA
Elettricità e reazione di redox - Conducibilità - Potenziali elettrodici - Potenziali
standard - Equazione di Nerst - Pile chimiche - Potenziali di redox e calcolo della
costante di equilibrio - Elettrodi di riferimento ed elettrodi indicatori - Pile di
concentrazione e determinazione potenziometrica del pH - Elettrodo di vetro Elettrolisi - Leggi di Faraday - Applicazioni industriali dell'elettrolisi: a) produzione
di metalli alcalini e alcalino terrosi per elettrolisi; b) preparazione di soda caustica; c)
estrazione di Al dalle bauxiti; d) galvanoplastica e galvanostegia; e) accumulatori al
piombo - Corrosione galvanica.
SOLO PER CHIMICI
LABORATORIO):
E
MATERIALISTI
(ESERCITAZIONI
IN
Analisi qualitativa
Proprietà delle sostanze legate alla struttura sfruttate nell'analisi:
a) colorazione alla fiamma
b) trasformazione di stato (cristallizzazione, evaporazione, sublimazione)
c) reazioni chimiche di neutralizzazione,
ossidoriduzione, formazione complessi
precipitazione,
ridisoluzione,
Saggi per l'identificazione di anioni più comuni
Principio teorico che regola l'analisi sistematica per individuare i cationi
Qualche esempio pratico: precipitazione di solfuri a pH acido (II gruppo);
precipitazione di idrossidi (III gruppo)
Analisi quantitativa
Sostanze madri - Soluzioni titolate - Punto di equivalenza - Curve di titolazione e
criteri di scelta degli indicatori
Titolazione di neutralizzazione, di precipitazione (argentometria), di ossido-riduzione
(permanganatometria), di complessazione (determinazione di durezza delle acque con
EDTA)
Alcuni esempi di metodi elettrochimici usati nell'analisi:
a) determinazione qualitativa e quantitativa del rame per via elettrolitica
b) determinazione di pH di soluzioni di vari sali (idrolisi salina)
c) pila Daniel
d) titolazione acido-base per via potenziometrica.
SOLO PER ELETTRICI ED ELETTRONICI:
Elementi di chimica organica
a) Struttura, isomeria, serie omologhe e gruppi funzionali, nomenclatura - Idrocarburi
alifatici: alcani, alcheni, alchini - Idrocarburi aromatici
b) Derivati degli idrocarburi: alogenuri, alcoli, fenoli, eteri, aldeidi, chetoni, acidi,
esteri, amine, nitroderivati, amminoacidi
c) Saponi e detersivi
d) Polimeri (cenni).