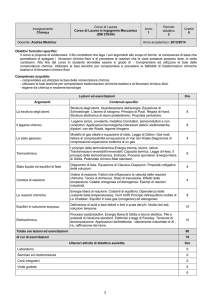
PROGRAMMA di CHIMICA I
Corsi di laurea in Ingegneria Civile e in Ingegneria per l’Ambiente e il Territorio
A. A. 2007/2008
Docente: prof. R. Pietropaolo
Obiettivi e finalità del corso :
Il corso mira a fornire allo studente le conoscenze di base sui processi chimico - fisici e sulla
struttura e le trasformazioni della materia.
1. L'ATOMO
Origine della teoria atomica. Esperienza di Rutherford. Massa atomica. Mole e peso
atomico. L'elettrone. La teoria quantistica. La meccanica ondulatoria. I numeri quantici. Le
strutture elettroniche degli atomi e classificazione periodica degli elementi.
2. IL LEGAME CHIMICO Formule di Lewis. Potenziale di ionizzazione. Affinità
elettronica. Elettronegatività. Legami chimici: covalente, ionico. Risonanza. Orbitali
delocalizzati. Orbitali ibridi. Forze intermolecolari. Legame idrogeno. Legame metallico.
3. LE REAZIONI CHIMICHE
Valenza. Numero d'ossidazione. Nomenclatura dei composti chimici. Reazioni chimiche.
Reazioni redox. Relazioni ponderali nelle reazioni chimiche. Peso equivalente.
4. STATI DELLA MATERIA
Stato gassoso. Leggi dello stato gassoso. Equazione generale dei gas ideali. Teoria cinetica
dei gas. I gas reali. Equazione di Van der Waals. Temperatura critica. Diagramma di
Andrews. Stato liquido. Processo di evaporazione. Tensione di vapore. Stato solido. Solidi
ionici, covalenti, molecolari. Metalli. Semiconduttori. Cambiamenti di stato. Sistemi
eterogenei ad un componente. Regola delle fasi. Diagramma di stato dell'acqua.
5. SOLUZIONI
Concentrazione delle soluzioni. Soluzioni ideali. Legge di Raoult. Soluzioni non ideali.
Proprietà colligative. Soluzioni elettrolitiche. Conducibilità elettrolitica. Conducibilità
equivalente.
6. TERMODINAMICA
Il primo principio della termodinamica. Energia interna ed entalpia. Termochimica. Legge di
Hess. Il secondo principio della termodinamica. Conversione di calore in lavoro. Entropia.
Energia libera. Equazione di Clausius-Clayperon. Spontaneità delle reazioni chimiche.
7. EQUILIBRIO CHIMICO
Legge dell'equilibrio chimico. Effetto della concentrazione, temperatura e pressione
sull'equilibrio. Equazione di Van't Hoff. Equilibri in fase gas. Equilibri eterogenei. Equilibri
in soluzione. Prodotto ionico dell'acqua. Acidi e basi. pH. Calcolo del pH. Soluzioni
tampone. Indicatori. Idrolisi. Prodotto di solubilità.
8. CINETICA CHIMICA
Velocità di reazione. Variabili che influenzano la velocità di reazione. Energia di
attivazione. Processi catalitici e fotochimici.
9. ELETTROCHIMICA
Pile. Elettrodi. Elettrodi di riferimento. Equazione di Nernst. Misura della f.e.m. di una pila.
Elettrolisi. Leggi di Faraday. Corrosione dei metalli. Accumulatori.
TESTI CONSIGLIATI
1. P. Finocchiaro, R. Pietropaolo “LEZIONI DI CHIMICA”
Edizioni Spiegel.
2. A. Clerici, S: Morocchi “ESERCITAZIONI DI CHIMICA”
Edizione Spiegel .
MODALITÀ D’ESAME
L’esame prevede prova scritta ed orale.
ORGANIZZAZIONE IN CREDITI
Il corso consiste di cinque crediti:
L'ATOMO - IL LEGAME CHIMICO - LE REAZIONI CHIMICHE (1 credito)
STATI DELLA MATERIA - SOLUZIONI (1 credito )
TERMODINAMICA (1 credito )
EQUILIBRIO CHIMICO - CINETICA CHIMICA (1 credito)
ELETTROCHIMICA (1 credito)