Chimica e vita
Le forme allotropiche del carbonio
La facilità con cui gli strati possono scorrere l’uno sull’altro spiega le
proprietà lubrificanti della grafite,
impiegata negli oli per motore. Per
lo stesso motivo si utilizza la grafite,
miscelata con alcune argille, per
preparare le mine delle matite; il segno che esse lasciano sul foglio di
carta è costituito proprio da quei
pochi strati di grafite che, a seguito
della pressione esercitata con la mano, si sono trasferiti dalla mina al
foglio.
La grafite, pur non essendo un
metallo, è un discreto conduttore di
elettricità. All’interno di ciascuna
maglia esagonale, infatti, restano sei
elettroni non localizzati fra coppie
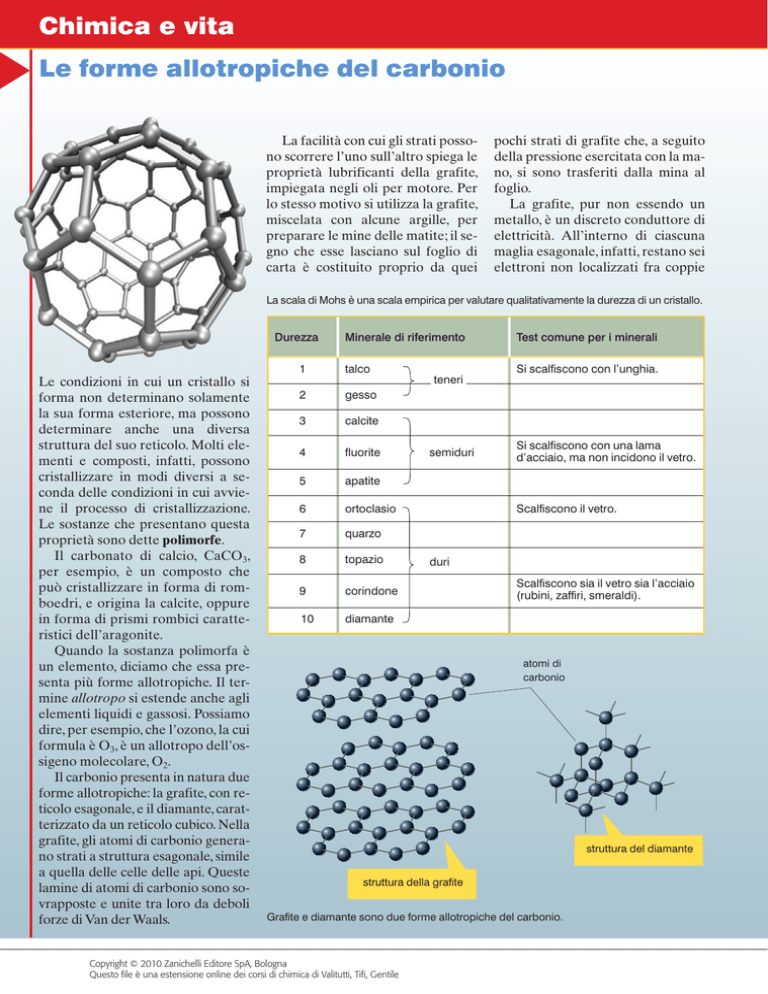
La scala di Mohs è una scala empirica per valutare qualitativamente la durezza di un cristallo.
Durezza
Le condizioni in cui un cristallo si
forma non determinano solamente
la sua forma esteriore, ma possono
determinare anche una diversa
struttura del suo reticolo. Molti elementi e composti, infatti, possono
cristallizzare in modi diversi a seconda delle condizioni in cui avviene il processo di cristallizzazione.
Le sostanze che presentano questa
proprietà sono dette polimorfe.
Il carbonato di calcio, CaCO3,
per esempio, è un composto che
può cristallizzare in forma di romboedri, e origina la calcite, oppure
in forma di prismi rombici caratteristici dell’aragonite.
Quando la sostanza polimorfa è
un elemento, diciamo che essa presenta più forme allotropiche. Il termine allotropo si estende anche agli
elementi liquidi e gassosi. Possiamo
dire, per esempio, che l’ozono, la cui
formula è O3, è un allotropo dell’ossigeno molecolare, O2.
Il carbonio presenta in natura due
forme allotropiche: la grafite, con reticolo esagonale, e il diamante, caratterizzato da un reticolo cubico. Nella
grafite, gli atomi di carbonio generano strati a struttura esagonale, simile
a quella delle celle delle api. Queste
lamine di atomi di carbonio sono sovrapposte e unite tra loro da deboli
forze di Van der Waals.
Minerale di riferimento
Test comune per i minerali
1
talco
Si scalfiscono con l’unghia.
2
gesso
3
calcite
4
fluorite
5
apatite
6
ortoclasio
7
quarzo
8
topazio
9
corindone
10
diamante
teneri
semiduri
Si scalfiscono con una lama
d’acciaio, ma non incidono il vetro.
Scalfiscono il vetro.
duri
Scalfiscono sia il vetro sia l’acciaio
(rubini, zaffiri, smeraldi).
atomi di
carbonio
struttura del diamante
struttura della grafite
Grafite e diamante sono due forme allotropiche del carbonio.
Copyright © 2010 Zanichelli Editore SpA, Bologna
Questo file è una estensione online dei corsi di chimica di Valitutti, Tifi, Gentile
specifiche di atomi, che sono pertanto liberi di muoversi su tutto il
piano.
Se la grafite può essere usata per
scrivere sulla carta, il diamante è
adatto per segnare il vetro. La sua
durezza gli consente di scalfire
qualsiasi superficie, compreso lo
zircone, lo smeraldo e altre pietre
dure.
La durezza è la resistenza che un
cristallo oppone alla scalfittura e
può essere valutata facendo riferimento alla scala di Mohs.
Il tetraedro è un solido che si può ricavare
da un cubo congiungendo fra loro due vertici non consecutivi.
Modello della struttura
cristallina esagonale compatta
del fullerene.
Essa è una scala empirica che assume come riferimento la durezza
di dieci composti cristallini numerati progressivamente da 1 a 10; ciascuno di essi è in grado di scalfire
quello che lo precede ma è scalfito
da quello che lo segue.
Nel diamante ogni carbonio è
legato ad altri quattro atomi di carbonio disposti ai vertici di un tetraedro. Il diamante non conduce la
corrente elettrica, ma è un ottimo
conduttore di calore. I diamanti
sembrano freddi al tatto proprio
perché, conducendo bene il calore,
lo allontanano dalle nostre dita
quando li tocchiamo. Sfruttando
Copyright © 2010 Zanichelli Editore SpA, Bologna
Questo file è una estensione online dei corsi di chimica di Valitutti, Tifi, Gentile
questa particolarità, gli esperti riescono a distinguere un diamante
vero da uno falso: sulla lingua, infatti, il diamante vero si sente freddo come un metallo.
I fullereni, di cui abbiamo già
parlato nel capitolo precedente,
sono un’altra forma allotropica del
carbonio. Il fullerene più stabile è
costituito da molecole sferiche, di
formula C60, che, per effetto delle
forze di Van der Waals, possono riunirsi in cristalli di color senape.
Essi hanno struttura esagonale
compatta e si sciolgono in benzene,
producendo una soluzione di colore rosso-magenta.