CAPITOLO TERZO
PRINCIPI FONDAMENTALI SULLA
CONVERSIONE DEL CALORE
Sistema termodinamico
La termodinamica tratta delle trasformazioni energetiche interessanti il
calore e dei problemi ad esse connesse.
Si definisce sistema termodinamico un corpo od un insieme di corpi
racchiusi da una definita superficie detta superficie di controllo.
Il sistema deve essere definito, cioé racchiuso completamente entro una
superficie di controllo, e limitato, cioé la superficie di controllo non deve
andare ad infinito.
Le pareti possono essere pervie (permeabili) o impervie (impermeabili), a
seconda che permettano o non il passaggio di materia (massa); mobili o rigide,
a seconda che consentano variazioni di volume e quindi scambi di lavoro di
deformazione; diatermane o adiabatiche, a seconda che consentano o non il
passaggio di calore.
Il sistema è detto chiuso se il contorno che lo limita è impervio, aperto nel
caso contrario. Si dice poi isolato se il contorno, oltre che impervio, è anche
rigido ed adiabatico. Ad esempio, le pareti che limitano i locali sono al tempo
stesso pervie (perché lasciano passare l’aria ed il vapor acqueo), rigide (non
consentono variazioni di volume), diatermane (perché consentono il passaggio
Cap. 3
Pagina 1 di 24
di calore).
Un sistema si dice in equilibrio termodinamico quando al suo interno non
si produce alcuna variazione al variare del tempo; tale situazione si chiama
anche stato termodinamico.
Lo stato termodinamico di un sistema è caratterizzato da un certo numero di
grandezze fisiche, dette anche coordinate, alcune legate a ciascun punto del
sistema (grandezze intensive) ed altre dipendenti dalla dimensione del sistema
(grandezze estensive); a volte le grandezze estensive vengono riferite all’unità
di massa o di volume del sistema e diventano grandezze specifiche. Ad
esempio la temperatura e la pressione sono grandezze intensive, la massa ed il
volume sono grandezze estensive e la densità (massa specifica) o il volume
specifico sono grandezze specifiche.
Lo stato di equilibrio termodinamico è caratterizzato dalla costanza delle
grandezze intensive e specifiche; in tale condizione è sufficiente un numero
delimitato di tali grandezze per caratterizzare inequivocabilmente lo stato del
sistema. Ad esempio per un sistema costituito da una sola sostanza lo stato
termodinamico è definito dal valore di due grandezze fra di loro indipendenti
(es. pressione e temperatura ovvero temperatura e volume specifico). Le altre
grandezze derivano da queste tramite relazioni (grafiche, numeriche o
analitiche) chiamate equazioni di stato (ad es. per un gas ideale una delle
possibili equazioni di stato è pv=RT che permette di ricavare ad esempio la
pressione p dalla temperatura T e dal volume specifico v, essendo R una
costante caratteristica del gas).
Quando l’equilibrio viene a mancare, il sistema diviene sede di una
trasformazione termodinamica ed in esso, se la trasformazione è
sufficientemente lenta nel tempo, si verifica una successione di stati
termodinamici differenti.
Le trasformazioni dello stato fisico di un corpo, ad esempio del suo
volume specifico v, della sua pressione p, della sua temperatura T , si
rappresentano tramite relazioni, dette equazioni della trasformazione, che
possono avere o la forma analitica ovvero grafica in un opportuno diagramma
cartesiano (linea della trasformazione). Così ad esempio nel caso di un gas
ideale, la trasformazione a temperatura costante presenta una relazione analitica
T=cost= T o e la linea di trasformazione viene rappresentata, in un diagramma
che riporti la temperatura T sulle ordinate ed il volume specifico v sulle ascisse,
tramite una linea orizzontale.
Cap. 3
Pagina 2 di 24
In effetti il sistema, se evolve, non potrebbe a rigore essere considerato come
caratterizzato da stati termodinamici successivi; tuttavia, in prima
approssimazione per fenomeni lenti, si può supporre che il sistema evolva
secondo una successione continua di stati di quasi-equilibrio termodinamico,
cioé di stati definibili con dei valori ben determinati delle variabili
termodinamiche ed infinitamente vicini a quelli corrispondenti a stati di
equilibrio termodinamico.
Se inoltre tali stati sono percorribili in entrambi i sensi, si dice che il sistema
è sede di una trasformazione termodinamica reversibile (per una definizione
più precisa vedere oltre).
Nella realtà le trasformazioni termodinamiche sono irreversibili, ma possono
approssimarsi alle trasformazioni reversibili che più da vicino le ricopiano ed,
introducendo i dovuti fattori correttivi empirici, si possono successivamente
rendere i risultati aderenti alle situazioni pratiche.
Conversione di energie fra loro e del calore in lavoro
La conversione di energia da una forma ad un’altra (esempio da meccanica
ad elettrica) ovvero sempre nella stessa forma ma con caratteristiche diverse
(esempio da elettrica ad alta tensione ad elettrica a bassa tensione), avviene a
mezzo di un apparecchio chiamato macchina.
Nel campo termico una macchina può essere considerata come un esempio di
sistema termodinamico.
Le macchine reali purtroppo non sono in grado di convertire esattamente
tutta l’energia in ingresso in altrettanta energia in uscita; ciò si constata in
quanto se l’energia in uscita viene introdotta in un’altra macchina che opera
inversamente alla prima, in uscita a quest’ultima non si ritrova tutta l’energia
spesa in prima istanza. Questa incompl%etaconvertibilità è determinata dalle
perdite.
Le perdite sono causate dalla irreversibilità di alcuni fenomeni quali gli
attriti, gli scambi di calore fra corpi a differente temperatura, le isteresi, ecc...
Gli attriti sono caratterizzati dalla presenza di una forza finita che impedisce
il distacco fra due superfici o che si oppone al moto relativo fra un fluido ed un
solido; invertendo il moto anche la forza si inverte impedendo il ricupero
Cap. 3
Pagina 3 di 24
dell’energia messa in gioco nel movimento diretto.
Lo scambio di calore fra due corpi aventi temperature diverse costituisce
anch’esso una perdita (vedi capitolo secondo) ed infatti il passaggio inverso non
avviene più spontaneamente ma necessita di una spesa di energia. Unica
possibilità di reversibilità consiste nell’immaginare lo scambio, sempre fra un
corpo più caldo ed uno più freddo, ma con differenze di temperature
infinitesime.
L’isteresi corrisponde al fatto che mentre il processo diretto segue una certa
legge, quello inverso segue un altro andamento; ciò porta, in una definita
situazione, ad avere due valori diversi della stessa grandezza secondo se si
proceda in una direzione del processo o in quella inversa. Ne consegue che nel
processo inverso avviene una restituzione di energia inferiore a quella messa in
gioco nel processo diretto.
Tutti questi fenomeni sono caratterizzati dal fatto che le differenze fra
alcuni parametri in gioco non sono infinitesime ma finite; solo con la prima
condizione la variazione di una delle grandezze in gioco nel fenomeno della
trasformazione, può far avvenire l’inversione del fenomeno della conversione
energetica e, a meno di infinitesimi di ordine superiore, l’energia ricuperata
nella trasformazione inversa eguaglia quella spesa nella trasformazione diretta.
Lo studio delle macchine reali può essere svolto più proficuamente
effettuandolo in due passi successivi: il primo passo considera la macchina
ideale, cioé senza perdite, in modo da esaminare i fenomeni fisici su cui è
imperniato il processo di conversione; il secondo sovrappone alla soluzione
ideale l’effetto, sperabilmente piccolo, delle perdite.
Mentre è intuitiva, in quanto verificabile continuamente nella realtà, la
perdita energetica dovuta agli attriti, non altrettanto intuitiva è la perdita
conseguente al degradamento termico del calore. Nel testo di Carnot questo è
chiaramente spiegato.
In particolare nella trasformazione del calore in lavoro con una macchina
ideale che permetta il massimo di conversione energetica (e di conseguenza la
reversibilità ) vanno rispettati i seguenti criteri:
1) nessun attrito o isteresi;
2) trasferimenti del calore con salti termici infinitesimi.
La macchina termica ideale che realizza tali principi nella trasformazione del
calore in lavoro, avendo a disposizione la quantità di calore Q 1 , fornita da
Cap. 3
Pagina 4 di 24
una capacità termica tale da assicurare la costanza della temperatura T 1 ed
avendo a disposizione una capacità termica a temperatura inferiore T 2 , è un
sistema termodinamico che:
a) scambia il calore Q 1 con la capacità termica a temperatura
T 1 con un salto termico infinitesimo,
b) idem per lo scambio con la capacità termica a temperatura T 2 ;
c) cambia di temperatura da
volume (senza scambi di calore).
T1
a
T2
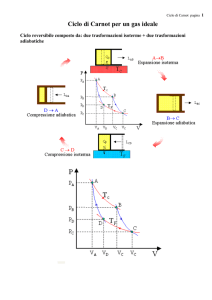
Il ciclo di Carnot, costituito da due isoterme da
adiabatiche realizza le condizioni sopra esposte.
solo per variazione di
T1
Definita l’efficienza della conversione come il rapporto
ottenuto L ed il calore speso Q 1 , Carnot dimostra che:
T2
a
e da due
fra il lavoro
1) l’efficienza è indipendente dalla sostanza che compie le
trasformazioni del ciclo;
2) l’efficienza può essere calcolata quindi con una sostanza qualsiasi e
pertanto ad esempio con un gas ideale, essendo il risultato ottenuto di
validità generale;
3) qualsiasi altro ciclo che utilizzi Q 1 fornito da una capacità
termica alla temperatura T 1 , avendo a disposizione una capacità alla
temperatura T 2 , non può avere efficienza superiore (al massimo può
essere uguale) a quella del ciclo di Carnot fra le stesse temperature
estreme.
Tutte queste dimostrazioni si effettuano per assurdo, considerando due cicli,
uno percorso in senso diretto e l’altro in senso inverso, e mostrando che, la
negazione di una delle tre proposizioni precedenti porta a negare la validità del
principio di Carnot.
Cap. 3
Pagina 5 di 24
Analogie fra macchine termiche e macchine idrauliche
Lo stesso Carnot (vedi capitolo secondo) indica l’analogia fra una
macchina termica ed una macchina idraulica (vedi figura 3.1).
Considera quindi equivalenti:
serbatoi di acqua, <----> serbatoi di calore
livello di acqua,
<----> temperatura
lavoro,
<----> lavoro
Per questo il principio dell’idraulica per il quale:
“Il massimo di lavoro prodotto da una certa massa di acqua in una
macchina idraulica si ottiene quando tale massa è presa alla massima
quota possibile (livello del serbatoio superiore), è scaricata alla minima
quota possibile (serbatoio inferiore) ed è evitata qualsiasi perdita
intermedia o bypass attraverso la macchina”.
Si trasforma nel Principio di Carnot:
“Il massimo di lavoro prodotto da una certa quantità di calore in una
macchina termica si ottiene quando il calore è fornito alla massima
temperatura possibile (capacità termica calda) e la quantità di calore
residua è scaricata alla minima temperatura (capacità termica fredda); va
evitato qualsiasi scambio intermedio fra corpi a temperatura sensibilmente
differente”.
Il ciclo che realizza tale principio risulta costituito da:
isoterma T 1=T max (temperature assolute in K)
isoterma T 2=T min (temperature assolute in K)
altre trasformazioni reversibili senza scambio di calore.
Si fa notare che mentre in idraulica tanta acqua esce dal serbatoio superiore
tanta ne viene scaricata in quello inferiore, nelle macchine termiche alla
capacità termica inferiore giunge una quantità di calore minore di quella
prelevata alla capacità calda, la differenza essendo proprio il lavoro (energia
meccanica) prodotto.
Cap. 3
Pagina 6 di 24
Figura 3.1 – Equivalenza, secondo Carnot, fra impianti idraulici ed impianti
termici per la produzione del lavoro meccanico.
Questo Carnot non riusciva a verificarlo perché la macchine di quei tempi
producevano talmente poco lavoro (meno dell’1%) che le due quantità di calore
suddette erano quasi uguali fra loro. Tuttavia, nonostante ciò, Carnot intuì
l’esistenza di una differenza ed indicò l’esigenza di un perfezionamento delle
modalità delle misure.
Altre formulazioni equivalenti al principio di Carnot
Il principio di Carnot costituisce una constatazione della realtà .
Il principio di Carnot è esprimibile, oltre che secondo la formulazione di
Carnot, anche secondo quella di Clausius (vedi poco oltre) o infine secondo
l’enunciato di Kelvin- Planck; cioé tutte queste espressioni indicano una stessa
proprietà del mondo in cui viviamo (non sono mai state esaminate situazioni
nelle quali questo principio fosse disatteso).
Cap. 3
Pagina 7 di 24
Delle diverse formulazioni la seconda è verificabile dovunque esistano corpi
a diversa temperatura.
Si può dimostrare che le tre formulazioni sono equivalenti fra loro, cioé ,
negata una espressione, rimangono automaticamente negate anche le altre.
La dimostrazione del Clausius, citata in tutti i libri di Fisica, mostra la
discendenza della formulazione di Carnot da quella di Clausius; essendo la
dimostrazione, del tipo per assurdo, piuttosto capziosa e di stretto interesse
fisico, noi sceglieremo come principio fornito dalla realtà la formulazione di
Carnot.
Si ricorda che:
secondo Kelvin-Planck:
E’ impossibile realizzare una trasformazione in cui unico risultato sia
quello di assorbire calore da una capacità calda e di convertirlo integralmente
in lavoro.
secondo Clausius:
Il calore passa spontaneamente da un corpo caldo ad uno freddo; il
passaggio inverso non avviene spontaneamente, senza cioé
qualche
concomitante risultato (spesa di lavoro).
Mentre secondo Carnot (riportato con le sue stesse parole):
“.. ogni metodo per sviluppare la potenza motrice raggiunge la
perfezione di cui è capace .... se ... non si hanno variazioni di temperatura
nel corpo ad eccezione di quelle dovute a cambiamenti di volume, oppure,
ciò che è lo stesso ma detto in altre parole, se non c’è mai contatto fra corpi
a temperature sensibilmente differenti.”
Ciò porta alla seguente formulazione applicativa:
Il massimo lavoro reso da una definita quantità di calore è quello che si
ottiene fornendo il calore alla massima temperatura possibile (quella della
capacità calda), sottraendo calore alla minima temperatura possibile
(quella della capacità fredda); tutte le trasformazioni devono essere
reversibili e, ad esclusione di quelle nelle quali si verifica lo scambio di
calore, devono avvenire senza scambio di calore con l’esterno.
Nelle precedenti formulazioni compaiono alcuni concetti di cui conviene
riprendere la definizione:
Cap. 3
Pagina 8 di 24
Capacità termica: essa rappresenta un serbatoio di calore in grado di
fornire tutto il calore, richiesto dalla macchina, senza cambiare di
temperatura;
Trasformazione reversibile: essa indica una trasformazione che può
essere percorsa in un verso o nell’altro (dallo stato iniziale 1 a quello
finale 2 o viceversa) esclusivamente cambiando le differenze infinitesime
delle grandezze in gioco; se percorsa in senso diretto e successivamente in
senso inverso, il sistema raggiunge la condizione iniziale e non rimarrà
traccia alcuna dell’avvenuto né nel sistema né all’esterno.
Il concetto di reversibilità qui indicato è leggermente più esteso di quello
precedentemente introdotto avendo qui compreso anche la reversibilità dello
scambio di calore; tale concetto risulta più comprensibile se si fornisce anche la
definizione di irreversibilità con qualche esempio.
Si ha irreversibilità quando esiste una differenza finita e non infinitesima fra
le grandezze fisiche (meccaniche o termiche) implicate nella trasformazione.
L’attrito, classico esempio di causa di irreversibilità, si manifesta come una
forza finita (e non infinitesima) al distacco fra due superfici, finita nello
scorrimento fra una superficie ed un fluido, ecc..; invertendo il senso del moto,
la forza non decresce con continuità, come avverrebbe per una forza elastica,
ma si inverte completamente mantenendo la sua entità ed impedendo così il
ricupero dell’energia messa in gioco nel movimento diretto.
Anche lo scambio di calore fra un corpo caldo ed uno freddo costituisce un
altro esempio di irreversibilità, perché il passaggio inverso può avvenire solo
invertendo la differenza finita di temperatura e non spontaneamente e senza
spesa di energia; solo nel caso di differenze infinitesime, l’energia da spendere
per l’inversione delle differenze di temperature, sarebbe infinitesima.
Infine le isteresi si manifestano quando le azioni, messe in gioco lungo un
percorso, presentano differenze finite rispetto a quelle nel percorso inverso; non
viene quindi ricuperata, al ritorno, tutta l’energia spesa all’andata.
Cap. 3
Pagina 9 di 24
Principio di Carnot e sue conseguenze
Il principio di Carnot ha una validità fino ad ora mai smentita. In un’era
in cui sono stati riesaminati molti principi della Fisica classica e moderna
(principi gravitazionali, teoria della relatività, costituzione della materia, la
stessa conservazione della materia e dell’energia), il principio di Carnot ha retto
di autorità in tutti quei processi di conversione che passano attraverso il calore.
Dal principio di Carnot derivano le seguenti osservazioni:
1) solo una parte del calore viene trasformato in energia meccanica;
2) non si ha produzione di energia meccanica se non si scarica la
quantità di calore residua (in un fiume, nel mare, nell’atmosfera) con
conseguente inquinamento termico;
3) il massimo di conversione energetica si ottiene seguendo un ciclo
termodinamico in cui tutta la quantità di calore di calore spesa Q 1 sia
fornita alla massima temperatura T 1 possibile (es. compatibile con la
resistenza dei materiali) e la quantità di calore residua Q 2 sia scaricata
alla minima temperatura possibile T 2 . Questa minima temperatura
rappresenta la temperatura ambiente, in quanto l’unico posto dove
riversare Q 2 è l’ambiente e la temperatura T 2 non può essere
inferiore a T a perchè il calore passa solo da un corpo più caldo ad uno
più freddo.
Si può definire come efficienza la grandezza:
=
lavoro ottenuto L
=
Q1
calore speso
,
(si fa notare che molti chiamano questo rapporto rendimento energetico; però,
volendo qui distinguere fra calore e lavoro considerate come grandezze diverse,
questo vocabolo preferiremmo evitarlo e riservarlo a rapporti fra grandezze
omogenee).
Cap. 3
Pagina 10 di 24
La massima produzione di lavoro coincide con il massimo di efficienza. Ciò
si ottiene con un ciclo di Carnot fra le temperature T 1 e T 2 (temperature
assolute), con T 2=T a .
Si dimostra che:
1) l’efficienza del ciclo di Carnot è indipendente dal tipo di sostanza
che lo compie;
2) per un ciclo compiuto da un gas ideale tale efficienza vale:
Carnot =
Q
T
L
=1− 2
=1− 2 .
Q 1 Carnot
Q 1 Carnot
T1
Come conseguenza dei due enunciati sopra indicati si deduce che l’efficienza
del ciclo di Carnot vale in ogni caso:
Carnot =1−
T2
.
T1
Si nota quindi che la quantità di calore Q 1 non è significativa a
rappresentare il lavoro ottenibile, senza che sia contemporaneamente definita la
temperatura T 1 a cui essa è disponibile e la temperatura T 2 (coincidente
con la temperatura ambiente T a ).
Nella tabella 3.1 sono riportate le corrispondenze fra il calore ed il lavoro
massimo ottenibile secondo Carnot, in funzione della temperatura alla quale
tale calore è disponibile; nella stessa tabella è anche riportata l’efficienza del
ciclo di Carnot.
Il confronto fra l’efficienza dei vari impianti, fatto sulla base dell’assunzione
che il calore sia una forma di energia equivalente alle altre, cioè sulla base del
principio di equivalenza, porta a risultati fuorvianti in quanto non vengono
distinti fra loro l’inconvertibilità di una parte del calore speso e l’effettiva
perdita per deficienze dovute al processo di conversione. Molto più significativa
appare invece la grandezza rendimento valutata come rapporto fra l’energia
ottenuta e quella parte del calore speso che si può convertire in energia cioè
Cap. 3
Pagina 11 di 24
l’energia utilizzabile, sulla base del dettato del principio di Carnot.
Per fare questo definiamo come energia utilizzabile o exergia B , in base al
principio di Carnot, l’energia meccanica massima che possiamo produrre con
una quantità di calore Q 1 , e precisamente:
B=Lmax =⋅Q 1=1−
T2
⋅Q 1
T1
;
con T 2=T a = temperatura ambiente; ovviamente tale grandezza sarà
espressa in J.
Tabella 3.1 – Lavoro massimo ottenibile da 1 Jt di calore ed efficienza della
conversione secondo Carnot.
Q1
T1
Ta
εc
Lmax =B
Q2
Jt
K
K
------
J
Jt
1
1800
300
0,83
0,83
0,17
1
1200
300
0,75
0,75
0,25
1
600
300
0,5
0,5
0,5
1
300
300
0
0
1
In definitiva il valore “energetico” di Q 1 non è conseguente al suo
numero di Joule termici , ma anche al corrispondente livello di temperatura
T 1 (vedi Tabella 3.1) .
La quantità di calore Q 1 non sempre può essere fornita ad una
temperatura costante T 1 , ma può derivare da una sorgente che cambia di
Q 1 può essere considerata come la
temperatura. In tal caso la quantità
somma di tanti dQ infinitesimi, ciascuno fornito ad una temperatura assoluta T
non costante. Ad ognuna di queste quantità di calore infinitesime corrisponderà
Cap. 3
Pagina 12 di 24
una exergia:
d B=d Q⋅1−T a /T ,
cui corrisponderà come somma:
b
b
b
Ta
dQ
Bb−B a=∫ 1− d Q=∫ dQ−T a∫
= Q 1−T a S b – S a .
T
a
a
a T
I limiti di integrazione a e b rappresentano due stati iniziale (ambiente) e
finale della somministrazione di calore.
Nel caso si abbia a che fare con una sostanza che, nell'intervallo considerato,
abbia una capacità termica C = costante (la capacità termica è pari alla massa m
per calore specifico c) :
d Q=C dT e anche Q=C T b−T a
da cui:
b
b
Ta
Bb−B a=∫ 1− d Q=∫ dQ−T a C
T
a
a
=
Q1 [1−
b
∫ dTT
a
= Q1 −T a C log
Tb
=
Ta
Ta
T
log b ]
T b−T a
Ta
Nella tabella 3.2 è riportata una esemplificazione dell'exergia corrispondente
ad una quantità di calore unitaria per temperature variabili fra T 1 e T a .
Cap. 3
Pagina 13 di 24
Tabella 3.2 – Lavoro massimo ottenibile da 1 Jt di calore a temperatura
variabile fra T 1 e T a ed efficienza della conversione secondo Carnot.
Q1
T1
Ta
εc
Lmax =B
Q2
Jt
K
K
------
J
Jt
1
1800
300
0,64
0,64
0,36
1
1200
300
0,54
0,54
0,46
1
600
300
0,31
0,31
0,69
1
300
300
0
0
1
La grandezza S, che si dimostra essere una funzione di stato, prende il nome
di entropia e rappresenta la grandezza termodinamica che, moltiplicata per
la temperatura T a dell’ambiente in cui si lavora, costituisce la parte del
calore che non si potrà in alcun modo convertire in lavoro (e che nel
processo dovrà essere scaricato in ambiente).
La grandezza B (una volta stabilito il valore di T a ) è una funzione di stato
in quanto presenta un valore unico in relazione alle situazioni (gli stati) a e b (se
così non fosse si potrebbero creare operazioni dirette ed inverse con produzione
di energia). Allo stesso modo la funzione entropia è anch’essa una funzione di
stato.
Per l’entropia si può considerare uno stato di riferimento (per i gas 1 bar e
273,15 K) cui si attribuisce un valore di S o=0 ; in tal caso nella precedente
espressione interverranno sempre le differenze di tali grandezze fra lo stato
iniziale a e quello finale b .
Per l'exergia B la condizione di riferimento è l'ambiente per cui B o=0 per
T o=T a e p o= p a
Si suole infine definire come fattore di Carnot, nel caso di sorgente a
temperatura costante, il termine:
Cap. 3
Pagina 14 di 24
N C =C =1−
T2
,
T1
mentre nel caso generale, fra la condizione di riferimento 0 e quella 1:
T a 1 dQ
S1
N C =C =1−
⋅∫
=1−T a
Q1 0 T
Q1
.
Conviene sottolineare che N C appare, come espressione analitica, essere
un numero puro (somma di uno e di un rapporto fra temperature); a noi
conviene attribuire l'unità di misura J / Jt per far quadrare i controlli
dimensionali e per chiaramente distinguere calore da energia utilizzabile
(exergia) associato a quest'ultimo.
Le conversioni energetiche e le perdite vengono chiaramente e
proficuamente valutate sulla base della funzione exergia, che si sottolinea
rappresenta l’energia utilizzabile; le equazioni di bilancio di primo principio
(impropriamente chiamate di bilancio energetico) vanno considerate come
mezzo per il controllo e la verifica di non aver dimenticato nulla nel bilancio
exergetico.
Le equazioni di bilancio exergetico possono essere applicate, oltre che ad un
intero impianto, in cui la sostanza intermediaria realizza un ciclo, anche ad un
qualsiasi suo componente, considerato come un sistema aperto, cioè
caratterizzato da un condotto d’ingresso ed uno di uscita attraverso i quali la
sostanza fluisce; in questo modo vengono quindi localizzati i componenti meno
efficienti, identificandone le cause.
Per far questo, in uniformità alle energie meccaniche, elettriche, ecc.,
misureremo in Joule anche le exergie per cui:
1 J di exergia = 1 Joule di energia meccanica, elettrica, magnetica, chimica,
nucleare, ecc.;
e pertanto per la relazione precedente:
B 1 espresso in J = Q 1 espresso in Jt moltiplicato per
Cap. 3
Pagina 15 di 24
Nc .
Nella tabella 3.2 sono indicate alcune corrispondenze.
Da questa tabella appare evidente che bruciando 1 kg di combustibile
liquido, dal quale si sviluppano circa 40.000 kJ di energia chimica, pari ad
altrettanti kJ ; se la stufa riuscisse a convertire tutti i 40.000 kJ in calore forniti
ad acqua a 400 K (circa 130 °C), si otterrebbero 40.000 kJt, corrispondenti a
solo 40.000 x 0,25 = 10.000 kJ con una perdita del 75%.
Una corretta conversione avrebbe invece dovuto portare 40.000 kJ all’acqua ,
cioè a 160.000 kJt per il riscaldamento (4 volte tanto!!).
Si ribadisce ancora che l’efficienza, definita in precedenza come rapporto fra
lavoro ottenuto e calore speso, per un qualsiasi processo reale di conversione da
calore a lavoro, non chiarisce se un basso valore di tale grandezza sia
imputabile alla macchina mal progettata e con molte perdite ovvero se dipenda
dal fatto che il calore fornito presenta una bassa energia utilizzabile.
Per questo fatto si può introdurre la grandezza rendimento (che molti
indicano come exergetico o di secondo principio, avendo già impegnato questo
vocabolo al posto di efficienza):
=
Energia utilizzabile ottenuta Exergia ottenuta
=
Energia utilizzabile spesa
Exergia spesa
Si vede immediatamente che:
=
L
L L max
=
⋅
=⋅N C =⋅C .
Q 1 L max Q 1
La tabella 3.3 esemplifica alcune situazioni.
Cap. 3
Pagina 16 di 24
.
Tabella 3.3 – Corrispondenze fra calore ed energie sotto altre forme.
εc
Corrispondenza
------
1
1J = 1J
------
------
1
1J = 1J
magnetica
------
------
1
1J = 1J
chimica
------
------
1
1J = 1J
nucleare
------
------
1
1J = 1J
fra le temperature costanti
400
300
0,25
Jt = 0,25J
fra le temperature costanti
500
300
0,4
Jt = 0,40J
fra le temperature costanti
800
300
0,63
Jt = 0,63J
T1
T2
K
K
elettrica
------
meccanica
Tipo di grandezza
ENERGIA
CALORE
Il ciclo di Carnot è difficilmente eseguibile con le macchine reali per cui il
rendimento (exergetico) è inferiore all’unità: ne consegue che l’efficienza di un
ciclo generico è inferiore a quello del ciclo di Carnot fra le stesse temperature
estreme.
Il ciclo di Carnot può anche essere percorso in senso inverso; in questo caso
(vedi Figura 3.2) il lavoro è speso ed il calore passa dalla bassa all’alta
temperatura (si spende lavoro per sollevare il calore da un livello di temperatura
basso a uno più elevato).
Cap. 3
Pagina 17 di 24
Figura 3.2 – Schema di ciclo inverso.
Si possono allora presentare le seguenti situazioni ( T a corrisponde alla
temperatura ambiente):
T 1=T a , in tal caso T 2T a cioé la capacità a bassa
1)
temperatura è più fredda dell’ambiente (macchina frigorifera); dalla
capacità fredda si preleva calore.
T 2=T a , in tal caso T 1T a , cioé la capacità ad alta
2)
temperatura è più calda dell’ambiente (pompa di calore); alla capacità
calda si fornisce calore.
Anche in questi casi nella pratica si utilizza una grandezza che ha una certa
somiglianza con l’efficienza in precedenza definita, essendo il rapporto fra la
grandezza fisica utile e quella spesa, grandezze che, come si vede, non sono
omogenee:
Cap. 3
Pagina 18 di 24
1) per la macchina frigorifera:
cf =
=
Calore sottratto a bassa temperatura
=
Lavoro speso
Q 2 Q 2 L min
1
⋅
−1⋅ ;
=
=
L L min L
NC
2) per la pompa di calore:
pc =
=
Calore fornito ad alta temperatura
=
Lavoro speso
Q 1 Q 1 L min 1
=
= ⋅ .
⋅
L L min L
NC
Si fa notare che, trattandosi in questi casi di operazioni inverse, con il ciclo
di Carnot si spende il minimo di lavoro rapportato alla quantità di calore
somministrata alla capacità calda o sottratta alla capacità fredda ed al salto di
temperatura fra le capacità calda e fredda.
Nelle precedenti relazioni è sempre inferiore all’unità indicando tale
grandezza la deviazione fra la macchina reale e quella di massima efficienza
(ciclo di Carnot inverso) mentre il valore dell’efficienza può essere anche
superiore all’unità .
Nel linguaggio tecnico le citate efficienze prendono i nomi seguenti:
1) per la macchina frigorifera: ef effetto frigorifero specifico o anche,
con un termine di derivazione americana coefficiente di prestazione (C.O.P.);
2) per la pompa di calore: pc coefficiente di moltiplicazione termica.
E' infine possibile definire l'exergia di una quantità di calore che si trovi a
temperatura T 2 inferiore a quella dell'ambiente; essa corrisponde al lavoro
Cap. 3
Pagina 19 di 24
reso disponibile da una macchina ideale (Carnot) fra le temperature T a e
T 2 ma riferito a Q2 . Lavoro identico è quello speso per estrarre Q2
dalla temperatura T 2 e scaricare Q1 nell'ambiente a T a :
B=L max=1−
T2
T
⋅Q 1=1− 2 ⋅Q 2Lmax
Ta
Ta
da cui:
Lmax=Q2⋅
T2
−1
Ta
La tabella 3.4 mostra qualche esempio numerico di questa relazione.
Tabella 3.4 – Lavoro massimo (exergia) ottenibile o speso per 1 Jt di calore
Q2 ceduto o preso a temperatura T 2 costante ed inferiore all'ambiente ed
efficienza della conversione secondo Carnot.
Q1
Ta
T2
ec
Lmax =B
Q2
Jt
K
K
------
J
Jt
1,2
300
250
0,2
0,2
1
1,5
300
200
0,5
0,5
1
3
300
100
2
2
1
6
300
50
5
5
1
300
300
1
299
299
1
Anche per le temperature inferiori all'ambiente variabili bisogna fare le
stesse considerazioni effettuate per le temperature superiori all'ambiente.
Dalla tabella 3.4 si nota come all'approssimarsi dello zero assoluto l'exergia
tende ad infinito mostrando la impossibilità di raggiungere tale traguardo.
Cap. 3
Pagina 20 di 24
Funzioni di stato e funzioni della trasformazione
Le varie grandezze termodinamiche esaminate si distinguono in funzioni di
stato e funzioni della trasformazione.
Le funzioni di stato sono quelle grandezze il cui valore è definito (cioé
unico) noto lo stato termodinamico della sostanza in esame (ad esempio
pressione, volume specifico, temperatura, exergia, entropia, ecc..); di queste
alcune sono definite da un valore assoluto (es. pressione, volume specifico),
altre a meno di una costante additiva (temperatura, entropia); la costante
additiva può essere calcolata fissando una condizione di riferimento (ad
esempio temperatura assoluta pari a 273,15 in corrispondenza del punto triplo
dell’acqua; entropia nulla per una sostanza monocomponente in corrispondenza
allo stato definito dalla temperatura assoluta di 273,15 K e dalla pressione di 1
bar).
L’exergia ha come riferimento, per definizione, la temperatura della capacità
fredda coincidente normalmente con la temperatura ambiente.
Per tutte le grandezze anzidette è ovvio che la differenza fra due stati è
indipendente dalle operazioni (trasformazioni) che sono state percorse per
passare da uno stato all’altro. Per questa proprietà queste grandezze vengono
anche chiamati potenziali ed i relativi differenziali vengono chiamati
differenziali esatti.
Altre grandezze invece dipendono dalla trasformazione effettuata (ad
esempio la quantità di calore, messa in gioco nel passaggio da uno stato ad un
altro, dipende dal percorso, cioé dalla linea di trasformazione; si potrà avere
una quantità di calore scambiata a volume costante, un’altra a pressione
costante ecc..); i relativi differenziali sono detti non esatti o funzioni della
trasformazione.
E’ evidente che le funzioni che ammettono potenziali, cioé quelle di stato,
sono le più utili in quanto sono tabulabili.
Purtroppo alcune delle grandezze interessanti per lo studio delle macchine
non sono variabili di stato e pertanto un componente di una macchina, percorso
da una sostanza, deve essere conosciuto nelle operazioni che in esso si
realizzano al fine di stabilire la trasformazioni che in esso avvengono. A volte si
può evitare di entrare nel dettaglio delle operazioni avvenute nel componente in
esame, se si riesce a derivare la grandezza richiesta da relazioni che la legano a
Cap. 3
Pagina 21 di 24
funzioni di stato valutate per la sostanza in ingresso ed in uscita.
Si fa notare che le funzioni definite a meno di una costante additiva possono
anche essere considerate come funzioni definite tramite il loro differenziale.
Exergia come funzione di stato; diagrammi e formule
L’exergia è una funzione di stato (se ne intuisce la dimostrazione pensando
che essa rappresenta il lavoro massimo ottenibile) che ha purtroppo
l’inconveniente di essere legata ad un prestabilito valore della temperatura
ambiente T a . Per questo motivo molte persone mostrano perplessità ad un
suo uso corrente.
Comunque, stabilita una temperatura ambiente di riferimento, è possibile
dotarsi di tabelle, diagrammi o formule sperimentali per le sostanze
normalmente usate nelle macchine e negli impianti, ovvero considerare tale
grandezza come differenza fra la quantità di calore ed il prodotto della
temperatura ambiente per l’entropia.
Il passaggio da un valore di temperatura ambiente ad un altro può essere
effettuato utilizzando la relazione direttamente derivata dalla definizione di
exergia:
B 2=B 1−T a2T a1 S 1 ,
che richiede la conoscenza, sempre tramite tabelle diagrammi o formule,
dell’entropia.
Altre relazioni, che permettono di calcolare l’exergia in funzione di altre
grandezze termodinamiche (es. dell’entalpia, del calore interno, ecc..), verranno
viste più oltre.
Cap. 3
Pagina 22 di 24
Capitoli della termodinamica
Come già specificato, la trattazione viene successivamente suddivisa nei
seguenti capitoli:
Capitolo quarto e quinto – Termodinamica del calore
Viene esaminata la fisica della conversione del calore in energia e viceversa
considerando il sistema che opera come un sistema il cui contenuto non viene
indagato; se il calore viene scambiato come tale il sistema viene chiamato
sistema chiuso (Capitolo quarto), mentre se esso viene anche scambiato con
l’intermediario di un fluido vettore, le cui trasformazioni entro la macchina non
fanno oggetto di considerazioni, ma che fluisce in modo continuo senza
accumuli, parleremo di sistema aperto (Capitolo quinto).
Capitolo sesto – Analogie
Quanto svolto è sufficiente per mostrare la perfetta analogia fra sistemi
termodinamici e sistemi elettromeccanici, per quanto concerne la conversione
dell’energia.
Capitolo settimo – Proprietà delle sostanze
Le proprietà termofisiche delle sostanze vengono trattate nel capitolo
settimo; non ci si sofferma eccessivamente su questa parte in quanto le sostanze
costituiscono un intermediario nel processo.
Capitolo ottavo – Trasformazioni termodinamiche
Con la stessa
termodinamiche .
impostazione
vengono
trattate
le
trasformazioni
Capitolo nono – Componenti termodinamici aperti
Si hanno a questo punto gli elementi per indagare sui componenti
termodinamici aperti nei quali si produce lavoro tramite un fluido che
attraversa in modo continuo tali apparecchi.
Cap. 3
Pagina 23 di 24
Capitolo decimo – Cicli termodinamici
Vengono esaminati i cicli termodinamici compiuti dalle macchine a gas ed
a vapore con i calcoli delle efficienze e dei rendimenti; alcuni esempi numerici
sottolineano le grandi differenze di valore fra le due grandezze.
Capitolo undicesimo – Rigenerazione termica
Viene esaminato il concetto di rigenerazione termica alla luce del principio
di Carnot.
Capitolo dodicesimo – Equazione generale del moto dei fluidi
Si mostra come l’equazione di bilancio delle quantità di moto possa essere
dedotta dall’equazione di bilancio delle energie utilizzabili (exergie) per i
sistemi aperti con piccolo scambio di calore.
Alcuni fogli lettronici di calcolo numerico apribili direttamente dal testo ed
altri raggiungibili attraverso un percorso guidato, permettono seguire le
modalità di calcolo, di verificare i propri calcoli e, cambiando i dati di ingresso,
comprendere l'influenza di alcuni parametri sul risultato finale.
Alcune appendici con tabelle di formule ricorrenti e diagrammi
termodinamici completano l’opera.
Cap. 3
Pagina 24 di 24