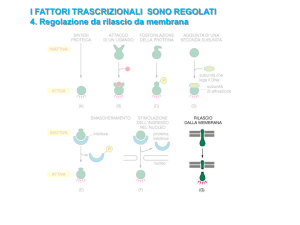
X
B
D
Y
W
?? A, B o D?
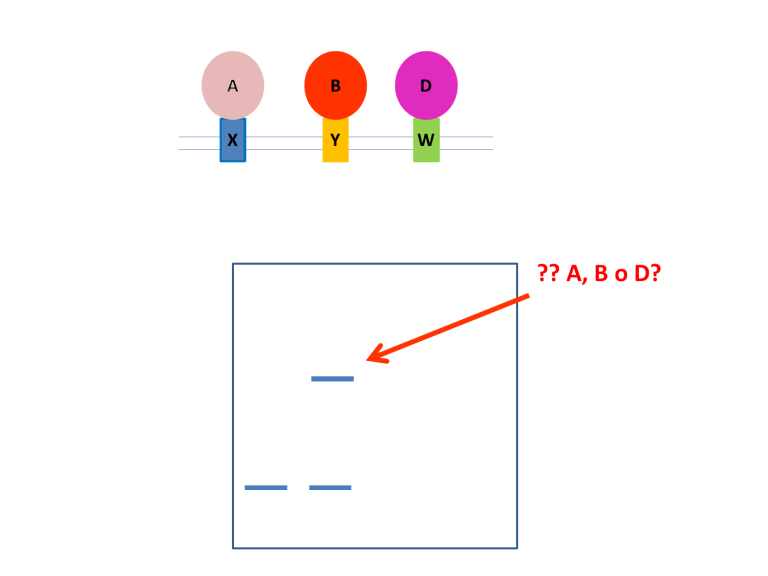
IMMUNOPRECIPITAZIONE
DELLA CROMATINA ChIP
SREBP-1c REGOLA L’ESPRESSIONE DEL GENE GLUT2 NEL FEGATO
IN RISPOSTA AL GLUCOSIO
GLUT2 è espresso principalmente nelle cellule β del pancreas e nellea membrana
basolaterale dei tubuli renali prossimali. Gioca un ruolo importante nell’omesotasi del
glucosio. E’ noto che la trascrizione del gene GLUT2 è upregolata nel fegato durante
l’iperglicemia post-prandiale o nel diabete di tipo 2, ma il meccanismo molecolare con cui
il glucosio attiva l’espressione di GLUT2 non è noto.
In questo studio I ricercatori riportano evidenze sperimentali che SREBP-1c gioca un
ruolo chiave nell’induzione dell’espressione del gene GLUT2 (2005)
BACKGROUND
GLUT2 trasporta il glucosio attraverso la membrana plasmetica degli epatociti
Il GLUCOSIO upregola GLUT2
NEL DIABETE GLUT2 è upregolato -> l’iperglicemia potrebbe regolare positivamente
l’espressione di questo gene
Le proteine SREBP sono importanti nel metabolismo del colesterolo
SREBP-2 regola I geni della biosentesi del colesterolo
SREBP-1c regola la sintesi degli acidi grassi nel fegato
I livelli di glucosio influiscono sui livelli di SREBP
Nei modelli animali di diabete (topi ob – insulino-resistenti, o topi KO per
insulina) di SREBP 1-c sono aumentati.
IPOTESI: L’UPREGOLAZIONE DI GLUT2 NEL FEGATO PUO’ ESSERE DOVUTA
ALL’ATTIVAZIONE DEL GENE DA PARTE DI SREBP-1c
Il promotore di GLUT2 contiene un cis-element per SREBP 1-c
Electrophoretic mobility shift assay of GLUT2SRE. The assay was performed with
recombinant SREBP-1 protein in 4% (wt/vol)
nondenaturing polyacrylamide gel
Effect of mutation on the SREBP-1 binding to the
putative GLUT2-SRE. SRE mutant was prepared by
replacing TGA with AAC. Wild-type and mutant probes
were labeled with [γ-32P]ATP, and EMSA was
performed in 4% (wt/vol) nondenaturing polyacrylamide
gel.
IL GLUCOSIO STIMOLA IL LEGAME DI SREBP-1 AL PROMOTORE DI
GLUT2 NEGLI EPATOCITI PRIMARI DI TOPO
Chromosomal DNA from primary cultured hepatocytes was cross-linked using formaldehyde, and an
antibody specific to SREBP-1 was used to immunoprecipitate the chromatin fragment. A specific region
of the GLUT2 promoter (−84/−76) was amplified by PCR. The binding of SREBP-1 to the GLUT2 promoter
was increased by glucose or glucose/insulin treatment (Fig A). The SREBP-1 binding to the GLUT2
promoter was increased in a dose-dependent manner (Fig. B). However, insulin did not affect the binding
of SREBP-1 to the putative SRE. These results indicate that glucose could be one of the major factors in
the binding of SREBP-1 to the GLUT2 promoter, which may help explain the upregulation of GLUT2 gene
expression by glucose.