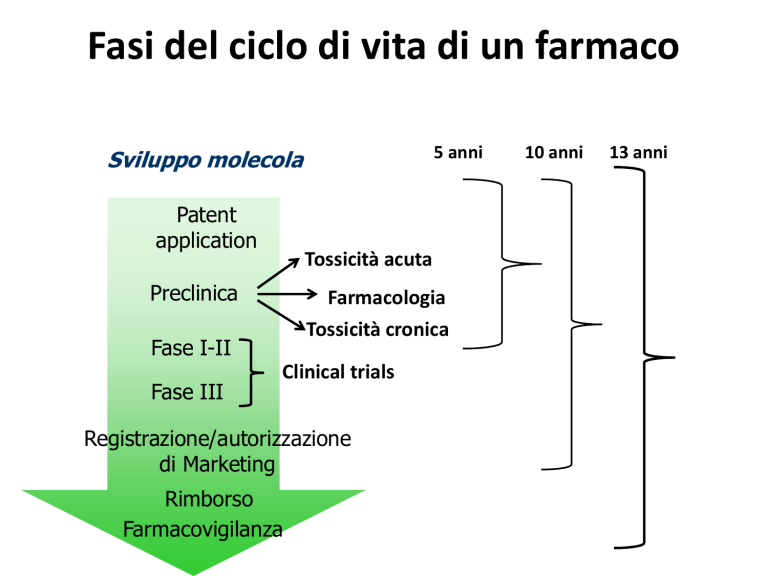
Fasi del ciclo di vita di un farmaco
5 anni
Sviluppo molecola
Patent
application
13 anni
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
Fase I-II
Fase III
10 anni
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
1
Farmaci Innovativi
Farmaci innovativi sono quelli che apportano
contributi in termini di:
• Attività terapeutica
• Minori effetti collaterali
• Diverso meccanismo d’azione per curare una
patologia già nota
80% del mercato
Farmaci Me Too
• Minore innovatività
• Ridotti vantaggi terapeutici
20% del mercato
Farmaci OTC
• Non sono soggetti a prescrizione medica
Caratteristiche:
• Composizione: principi attivi già largamente impiegati in terapia da almeno 5 anni
•
•
•
•
•
•
dalla immissione sul mercato;
Indicazioni terapeutiche: patologie per le quali la valutazione dei sintomi viene
effettuata dallo stesso paziente (disturbi di lieve entità)
Vie di somministrazione: tutte tranne la via parenterale e la somministrazione
aerosol
Posologia: mantenuta nei limiti di sicurezza per unità posologica e per confezione
a seconda del tipo di specialità
Confezioni: volume ridotto per terapie di breve durata, pratiche e non pericolose.
Rimborsabilità: non sono rimborsati, quindi non sono tra quelli inclusi nel SSN.
Marchio: esclusi quei marchi comuni a specialità soggette a prescrizione medica
ripetibile o non ripetibile o a farmaci a carico del SSN
Farmaci lifestyle
• Farmaci sviluppati o utilizzati per correggere alterazioni fisiopatologiche
non gravi
• Soddisfano alcune esigenze legate al progressivo invecchiamento della
popolazione.
Diverso concetto di salute: non solo assenza di malattia
ma anche desiderio di benessere fisico e psicologico
Il termine si riferisce ad una serie di farmaci che hanno lo scopo di migliorare la
qualità della vita ed il benessere degli utenti
Farmaci lifestyle
• Sono stati erroneamente inclusi in categorie di farmaci quali valido
presidio per prevenire primariamente o secondariamente patologie
correlate allo stile di vita che vanno a migliorare o ad insane abitudini
che vanno a correggere, come fumo ed alimentazione.
Il loro successo
è dovuto
Recondita speranza che una compressa possa:
Contrastare gli effetti dell’età
Risolvere una condizione fisica fastidiosa
I mass media hanno creato danni
Grandi aspettative in questi farmaci, valicando anche il controllo
delle industrie produttrici
Farmaci lifestyle
Brand management: uno degli aspetti più delicati
Sin dalle fasi antecedenti l’accesso al mercato attento Brand
management informazione più corretta, minori
distorsioni comunicazionali, utilizzo corretto ed utile per il
paziente.
Previsioni di mercato:
È stato stimato che questi farmaci andranno a costituire il 15% del
mercato farmaceutico
Aree di interesse: disfunzioni maschili, miglioramento cognitivo,
fobie sociali, depressione, antiaging
Farmaci lifestyle: fattori favorenti
Caratteristiche sociali:
1. Medicalizzazione del processo naturale di invecchiamento
2. Erosione di tabù sociali
Caratteristiche della malattia:
1. Legata all’invecchiamento
2. Esteriorità dei sintomi
3. Cronicizzazione
4. Sintomi associati di rilievo
5. Elevato interesse sociale e mediatico
6. Riduzione della qualità della vita
Caratteristiche del prodotto:
1. Efficace e con risultati visibili
2. Effetti collaterali blandi
3. Dosaggio semplice
4. Facile da prendere
Farmaci bioequivalenti
• Farmaci contenenti principi attivi di cui è
scaduta la protezione brevettuale e che
possono essere prodotti e commercializzati da
chiunque
• Innovatività nulla
Fasi del ciclo di vita di un farmaco
Sviluppo molecola
Patent
application
L’Azienda titolare dell’innovazione ha
interesse a richiedere la tutela
brevettuale fin dalla scoperta del
principio attivo, anche se, così agendo, il
tempo effettivo di durata del brevetto
risulta inevitabilmente più limitato.
Fasi del ciclo di vita di un farmaco
Sviluppo molecola
Patent
application
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
La scoperta di un nuovo farmaco è il risultato
di una complessa attività di ricerca e
sviluppo, molto onerosa sotto il profilo
economico e finanziario, ma con risultati
estremamente incerti.
Il percorso iniziale di ogni nuova molecola si
articola su due fondamentali criteri di
valutazione del rapporto sicurezza/qualità
che sono:
- test di valutazione della tossicità
sperimentale;
- test di sicurezza e di efficacia clinica.
A questi due principali valutazioni seguono
ulteriori sperimentazioni che sono:
nell’ambito della tossicità sperimentale
vengono testate la tossicità a breve e a
lungo termine, la carcinogeneticità (ovvero
la prevedibilità delle possibili proprietà
carcinocinetiche dei medicamenti) e la
tossicologia della riproduzione, cioè la
ricerca di eventuali effetti tossici indotti sulla
riproduzione e sullo sviluppo della prole
realizzato negli animali da laboratorio.
Sviluppo molecola
Patent
application
Preclinica
Fase I
Tossicità acuta
Farmacologia
Tossicità cronica
Fase I: valutazione degli effetti del farmaco
su un numero ristretto di volontari sani.
Tale fase, definita pilota, stabilisce con
maggior precisione l’ipotesi terapeutica e
definisce nel migliore dei modi gli schemi di
trattamento da utilizzare nelle successive
fasi di sperimentazione (dosi, forme,
farmaceutiche, tempi di somministrazione
in rapporto a studi di farmacocinetica).
Sviluppo molecola
Patent
application
Preclinica
Tossicità acuta
Farmacologia
Tossicità cronica
Fase I
Fase II
Fase II: valutazione dell’attività di un
farmaco su un numero ristretto di pazienti
affetti da una particolare forma morbosa
specifica: l’attività farmacologica può
essere confrontata con placebo o con uno o
più farmaci di controllo.
Sviluppo molecola
Patent
application
Preclinica
Fase I
Tossicità acuta
Farmacologia
Tossicità cronica
Fase II
Fase III
Fase III: si amplia in maniera consistente sia
il numero di pazienti sia quello dei criteri
clinici coinvolti; anche in questi studi si
usano come controllo o il placebo o altri
farmaci.
Sviluppo molecola
Patent
application
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
Fase I-II
Fase III
Dossier Tecnico
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
Il farmaco può essere commercializzato
soltanto dopo che il titolare ha ottenuto
un’apposita autorizzazione
alla
l
commercializzazione (AIC) dall’AIFA o
EMA
Sviluppo molecola
Patent
application
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
Fase I-II
Fase III
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
Attribuzione del prezzo
l e rimborsabilità
Sviluppo molecola
Patent
application
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
Fase I-II
Fase III
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
riguarda la sorveglianza da adottare allorchè un farmaco è già
sul mercato e, quindi già diffuso a livello terapeutico. Lo scopo
di questa attività definita farmacovigilanza, sta nella possibilità
di individuare effetti tossici a bassa frequenza che possano
non essere emersi nelle fasi II e III.
Flusso di cassa di un farmaco
+
Scadenza
brevettuale
lancio
-
4
6
8
10
12
14 16
18
Anni
Durante la fase brevettuale l’inventore deve assicurarsi che il prodotto gli consenta di
recuperare non solo l’investimento in ricerca necessario per l’ingresso sul mercato, ma
anche tutti gli investimenti su altri prodotti che, durante le fasi della ricerca, non hanno
superato le prove sperimentali (e non sono perciò divenuti farmaci)
Sviluppo molecola
Patent
application
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
Fase I-II
Fase III
Dossier Tecnico
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
Il farmaco può essere commercializzato
soltanto dopo che il titolare ha ottenuto
un’apposita autorizzazione
alla
l
commercializzazione (AIC) dall’AIFA o
EMA
Nel momento in cui l’AIC è concessa, questa ha una durata di 5 anni e diviene la carta di
identità del farmaco, poiché stabilisce:
• il nome del medicinale;
• La sua composizione;
• la descrizione del metodo di fabbricazione;
• le indicazioni terapeutiche, le controindicazioni e le reazioni avverse;
• la posologia, la forma farmaceutica, il modo e la via di somministrazione;
• le misure di precauzione e di sicurezza da adottare per la conservazione del medicinale e
per la sua somministrazione ai pazienti;
• il riassunto delle caratteristiche del prodotto;
• un modello dell'imballaggio esterno;
• il foglio illustrativo;
• la valutazione dei rischi che il medicinale può comportare per l'ambiente.
Modalità di registrazione nazionale:
Quando per un medicinale è stata rilasciata un’ AIC, ogni successiva modifica nel dosaggio o
nella forma farmaceutica, nella presentazione o nella via di somministrazione, comporta la
richiesta di un’ulteriore autorizzazione.
Modalità di registrazione comunitaria
Quest’ultima prevede l’Autorizzazione all’Immissione in Commercio dei medicinali secondo
procedure che coinvolgono tutti i Paesi membri Unione europea (procedura centralizzata) o
parte di essi (procedura di mutuo riconoscimento e decentrata).
Procedura centralizzata
E’ obbligatoria per medicinali derivati da procedimenti biotecnologici, medicinali per
il trattamento della sindrome da immunodeficienza acquisita, del cancro, dei
disordini neurodegenerativi, del diabete, per i medicinali per malattie autoimmuni
e altre disfunzioni immunitarie e malattie virali. Inoltre, è previsto un accesso
facoltativo alla procedura centralizzata anche per medicinali che non rientrano nelle
classi menzionate ma che siano giudicati innovativi sul piano terapeutico, scientifico
o tecnologico o la cui autorizzazione comunitaria sia ritenuta utile per i pazienti.
Procedura di mutuo riconoscimento
Meccanismo di riconoscimento reciproco tra diversi paesi membri dell’Ue
dell’autorizzazione all’immissione in commercio di un farmaco. Può essere utilizzata
soltanto per i farmaci tradizionali.
L’AIC può essere rinnovata solo dopo un’accurata valutazione del rapporto
rischio/beneficio dell’AIFA sulla base di dossier aggiornati, presentati dal titolare entro
sei mesi dalla scadenza.
Dopo tale rinnovo, la validità è praticamente illimitata, salvo diversa indicazione
dell’AIFA/EMEA.
Se però nei successivi tre anni il prodotto non è commercializzato essa decade.
Altre possibilità di decadenza sono: revoca
la sospensione
la rinuncia
Imposte dall’AIFA
Scelta deliberata dal titolare
Revoca quando:
Definitivo ritiro
dal commercio
Il medicinale è nocivo nelle normali condizioni di impiego
Il medicinale non permette di ottenere l’effetto per il quale è stato
autorizzato
Il rapporto rischio/beneficio non è favorevole nelle normali
condizioni di impiego
Il medicinale non ha la composizione quali/quantitativa dichiarata
le indicazioni nel dossier sono errate o non sono state modificate se
necessario
Sospensione quando: l’AIFA necessita di acquisire ulteriori informazioni
Ritiro dal commercio
per un certo periodo
di tempo
Rinuncia quando
Disposta dal titolare a cui segue un decreto di revoca predisposta
dall’AIFA (decreto di revoca su rinuncia), che può concedere
un tempo per il ritiro quando non ci siano motivi di salute pubblica
Sviluppo molecola
Patent
application
Tossicità acuta
Preclinica
Farmacologia
Tossicità cronica
Fase I-II
Fase III
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
Attribuzione del prezzo
l e rimborsabilità
Negoziazione e rimborsabilità
La determinazione del prezzo dei farmaci rimborsati dal Servizio Sanitario Nazionale,
mediante la contrattazione tra Agenzia Italiana del Farmaco e le Aziende Farmaceutiche
(L. 326/03), afferisce a questo settore di attività dell’AIFA che opera sulla base delle
modalità e dei criteri indicati sulla deliberazione CIPE 1/2/01: “ individuazione dei criteri
per la contrattazione del prezzo dei farmaci”.
la negoziazione del prezzo di una nuova specialità medicinale avviene secondo
i seguenti criteri:
rapporto costo/efficacia positivo: il medicinale è ritenuto utile per il trattamento di
patologie per le quali non esiste alcuna terapia efficace, o fornisce una risposta più
adeguata rispetto a farmaci già disponibili per le medesime indicazioni terapeutiche;
rapporto rischio/beneficio più favorevole rispetto a farmaci già disponibili
per le stesse indicazioni;
valutazione dell’impatto economico sul SSN;
miglior rapporto costo terapia /die a confronto con prodotti della stessa
efficacia;
stima delle quote di mercato acquisibili;
confronto con i prezzi e i consumi degli altri Paesi europei.
Nella valutazione dell’efficacia e del prezzo di un farmaco l’AIFA si avvale del supporto della
Commissione Tecnico Scientifica e del Comitato Prezzi e Rimborso e dei dati dei consumi e
della spesa farmaceutica forniti dall’Osservatorio Nazionale sull’impiego dei Medicinali
(OsMed). All’AIFA spetta inoltre il mantenimento dell’equilibrio economico relativo al tetto
fissato per la spesa farmaceutica convenzionata e ospedaliera, che governa tramite
l’applicazione di opportune misure di ripiano nel caso di sforamento, quali il pay back e
l’incentivazione all’impiego di medicinali equivalenti. E’ infine attivo un Sistema di
negoziazione dei prezzi on line per le Aziende che devono fornire la documentazione
necessaria alla negoziazione per il prezzo e il rimborso di un farmaco e attraverso il quale le
stesse aziende possono monitorare l’avanzamento delle varie fasi della procedura negoziale.
Farmaci bioequivalenti
Sviluppo molecola
Patent
application
Tossicità acuta
SonoPreclinica
richiesti solo
studi di
biodisponibilità
Fase I-II
Fase III
Farmacologia
Tossicità cronica
Clinical trials
Registrazione/autorizzazione
di Marketing
Rimborso
Farmacovigilanza
Concentrazione
plasmatica
Iniezione
endovenosa
Biodisponibilità assoluta:
F = Fraction escaping metabolism
AUCev
AUCorale
Somministrazione
orale
Tempo
AUCev e AUCorale = aree sotto le curve della concentrazione plasmatica in funzione del tempo
relative alla somministrazione per endovena ed orale, rispettivamente
Studi farmacocinetici
Parametri chiave.
Generico
Composto di riferimento
Cmax
•
AUC
– Area sotto la curva concentrazionetempo
•
Cmax
Concentrazione
– Massima concentrazione
– Una differenza più grande del 20% in
Cmax o dell’ AUC rappresenta una
differenza significativa tra I composti
in esame.
•
Tmax
– Tempo per raggiungere la max conc
AUC
Tmax
Tempo
Farmaci bioequivalenti
DEFINIZIONE DELL’ORGANIZZAZIONE MONDIALE DELLA SANITÀ (OMS):
Farmaco intercambiabile con il prodotto innovatore (Bioequivalente), che viene
messo in commercio dopo che sono scaduti il brevetto ed il certificato
complementare di protezione del farmaco originale.
Bioequivalenti con marchio
Nome di Fantasia
Bioequivalenti senza marchio
Nome del principio attivo
Farmaci bioequivalenti
Vantaggi: La ricerca è già stata affrontata da altri e già remunerata, quindi il loro prezzo è
molto più basso (fascia C).
La ricerca è già stata affrontata da altri e già remunerata, quindi il loro prezzo è
molto più basso (fascia C).
Integratori alimentari












