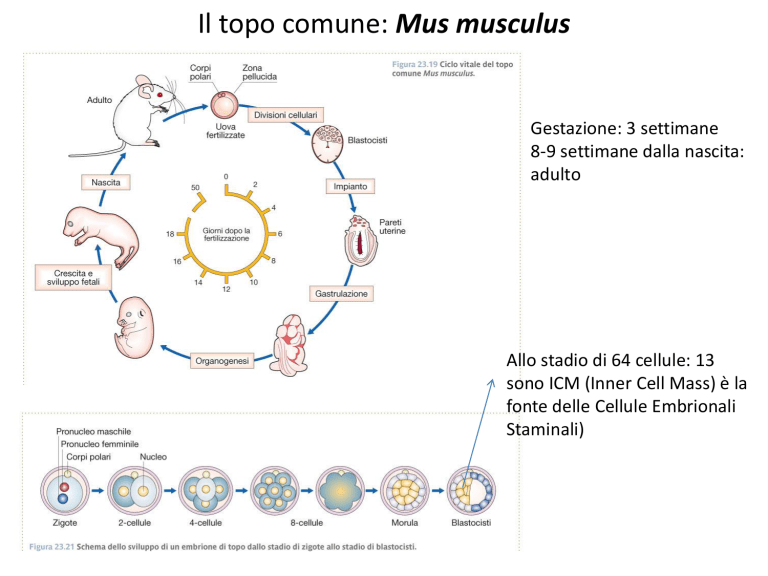
Il topo comune: Mus musculus
Gestazione: 3 settimane
8-9 settimane dalla nascita:
adulto
Allo stadio di 64 cellule: 13
sono ICM (Inner Cell Mass) è la
fonte delle Cellule Embrionali
Staminali)
Mus musculus: ciclo vitale
•
•
•
•
5-10 nidiate/anno
5-10 cuccioli/nidiata
19-21 giorni di gestazione
Maturità sessuale a 7
settimane
• 4-5 generazioni per anno
Mus musculus: caratteristiche del topo di laboratorio
- Ceppi inbred: accoppiamento fratello-sorella per almeno 30 generazioni
successive: 98.6% di omozigosi a tutti i loci
- Variabilità genetica nella popolazione diminuita
- Possibilità di fissare uno specifico fenotipo
Mus musculus e Rattus norvegicus: completato il
sequenziamento dei genomi
2002
2004
Pubblicazioni
2004-2013
532.000 topo
361.000 ratto
54.000 cane
34.000 Drosophila
15.000 zebrafish
13.000 C. elegans
Genoma di topo:
2500 Mb
19 autosomi + X, Y
Geni: circa 25000
Progenitore comune: 80
mln anni fa
Mappa di sintenia Uomo-Topo
SINTENIA: CONSERVAZIONE DELL’ORDINE LUNGO IL CROMOSOMA DI GENI
ORTOLOGHI IN UOMO E TOPO
Mus musculus: eccellente modello genetico per lo studio
dello sviluppo dei vertebrati
White spotting
Piebaldismo
Molte malattie genetiche umane hanno una controparte nel topo.
Creazione di topi transgenici o knock-out.
Consorzio Internazionale per la creazione di topi knock-out istituito 2007:
www.knockoutmouse.org
Mus musculus e Rattus norvegicus: applicazioni
• Modelli transgenici per:
• malattia di Alzheimer, sclerosi laterale, corea di Huntington ,
distrofie muscolari,
• tumorigenesi,
• ipertensione,
• malattie neurodegenerative,
• disordini psichiatrici (alterazioni comportamento, dipendenze),
• diabete,
• malattie autoimmuni (artride reumatide),
• rigenerazione tissutale e ossea,
• trapianti,
• tossicità dei farmaci
TRANSGENESI IN Mus musculus
Creazione di animali geneticamente modificati per:
- conferma di gene candidato responsabile di una patologia umana
- studio della funzione e della regolazione di un gene
- modelli animali per lo studio delle malattie umane
- modelli animali sperimentali:
per la correzione del difetto genetico (“rescue” fenotipico),
per messa a punto terapia farmacologica
Un organismo si considera transgenico quando il gene endogeno modificato o il
gene esogeno introdotto è:
• integrato nel suo genoma;
• espresso correttamente e selettivamente in uno o più tessuti dell'animale;
• integrato nella linea germinale e quindi trasmissibile dall’animale fondatore
alla progenie.
TRANSGENESI IN M. musculus
Malattie con aploinsufficienza ( analisi dell’eterozigote)
Malattie dominanti: alleli con acquisizione di funzione
- introduzione della mutazione patologica nel gene endogeno
- introduzione dell’allele esogeno mutato senza soppressione endogeno
o con soppressione endogeno
- inserimento di più copie del gene endogeno o di promotore forte
(aumento di funzione)
Malattie recessive: produzione di ko del gene endogeno
TRANSGENESI IN M. musculus
KNOCK IN
Introduzione di sequenza genica (può appartenere alla stessa specie o può derivare da
specie differenti) da esprimere nel topo.
- Aumento del numero di copie gene endogeno
studio della sovraespressione
- Inserimento di un intero gene esogeno o solo alcuni esoni
può
contemporaneamente determinare l’inattivazione del gene endogeno
KNOCK OUT
Introduzione di sequenza genica per l’abolizione della funzione genica endogena
- Inattivazione genica costitutiva
ESPRESSIONE INDUCIBILE DI UN TRANSGENE
Attivazione o inattivazione genica condizionale (nel tempo e nello spazio)
TRANSGENESI IN M. musculus
METODI DI TRASFERIMENTO GENICO
1) Trasferimento genico diretto:
-Trasfezione DNA libero con microiniezione
2) Trasferimento tramite vettori (adenovirus, virus adeno associati, retrovirus):
infezione virale
3) Metodi:
- Microiniezione nel pronucleo maschile in oocita fecondato
- Trasferimento nucleare di cellula con transgene in oocita fecondato privo di
nucleo e reimpianto in madre surrogata.
-Trasferimento genico in cellule Embrionali Staminali (ES) e reimpianto in blastocisti
4) Tipi di inserzione:
- ectopica
- mirata
Inserzione ectopica: effetto di posizione
Influenza di elementi di regolazione endogeni (enhancer, silenziatori)
Influenza struttura cromatina (eterocromatina, DNA ipermetilato)
Inserzione mirata
Inserimento nel genoma in una posizione occupata da sequenza omologa
Controllo di espressione del transgene
Uso di promotori costitutivi (es: promotore + enhancer di SV40) per geni sempre
attivi e molto espressi
Uso di promotori inducibili specifici per tipo cellulare o stadio di sviluppo
Uso di proteine di fusione rilevabili facilmente
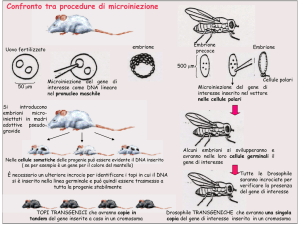
Trasferimento genico tramite microiniezione nel pronucleo
maschile
(accoppiata con maschio
vasectomizzato)
Inserzione mirata: produzione Knock-out/in per ricombinazione
Inserzione mirata: produzione Knock-out/in per ricombinazione
omologa
DNA esogeno
DNA genomico
Inserzione mirata: produzione Knock-out/in per ricombinazione
omologa
Trasferimento genico tramite microiniezione nel pronucleo
maschile
Si microiniettano molti oociti fecondati (circa 200
oociti da 7-8 femmine dopo induzione
superovulazione)
Da ogni oocita fecondato si sviluppa un topo
Individuazione topo transgenico
Trasferimento genico tramite trasferimento nucleare
fecondato
Riprogrammazione del
nucleo che ripercorrerà
l’intero sviluppo
Metodi per produzione di topi transgenici
- Microiniezione nel pronucleo: se l’inserimento riesce, tutto l’animale che
ne deriva è transgenico (comprese cellule germinali)
- Trasferimento nucleare: se l’inserimento riesce, tutto l’animale che
ne deriva è transgenico
- Trasfezione (o elettroporazione) di cellule Embrionali Staminali (ES) e
reimpianto in blastocisti, l’animale che ne deriva è chimerico (produrrà
transgenici solo se le sue cellule germinali sono transgenizzate)
Trasferimento genico in cellule embrionali staminali (ES) e
reimpianto in blastocisti
Le cellule staminali embrionali derivano dalla massa di cellule interne della blastocisti, 3,5
- 4,5 giorni dopo l’accoppiamento.
Possono essere mantenute in coltura con fattori che impediscono il differenziamento:
totipotenti
Cellule staminali pluripotenti isolate anche da feto e adulto (numero e capacità
differenziative limitati)
Formazione della blastocisti
Trasferimento genico in cellule embrionali staminali (ES) e
reimpianto in blastocisti
NO è una CHIMERA!!!
Zigote
Mutazione genetica in
una delle cellule
Zigote 1(blastocisti)
Zigote 2 (cellula ES transgenica)
due popolazioni cellulari
due popolazioni cellulari
Mosaico
Chimera
Trasferimento genico in cellule embrionali staminali (ES) e
reimpianto in blastocisti
Solo alcuni topi produrranno gameti con il transgene da cui deriveranno topi transgenici
Cellule embrionali staminali (ES) con transgene sono
reimpiantate in blastocisti
Mutagenesi di ES con inserzione mirata per produzione topo ko
Si controlla il corretto inserimento attraverso la metodica della selezione positiva-negativa
con G418 e ganciclovir
Vettore con:
gene tk (timidino-chinasi) (tk+ ) dell’Herpes virus (tk HSV),
gene della Neomicina resistenza = neoR
Gene endogeno inattivato per inserzione mirata del gene neoR
Tk = pathway di recupero dei nucleotidi: converte la timidina libera in monofosfato per la
sintesi DNA
Selezione positiva-negativa con G418 e ganciclovir
G418: analogo della neomicina
Ganciclovir (Gcv): analogo del nucleoside erpetico: uccide le cellule tk+,
ovvero con il vettore virale inserito
Tk HSV
Gcv
Gcv-P
Tk mammifero
Gcv-PPP
Incorporazione DNA
Terminazione catena
rottura DNA
Mutagenesi di ES con inserzione mirata per produzione topo ko
Cellule ES con mutazione
impiantate in blastociti di
madre surrogata
Produzione di topo ko (in omozigosi) successiva a mutazione mirata
Aguti
Fenotipo ko =
Coda arricciata
Topi transgenici
Topo nero: apparentemente
nessun contributo di cellule ES
Topo fondatore chimerico: forte
contributo delle cellule ES
Topo fondatore chimerico:
debole contributo delle
cellule ES
Mutagenesi di ES con inserzione mirata per produzione topo ko
Background genetico del topo: influenza sull’espressione del transgene (geni modificatori)
Utilizzo di ceppi (strain) diversi nelle varie fasi della produzione e mantenimento ko
Produzione cellule ES di solito dal ceppo 129 (mantello agouti o bianco)
Inserimento cellule ES in blastocisti C57BL/6 (mantello nero) (staminali C57BL/6
meno efficienti nell’attecchimento)
Maggiore è il contributo del genoma delle ES maggiormente sarà agouti il mantello
Problematiche del KO dal ceppo 129: difficoltà di accoppiamento, alterazioni
comportamentali, anatomiche, immunologiche)
Mantenimento ceppo 129 KO: reincroci con C57BL/6 (animale robusto, alta fertilità)
Creazione ceppo congenico: topo ko con contributo genetico minimo delle ES nel genoma
di C57BL/6 (al minimo regione contenente il transgene!)
Produzione di organismo Knock-in per ricombinazione
e sostituzione di un gene cromosomico con un transgene
Doppia ricombinazione omologa (X) che (esclude tk e inserisce Neo): grande delezione
dell’esone 1 endogeno ed ingresso del transgene che viene trascritto a partire dal P
del gene endogeno. Marcatore Neo con Promotore per la selezione delle cellule ES in
cui è avvenuta la sostituzione; gene tk per selezione negativa
Produzione di organismo Knock-in per ricombinazione
e sostituzione di un gene cromosomico con un transgene
Inserzione del gene LacZ
nel gene Evc murino.
LacZ sotto controllo trascrizionale degli
elementi regolativi del gene Evc
Colorazione dopo X-gal
SI STUDIANO DUE ASPETTI:
- CONSEGUENZE INATTIVAZIONE
- NORMALE PATTERN DI ESPRESSIONE
TISSUTALE
Sindrome Ellis van Creveld (AR):
acondroplasia associata con alterazioni
dello sviluppo della cute, dei capelli e
dei denti, polidattilia e con difetti del
setto cardiaco
Embrione Evc +/Forte espressione nelle regioni della bocca
Creazione omozigoti Evc-/-
Produzione di topo knock out Evc -/- ed analisi fenotipica
Arti corti e anomalie
scheletriche
osso
cartilagine
Anomalie nella dentizione
Espressione inducibile di un gene
• Si può regolare l’espressione di un gene spazio-temporalmente
• E’ necessario che il gene sia integrato e stabile nelle cellule
• Si può studiare l’espressione di geni tossici: si possono ottenere linee cellulari
trasfettate stabilmente col gene da studiare che viene:
- mantenuto “spento” durante l’espansione della coltura
- “acceso” al momento dell’esperimento
Sistemi regolati dalla tetraciclina (Tet) o da suoi analoghi come la doxyciclina (Dox).
Tet-On: l’aggiunta di Tet o Dox “accende” il gene
Tet-Off: l’aggiunta di Tet o Dox mantiene “spento” il gene
Espressione inducibile di un gene
Il sistema P e tetR (repressore della
tetraciclina di E. coli) inserito nel genoma
in modo indipendente
Transgene con operatore tet di E. coli
Introduzione nel mezzo di un analogo
della tetraciclina: Dox
Espressione inducibile di un gene
Ormone della crescita del ratto (GF) clonato a valle del promotore del gene della
metallotioneina murina regolata dai metalli pesanti
Risultato: ANIMALI GRANDI
Topi alimentati con zinco sono 2-3 volte più
grandi
Inattivazione genica condizionale
Ricombinazione sito-specifica guidata dal sistema Cre-LoxP
Ricombinasi Cre: enzima che fa parte della famiglia delle integrasi ricombinasi sitospecifiche.
La ricombinasi Cre è presente in natura nel batteriofago P1 ed ha un ruolo nel ciclo
lisogenico, in quanto serve per l’integrazione del genoma fagico in quello batterico
La ricombinasi è in grado di riconoscere specifiche sequenze di DNA chiamati siti LoxP
(locus del X-over P1)
Filamenti di DNA fiancheggiati da una coppia siti LoxP vengono definiti “floxed” o
“floxati”. I siti loxP sono costituiti da due distinte sequenze palindromiche di 13
nucleotidi ciascuna interrotte da una sequenza asimmetrica di 8 nucleotidi detta
“spacer” che conferisce direzionalità al sito.
Siti di riconoscimento loxP
Siti di riconoscimento FRT
(Flippasi che deriva dal 2
micron di S. cerevisiae
Inattivazione genica condizionale
Ricombinazione sito-specifica guidata dal sistema Cre-LoxP
Utilizzo di promotori
tessuto specifici
eterozigote per locus (A/a per knock-out)
in omozigosi
La ricombinasi Cre riconosce
appaiamento di siti loxP e
taglia
Sistema Cre-loxP per
knock-out genico
tempo- e tessutospecifico
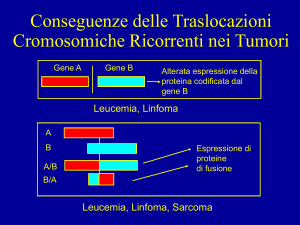
Topi come modello per i tumori
- Inserimento di un oncogene con promotore specifico
-Perdita dell’oncosoppressore per ricombinazione Cre-LoxP
- Studio di attivazioni improprie di un oncogene
Mutanti condizionali: espressione dell’oncogene in tessuti specifici.
Esempio BRCA1: 50% tumori mammari umani
Mancanza Brca1 causa morte embrionale topo ; sistema CreLoxP e rimozione
esone 11 solo in cellule epiteliali tessuto mammario
Mutanti condizionali per Brca1 e p53: accelerazione sviluppo tumore
MALATTIE DA MUTAZIONI DINAMICHE
ESPANSIONI DI RIPETIZIONI IN SEQUENZE GENICHE CODIFICANTI
(CAG)n = poliglutammine
APPROCCI PER OTTENERE UN MODELLO ANIMALE DI TOPO PER LA COREA DI
HUNTINGTON
1999: Ceppo R6/2: Iniezione pronucleo maschile di un transgene con
promotore HD umano + esone 1 espanso. Disturbi rapidamente progressivi
come forme giovanili. Inclusioni nucleari in striato e ippocampo
Promotore inducibile dalla doxiciclina: aggregati rimossi dal cervello spegnendo il
gene = sintomi reversibili
Inserzione casuale del cDNA del gene HD umano
APPROCCI PER OTTENERE UN MODELLO ANIMALE DI TOPO PER LA COREA DI
HUNTINGTON
Gene HD completo di promotore, esoni e introni. Microiniezione nel pronucleo di uno YAC
Inserimento nel gene Hd murino dell’esone 1 di HD umano
Modelli più usati: R6/2 e YAC 128 associati a fenotipi gravi
Utilizzo di YAC (Yeast Artificial Chromosome) per produrre topi
transgenici
Per trasferire geni di grandi dimensioni (300-1000 kb)
Metodi
1) Fusione di SFEROPLASTI (cellule Lievito dopo trattamento della parete) + cellule ES
(rischio di contaminazione con genoma Lievito)
2) Purificazione di YAC (separato per elettroforesi) + microiniezione nel pronucleo
(se YAC non ha dimensioni grandi, altrimenti si frammenta)
3) Trasferimento di YAC nelle ES tramite LIPOSOMI (vescicole lipidiche artificiali per
fusione con membrana)
Utilizzo di YAC (Yeast Artificial Chromosome) per produrre
topi transgenici
ESEMPI DI MODELLI MURINI DI PATOLOGIE UMANE
OTTENUTI CON METODI TRANSGENETICI
I topi sono sempre un buon modello?
Mutazioni spontanee in topi, patologie spesso diverse dalle umane
Topo NOD: topo diabetico non obeso (NOD) è un modello molto bene studiato
del diabete autoimmune diabetico ma senza obesità. Assomiglia al diabete
insulino-dipendente umano
Topo mdx: mutazione nonsenso nel gene mdx, distrofia molto più lieve
della DMD
Difficile ottenere modelli di alcuni tumori umani
Impossibile studiare effetti di alcune infezioni virali (es: virus del raffreddore,
HIV, polio): mancano di recettori specifici, naturalmente resistenti a certe
infezioni.
Necessità di “umanizzare” il topo perché esprima i recettori umani e possa
essere infettato da virus
I topi sono sempre un buon modello?
Differenze nell’assetto genetico (non esistono certi ortologhi; esistenza di geni
modificatori; ridondanza genetica)
Differenze nel background genetico (topi di laboratorio inbred, popolazione
umana outbred)
Differenze nelle vie biochimiche e metaboliche
Differenze nelle fisiologia delle cellule percorsi di sviluppo embrionale
Differenze nella struttura e funzioni del cervello
Differenze nella sensibilità ad alcuni patogeni
Durata della vita media (esordio tardivo nell’uomo)
Differenze nel nei telomeri e nella telomerasi (enzima più attivo: minore
erosione cromosomica e senescenza cellulare nel topo)