TRANSGENESI IN M. musculus
Creazione di animali geneticamente modificati per:
- conferma di gene candidato responsabile patologia umana
- studio della funzione e della regolazione genica
- modelli animali per lo studio delle malattie umane
- modelli animali sperimentali:
per la correzione del difetto genetico (“rescue” fenotipico),
per messa a punto terapia farmacologica
Un organismo si considera transgenico quando il gene esterno è:
• integrato nel suo genoma;
• espresso correttamente e selettivamente in uno o più tessuti
dell'animale;
• integrato nella linea germinale e quindi trasmissibile
dall’animale fondatore alla progenie.
TRANSGENESI IN M. musculus
KNOCK IN
Introduzione di sequenza genica (può appartenere alla stessa specie o può
derivare da specie differenti) da esprimere nel topo.
L’inserzione di un gene esogeno può contemporaneamente determinare
l’inattivazione del gene endogeno attraverso il suo inserimento.
KNOCK OUT
Introduzione di sequenza genica per l’abolizione della funzione genica
endogena
TRANSGENESI IN M. musculus
METODI DI TRASFERIMENTO GENICO
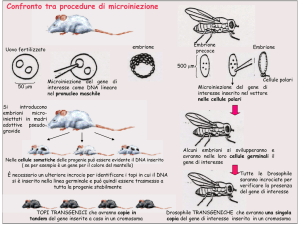
1) Trasferimento genico diretto:
-Trasfezione DNA libero con microiniezione
2) Trasferimento tramite vettori (adenovirus, virus adeno associati, retrovirus):
infezione virale
3) Metodi:
- Microiniezione nel pronucleo maschile in oocita fecondato
- Trasferimento nucleare di cellula con transgene in oocita fecondato privo di
nucleo e reimpianto in madre surrogata.
-Trasferimento genico in cellule Embrionali Staminali (ES) e reimpianto in
blastocisti
4) Tipi di inserzione:
- ectopica
- mirata
Inserzione ectopica: effetto di posizione
Influenza di elementi di regolazione endogeni (enhancer, silenziatori)
Influenza struttura cromatina (eterocromatina, DNA ipermetilato)
Inserzione mirata
Inserimento nel genoma in una posizione occupata da sequenza omologa
Controllo di espressione del transgene
Uso di promotori costitutivi (es: promotore + enhancer di SV40) per geni
sempre attivi e molto espressi
Uso di promotori inducibili specifici per tipo cellulare o stadio di sviluppo
Uso di proteine di fusione rilevabili facilmente
TRANSGENESI IN M. musculus
- Gene da esprimere fuso con cDNA proteina GFP
- Gene da esprimere fuso con peptidi target di anticorpi
fluorescenti.
Produzione di organismo Knock-in o Knock-out per
ricombinazione omologa
DNA esogeno
DNA genomico
Produzione di organismo Knock-out per ricombinazione
Produzione di organismo Knock-out/in per ricombinazione
Trasferimento genico tramite microiniezione nel pronucleo maschile
Oocita fecondato
Accoppiate con
maschi
vasectomizzati
Trasferimento genico tramite microiniezione nel pronucleo maschile
Si microiniettano
molti oociti
Trasferimento genico tramite trasferimento nucleare
fecondato
Riprogrammazione del
nucleo che ripercorrerà
l’intero sviluppo
Metodi per produzione di topi transgenici
- Microiniezione nel pronucleo: se l’inserimento riesce, tutto l’animale
che ne deriva è transgenico (comprese cellule germinali)
- Trasferimento nucleare: se l’inserimento riesce, tutto l’animale che
ne deriva è transgenico
- Trasfezione (o elettroporazione) di cellule Embrionali Staminali (ES) e
reimpianto in blastocisti, l’animale che ne deriva è chimerico (produrrà
transgenici solo se le sue cellule germinali sono transgenizzate)
Mutagenesi di cellule ES
NO è una CHIMERA!!!
Zigote
Mutazione genetica
Zigote 1(blastocisti)
Zigote 2 (cellule ES)
due popolazioni cellulari
Mosaico
due popolazioni cellulari
Chimera
Mutagenesi di ES con inserzione mirata per produzione topo KO
Si controlla il corretto inserimento attraverso la metodica della selezione positivanegativa con G418 e ganciclovir
Vettore con:
gene tk (timidino-chinasi) (tk+ ) dell’Herpes virus (tk HSV),
gene della Neomicina resistenza = neoR
Gene endogeno inattivato per inserzione mirata del gene neoR
Tk = pathway di recupero dei nucleotidi: converte la timidina libera in monofosfato
per la sintesi DNA
Selezione positiva-negativa con G418 e ganciclovir
G418: analogo della neomicina
Ganciclovir (Gcv): analogo del nucleoside erpetico: uccide le cellule tk+,
ovvero con il vettore virale inserito
Tk HSV
Gcv
Tk mammifero
Gcv-P
Gcv-PPP
Incorporazione DNA
Terminazione catena
rottura DNA
Selezione positiva-negativa con G418 e ganciclovir
Cellule ES con mutazione
impiantate in blastociti di
madre surrogata
Mutagenesi di ES con inserzione mirata per produzione topo ko
Cellule ES con mutazione
impiantate in blastociti di
madre surrogata
Produzione di topo ko (in omozigosi) successivo a mutazione mirata
Aguti
Fenotipo ko =
Coda arricciata
CREAZIONE TOPO KnockOut
1) Ricombinazione omologa nelle cellule staminali embrionali (topo marrone)
2) Selezione con G418 e gancyclovir
3) Iniezione delle cellule transgeniche in una blastocisti e impianto in una
madre pseudogravida (topo nero)
4) Progenie chimerica
5) Incrocio di eterozigoti per ottenere topo omozigote
ESEMPI DI MODELLI MURINI DI PATOLOGIE UMANE
OTTENUTI CON METODI TRANSGENETICI
Malattia
Gene
Metodo
Fibrosi cistica
CFTR
Inattivazione da inserzione mirata
Beta talassemia
Beta globina
Inattivazione da inserzione mirata
Malattia di Gaucher
GBA
Inattivazione da inserzione mirata
Sindrome dell’X
fragile
FMR1
Inattivazione da inserzione mirata
Sindrome da prioni
umana
PRNP
Integrazione del gene murino
mutante della proteina prionica
Atassia
spinocerebellare I
SCA1 (atassina)
Integrazione del gene umano
espanso
I topi sono sempre un buon modello?
Mutazioni spontanee in topi, patologie spesso diverse dalle umane
Topo NOD: diabetico ma senza obesità. Assomiglia al diabete insulinodipendente umano
Topo mdx: mutazione nonsenso nel gene mdx, distrofia molto più lieve
della DMD
Modelli per malattie con perdita di funzione: identificazione ortologo e
creazione topo knock-out. Produzione di: alleli nulli (assenza completa
di funzione), mutazioni leaky, (inattivazione geni con funzione simile)
Differenza nel fenotipo possibile per presenza di geni modificatori in
differenti ceppi murini
Modelli per malattie umane con acquisto di funzione: topo knock-in (es
inserimento di oncogeni, geni con triplette espanse)
I topi sono sempre un buon modello?
Differenze nelle vie biochimiche
Differenze nei percorsi di sviluppo
Durata della vita media (esordio tardivo nell’uomo)
Differenze nel contesto genetico