Area di progetto della Classe 2^A
ISTITUTO DI ISTRUZIONE SUPERIORE “Cristoforo Marzoli”
Con Sezioni Associate:
Istituto Tecnico Industriale Statale "Cristoforo Marzoli"
Liceo Scientifico di Stato "Galileo Galilei"
Via Levadello, 25036 Palazzolo S/O (BS)
C.F. 91011920179 Tel 0307400391; Fax 0307407000
e-mail: [email protected] http://www.iismarzoli.net
Area di progetto proposta dal consiglio di classe e dai docenti di chimica e laboratorio:
Prof. MANNARINO FRANCO e PESCATORE CARMELO (coordinatore dell’area di progetto).
Hanno partecipato inoltre i professori:
Palmieri Giuseppe – area fisica
Presti Giuseppina – area storica
Radici Maria Cristina – area giuridica
Barbaglio Alessandra – area grafica e tecnologica
Gli alunni hanno lavorato in gruppi:
Caracciolo Alberto e Armici Matteo – Copertina
Sardini L. , Uberti N. e Campana N. – Storia
Cruciani D. , Sarzilla D. , Verzelletti C. , Ghilardi J. , Pagani D. e Ferrari E. – Chimica
Lleshi A. , Torri A. , Belotti N. , Bosio S. , Gozzini A. e Massetti M. – Fisica
Rovaris M. e Chiari S. – Economia e Diritto
Turra G. , Manessi A. e Belotti F. – Sistema internazionale
Cruciani D. , Ghilardi J. e Turra G. – Presentazione PowerPoint e Convertitore
La storia
Le norme
Convertitore
Teoria degli
errori
Grandezze
fondamentali
Grandezze
Derivate
La storia delle unità di misura
•
•
•
•
•
•
•
•
•
•
•
•
La metrologia
La metrologia è la disciplina che regola tutte le norme relative al corretto uso dell’unità di misura e
definisce le modalità necessarie per una corretta misurazione.
Thomson metteva a fuoco l’importanza della metrologia.
Il valore delle grandezze fisiche ha un significato quantitativo molto preciso, queste grandezze,
adoperate in ambito professionale, sono estremamente diversificate.
Uno dei primi sistemi metrologici inventato fu quello egiziano esso si basava su un regolo lungo
circa 528 mm chiamato cubito. Il cubito era in effetti la distanza che poteva essere misurata tra
l’estremità del gomito e quella del pugno chiuso. Oltre al cubito esisteva un’altra misura di
lunghezza, il “talento” pari a 42,5 kg diviso a sua volta in 50 mine da 850 g.
In Inghilterra fu inventato lo “yard” che era la misura della distanza tra la punta del naso del re
Enrico I e il suo dito medio avendo cura di stendere il braccio ad angolo retto.
Talley Rand Perigord con un appassionato intervento all’assemblea Francese pose dei chiari
termini sul tema della metrologia, e gli disse : “Il sistema deve essere perfetto e deve basarsi su
un modello costante desunto dalla natura e sul quale tutte le nazioni devono trovare un accordo.
Inoltre il sistema internazionale doveva essere costituito da multipli e sottomultipli”.
Fu grazie a questa conferenza che nacque il metro.
In un laboratorio metrologico francese possiamo osservare un campione del metro sostituito da
una lega Platino-Iridio, il metro è anticamente legato a definizioni astronomiche, oggi è definito
come la misura della frequenza di oscillazione dell’atomo di Cesio 133.
Il metro, il secondo, il kilogrammo, l’ampere, la candela, il grado Kelvin e la mole sono le 7 unità di
misura principali considerate come riferimento nel sistema internazionale.
Si aggiungono poi le misure angolari di radiante e steradiante.
In Germania nel XVI secolo fu introdotto il “Rod” come unità di misura delle lunghezze. Questo
tipo di misura funzionava cosi: “ Di domenica mattina si facevano uscire dalla chiesa 16
galantuomini che venivano allineati uno dietro l’altro. La somma complessiva delle lunghezze dei
loro piedi costituiva la lunghezza di 1 Rod.
La storia delle unità di misura
Antiche misure di superficie ed equivalente in m²
Località
Vecchie
Ragguaglio
in m²
Località
misure
Alessandria
Casale Monf
Novi Ligure
Tortora
Ancona
Senigallia
Arezzo
Ascoli Piceno
Avellino
Bari e Barletta
Belluno
Benevento
Bergamo
Bologna
Imola
Brescia
Cagliari
Catanzaro
Chieti
Como
Cremona
Crema
Ferrara
Argenta
Cento
Firenze
Moggio g
Moggio p
Trabucco
Pertica
Pertica
Canna q.
Soma
Stajolo
Rubbio
Moggio
Versura
Campo
Tomolo
Pertica
Tornatura
Tornatura
Piò
Starello
Tomolata
Tomolo
Pertica
Pertica
Pertica
Biolca
Tornatura
Tornatura
Tornatura
Q. di 10 Tav
Stioro
Stajo
Vecchie
Ragguaglio
in m²
Località
misure
4751.96
3143.97
8.43
783.96
654.52
16.77
12479.32
1750.10
12313.49
4100
12345
3778.75
3085
662.30
2080.43
1933.01
3255.39
3986.75
3080.25
3244
703.63
808.04
762.73
6523.93
2348.64
2862.57
2263.31
3406.19
525.01
1703
Foggia
Forlì
Cesena
Rimini
Genova
Gorizia
Grosseto
Lecce
Brindisi
Taranto
Livorno
Lucca
Macerata
Mantova
Massa
Carrara
Milano
Lodi
Modena
Napoli
Novara
Padova
Palermo
Parma
Pavia
Mortasa
Perugina
Pesaro
Versura
Tornatura
Tornatura
Tornatura
Cannella q
Campo
Stajo
Moggio
Versura
Tombo Br
Tomolo
Pertica
Coltra
Modiolo
Biolca
Stajo
Quartiere
Pertica
Pertica
Biolca
Moggio
Pertica
Campo
Bisaccia
Tomolo
Biolca
Pertica
Giornata
Mina
Canna q
Vecchie
Ragguaglio
in m²
misure
12345
2383.45
2899.52
2947.92
8.86
3650
1300.90
31221.82
12345
8575
6813
8.52
4009.94
3119.3
3138.59
1198.60
1278.77
654.51
716.52
2836.47
3333
654.51
3862.57
4365.64
1091.41
3081.45
769.79
3810.39
4459.46
27.26
Faenza
Lugo
Reggio E.
Roma
Rovigo
Salerno
Sassari
Siena
Montepulc.
Sondrio
Teramo
Torino
Aosta
Trento
Trieste
Treviso
Udine
Venezia
Verona
Vicenza
Urbino
Piacenza
Pisa
Potenza
Ravenna
Tornatura
Tornatura
Biolca
Rubbio
Quarta
Campo
Moggio
Tomolo
Starello
Stajo
Stajo
Pertica
Tomolo
Giornata
Tavola
Seteur
Pertica Qt.
Iugero
Stajo
Iugero
Campo
Zuoia g.
Zuoia p.
Campo
Campo
Campo
Coppa
Pertica
Moggiola
Stioro
Versura
Tornatura
2301.8
1681.42
2922.25
18484.38
4621.09
4464.40
3789
4028
1993.3
1300.91
1703.10
688.07
4000
3810.39
38.10
2803.50
3.60
5754
845
5755
5204.69
5217.01
3505.33
3656.60
3047.94
3862.57
2824.39
762.01
13488.51
562.02
12345
3417.66
La storia delle unità di misura
•
•
•
Gli antichi romani adoperavano lo iugero, che era la superficie di terreno arata da una coppia di
buoi (jugum = uniti) in una giornata di lavoro.
Quindi il ragionamento è questo: prendiamo 5 litri di grano, lo seminiamo, la superficie coperta è
unu moi (circa 4.000 metri quadrati).
Per gli antichi romani era: aggioghiamo una coppia di buoi, li mettiamo ad arare per una giornata
intera, la superficie arata è uno iugero (corrisponde a 2.520 m2: Devoto-Oli, Vocabolario della
Lingua Italiana).
COMMENTO
Per la fisica e l'economia moderne questo modo di procedere è assolutamente inammissibile
perché contravviene alle due leggi che regolano le unità di misura:
1. l'unità di misura deve essere stabile nel tempo;
2. l'unità di misura deve essere facilmente riproducibile.
Nel mondo economico di oggi, quasi globalizzato, c'è anche una terza legge:
3. l'unità di misura deve essere condivisa per non incorrere in continue diatribe.
Facciamo alcune facili considerazioni: prendiamo il caso del pollice inglese; supponiamo che
fosse la larghezza del pollice di un certo re; supponiamo che il re sia ingrassato: cambiamo l'unità
di misura?; supponiamo che il re muoia e il suo erede voglia anche lui entrare nella storia della
fisica: cambiamo l'unità di misura perché il pollice del figlio è più stretto di quello del padre?
Il problema è così importante che in fisica dalla metà del 1700 ad oggi si sono susseguiti sei modi
di definire il metro, dalla prima (il metro è la quarantamilionesima parte del meridiano terrestre)
sino a quella ora valida (il metro è lo spazio percorso dalla luce nel vuoto in un
trecentomilionesimo di secondo (notare che una delle prime definizioni di metro servì per misurare
la velocità della luce, e ora la velocità della luce serve per misurare il metro! Misteri della fisica!!!!).
La storia delle unità di misura
•
Le unità di misura rappresentano un grosso problema che da sempre angustia tutti, o quasi, gli
studenti delle scuole medie superiori, quando ci si addentra nei meandri della fisica. Ciascun
fenomeno ha bisogno di essere misurato, e per fenomeni diversi occorrono unità diverse. Ancora
adesso nelle feste paesane del Campidano, sui banchetti dei venditori ambulanti, sopravvivono
accanto alla bilancia elettronica per pesare il torrone, le stadere per le angurie e i barattolini per
misurare in volume le noccioline e i ceci arrosto e i semi di zucca.
Subito dopo la seconda guerra mondiale, quando in Sardegna mancava tutto, in alcune
bottegucce che vendevano pane e chiodi e zucchero sfuso e zolfo per le viti e calce da intonaco e
doppio concentrato di pomodoro prelevato da un barattolo mezzo arrugginito con un cucchiaio di
legno, il tutto in una nuvola di odori e di mosche, allora, dicevo, in mancanza anche di pesi
ufficiali, si adoperavano pietre per equilibrare la merce comprata. Altro che igiene ed elettronica!
•
E' però anche vero che alcune unità di misura sono di difficile acquisizione, non solo per gli
studenti ma anche per altri.
Ancora adesso nelle scuole elementari si insegnano ai ragazzi i "pesi", che sono forze, anziché le
"masse", che sono quantità di materia. Le bilance infatti non misurano pesi, ma masse.
Negli Stati Uniti, in Cina, in India, ecc. le unità di misura non sono quelle normalizzate europee.
Solo in campo scientifico c'è una certa uniformità intorno al Sistema Internazionale (SI) basato su
metro, chilogrammo massa, secondo per quanto riguarda la meccanica. In altri campi si sono
diffuse e permangono nell'uso unità veramente strane, come il barile per il petrolio o l'oncia per
l'oro o il carato per i gioielli o il nodo per la velocità delle navi o il piede per la quota degli aerei,
ecc.
•
•
Le norme riguardanti
•
La metrologia legale studia le unità, i metodi e gli strumenti di misura e garantisce la correttezza
delle misure utilizzate per le transazioni commerciali.
Gli Uffici metrici delle Camere di Commercio si occupano, a livello provinciale, di garantire la fede
pubblica in ogni rapporto economico. In altri termini, la loro finalità è quella di rendere trasparenti
le operazioni di scambio e di promuovere l’autocontrollo del mercato. L’attività di tali Uffici
camerali si coordina con il Ministero delle Attività produttive, che identifica caratteristiche e
requisiti degli strumenti per pesare e per misurare seguendo le direttive comunitarie in materia.
Gli Uffici metrici effettuano controlli sia su richiesta dei fabbricanti metrici ed utenti metrici, sia
autonomamente con finalità ispettive.
Le norme riguardanti
•
I loro compiti sono, infatti, la verifica degli strumenti di misura, il controllo metrologico dei prodotti
preconfezionati e preimballati e l'assegnazione del marchio di identificazione per i metalli preziosi,
che contrassegna gli oggetti realizzati e posti in vendita Sono inoltre competenti per le violazioni
in materia di metrologia legale, gli ispettori metrici possono irrogare le sanzioni amministrative
previste dalla normativa vigente.
Per facilitare gli scambi tra paesi che non hanno la stessa legislazione, è nata l'Organizzazione
internazionale di metrologia legale (OIML) che ha sede a Parigi e alla quale aderiscono quasi tutti
gli Stati del mondo. Obiettivo è l’armonizzazione delle procedure di controllo metrologico.
In campo europeo.la posizione comune n. 51/2003 sugli strumenti di misura è stata definita
durante la riunione del Consiglio del 22 luglio 2003. Mentre con la Direttiva 4 aprile 2003, il
Ministero delle Attività produttive ha stabilito le procedure tecniche per la verificazione periodica
degli strumenti per pesare a funzionamento non automatico e dei complessi di misurazione di
carburante per autotrazione presso distributori stradali.
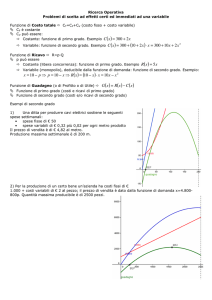
Grandezze derivate area chimica
Volume molare
Entropia
Massa molare
Entalpia
Concentrazione
di soluzione
Energia libera
Energia interna
Massa volumica
Quantità
di calore
Massa molare
Ogni elemento possiede la propria massa atomica assoluta mA esprimibile in
grammi o in chilogrammi. Tuttavia date le dimensioni infinitamente piccole
degli atomi, non esiste bilancia capace di misurarla. A questo scopo è stata
introdotta la grandezza mole, esprimibile in grammi, che contiene un
numero fisso di atomi, di molecole o di ioni chiamato costante di Avogadro
NA:
NA=6.023·1023
La mole è la grandezza fisica fondamentale che definicse un unità di quantità
di sostanza, espressa in grammi.
Per esempio:
Una mole di atomi di Na(Ar=22.99) corrisponde a 22.99 g di Na e
contiene 6.023·1023 atomi di Na
Una mole di atomi di H2O(Mr=18.016) corrisponde a 18.016 g di H2O e
contiene 6.023·1023 molecole di H2O
Viene di conseguenza che per calcolare la massa assoluta dell’atomo o della
molecola di qualunque sostanza è sufficiente dividerne per il NA:
ma=mole(g)/NA
Nel S.I. di misura, la grandezza mole, viene indicata con il simbolo M(mol) e la
sua unità di misura è kg/mol oppure g/mol
Volume molare
I valori sperimentali dei volumi di 1 mole dei
seguenti gas (O2, H2, N2 …) mostrano una
sorprendente regolarità: sono molto vicini a
22,4 litri, in condizioni standard di temperatura
e pressione (abbreviato STP), cioè a 0°C e 1
atm.
Il volume di 22,4 l è chiamato
Massa molare 32,00 g/mol
Volume molare 22,4 L/mol
Una mole di O2
Costante di Avogadro
Quindi una mole di ciascuna delle seguenti sostanze
gassose cioè:
32.00 g di O2
6,023·1023 molecole/mol
VOLUME MOLARE DI UN GAS(in condizioni STP)
2.02 g di H2
28.00 g di N2
Costante di Avogadro
6,023·1023 molecole/mol
44.00 g diCO2
occupa 22,4 l in condizioni STP e contiene lo stesso
numero di molecole(6,023·1023).
Una
mole di
O2
Volume molare
22,4 L/mol
Con le sostanze solide e liquide,invece, il valore del volume molare è caratteristico per ciascuna di
esse, cioè varia da sostanza a sostanza, per il fatto che le loro particelle sono molto ravvicinate.
Il volume molare, infatti, è dato dal rapporto tra la massa molare e la densità.
Massa molare
32,00 g/mol
Entalpia
•
•
•
•
•
•
•
•
E’ la funzione di stato che indica l’energia totale in ballo in una reazione chimica quando essa
avviene a pressione costante.
Essa è data da ∆H = ∆U + P∆V, dove:
∆H è la variazione entropica (J);
∆U è la variazione di energia interna (J);
P è la pressione (Pa);
∆V è la variazione di volume (m³).
N
Dalla funzione di stato possiamo ricavare le unità di misura:
H J Pa m 3 N m 2 m 3 N m J
m
Dalle quali possiamo ricavare le formule inverse:
U H PV
U N m
•
•
•
•
•
•
•
N
m3 N m J
2
m
P
H U J J N m
Pa
V
m3
m3
V
H U J J
m2
N m
m3
N
P
N
m2
Proprietà dell’entalpia: prendiamo in considerazione la reazione di combustione del carbonio
condotta in eccesso di ossigeno:
C(s) + ½O2(g) → CO2(g)
∆H=-393,5 KJ/mol
Se invece la reazione avviene in difetto di ossigeno si hanno due stadi successivi:
C(s) + ½O2(g) → CO(g)
∆H1=-110,5 KJ/mol
CO(g) + ½O2(g) → CO2(g) ∆H2=-283 KJ/mol
C(s) + O2(g) → CO2(g)
∆H=-393,5 KJ/mol
La variazione di entalpia di una reazione è la stessa, qualunque sia il percorso attraverso il quale
essa avvenga.
Entropia
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Il primo principio affermando che l’ energia si può solo trasformare ha dei notevoli limiti , infatti ammetterebbe che
un corpo meno caldo (a temperatura minore) potrebbe riscaldare un corpo più caldo (a temperatura
maggiore),mentre le osservazioni scientifiche e pratiche hanno dimostrato che ciò non è possibile.
Per superare queste difficoltà concettuali si è avuto il bisogno di introdurre il secondo principio della
termodinamica che afferma: “non tutto il calore si può trasformare in lavoro”.
Ma se il calore non si può trasformare in lavoro la parte non trasformabile che fine fa? Per rispondere a questa
domanda dobbiamo introdurre una nuova funzione di stato: l’entropia(S).
Concettualmente l’ entropia si può definire come l’ indice del disordine (o viceversa dell’ ordine) di un sistema
termodinamico, un esempio di due sistemi simili ma con contenuto entropico (disordine) diverso: la grafite e il
diamante.
Grafite e diamante sono composti dallo stesso tipo di atomo: il carbonio, ma sono cristalli che hanno proprietà
fisiche nettamente diverse, possiamo semplicemente affermare che la grafite (con carbonio ibridizzato sp2) è
meno ordinata del diamante (con carbonio ibridizzato sp3), ne segue che il diamante ha un contenuto entropico
minore.
ESEMPI DI DISORDINE:
scambio di calore fra corpi
espansione di un gas
vaporizzazione,fusione,sublimazione
formazione di una soluzione
reazione con formazione di prodotti gassosi
reazione di decomposizione e di rottura di legami chimici
La variazione di entropia tra due stati termodinamici che come funzione di stato è simboleggiata dal ΔS, ed è data
dalla relazione:
ΔS= Sprodotti-Sreagenti = Q / T,
dove Q è il calore e T la temperatura in gradi Kelvin.
Le unità di misura sono:
∆S=Q/T=J/°K
L’ entropia è l’ unica funzione di stato di cui si può conoscere il valore assoluto infatti il terzo principio della
termodinamica afferma che allo zero assoluto un cristallo puro ha entropia pari a zero.
Energia libera
•
•
•
•
•
•
•
•
•
•
•
•
•
La funzione di stato variazione di energia libera è la più importante funzione di stato per la chimica
poiché ci dice, come vedremo, se una reazione può avvenire o non può avvenire.
La variazione di energia libera è data dalla relazione di Gibbs:
ΔG= Gprodotti-Greagenti= ΔH – TΔS
dove ΔH è l’ entalpia o calore totale, e il TΔS è il contributo entropico, ma cosa risulta dalla
differenza tra calore totale e calore dissipato, ovvero non trasformabile in lavoro?
La risposta è molto semplice: il lavoro utile, ovvero l’ energia che si ottiene quindi trasformabile in
lavoro da una reazione chimica.
Il ΔG è una funzione di stato molto importante perché a seconda del suo valore una reazione
sarà possibile o impossibile:
ΔG< 0 la reazione è possibile e si verifica naturalmente;
ΔG> 0 la reazione è impossibile, si può realizzare la reazione inversa (che ha un ΔG negativo);
ΔG= 0 la reazione non procede perché ha raggiunto il suo equilibrio termodinamico.
Se si conosce l’energia libera standard di formazione delle sostanze presenti in una reazione il
calcolo di ∆G° di una reazione è data dalla seguente formula:
∆G°reazione= ∆G°prodotti - ∆G°reagenti
Nelle varie situazioni possiamo trovare i joule e le calorie di cui abbiamo la seguente equivalenza:
1cal= 4,186 joule
Massa volumica
•
La massa volumica o densità, è il rapporto tra la massa e il volume.
La formula per calcolare la densità è:
d = m/v
Sistema Internazionale
MKS
CGS
Kg
g
________
________
m²
Cm²
•
Densità assoluta:
E' una proprietà intensiva della materia, indipendente cioè dall'estensione del campione, ed esprime la
massa dell'unità di volume di un corpo omogeneo. In altre parole è data dal rapporto tra massa e
volume. La densità si indica, in Italia, con il simbolo d, anche se il SI raccomanda l'uso della
lettera greca r ( rho ); l'unità di misura SI è il kilogrammo su metro cubo ( kg/m3 );
comunemente si usa anche il grammo su centimetro cubo ( g/cm3 ).
L'espressione della densità è: d = m / v, da cui deriva V = m / d e
m=v·d.
•
Densità relativa:
Rappresenta il rapporto tra la massa di un campione e la massa di un eguale volume di acqua
distillata alla temperatura di 4 °C. E' una grandezza adimensionale, espressa, cioè, da un numero
puro che rappresenta il rapporto tra due grandezze definite dalla stessa unità di misura. Ad
esempio la densità dell'oro è = 19.3, ovvero l'oro ha densità 19.3 volte maggiore di quella
dell'acqua distillata a 4 °C
Quantità di calore
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Calore:
Per calore si intende l'energia termica che passa tra due corpi per effetto di una differenza di temperatura. Se si pongono a contatto un
corpo a temperatura più alta ed uno a temperatura più bassa, il secondo riceve calore ceduto dal primo. Questo passaggio è un
trasferimento di energia termica che si trovava nel corpo più caldo sotto forma di energia potenziale.
In altre parole, il calore si propaga sempre da zone o corpi più caldi a zone o corpi più freddi.
Unità di misura del calore nel SI è il joule ( J ); come già noto, si utilizzano spesso la caloria ( cal ) e la kilocaloria ( kcal ).
La temperatura è un indice dello stato termico di un corpo rispetto un altro corpo, ovvero ci informa se un corpo è più caldo o meno di un’
altro corpo, rispetto sempre una scala termometrica. La scala termometrica e' la graduazione del termometro per consentire la
misurazione della temperatura.
La graduazione di un termometro richiede di:
segnare sulla scala termometrica dei punti di riferimento, detti punti fissi, a temperature ben determinate e riproducibili.
fissare un'unita' di misura per la lettura delle temperature dei corpi.
Per convenzione si scelgono come punti fissi la temperatura a cui fonde il ghiaccio e la temperatura a cui bolle l'acqua alla pressione di
un'atmosfera.
Esistono diverse scale termometriche: la scala Celsius, la Reamur e la Fahrenheit.
La scala Celsius o centigrada prevede che la temperatura del ghiaccio che fonde, corrisponda al grado 0 di questa scala, mentre l'acqua
che bolle corrisponda al grado 100. La graduazione risulta divisa in 100 intervalli uguali. L'unita' di misura e' il grado centigrado (°C).
Anche la scala Reamur, prevede come punti fissi, la temperatura del ghiaccio che fonde, corrispondente al grado 0 e la temperatura
dell'acqua che bolle che corrisponde tuttavia al grado 80. La graduazione risulta, in questa scala, divisa in 80 intervalli uguali. L'unita' di
misura e' il grado Reamur °R.
Nella scala Fahrenheit, la temperatura del ghiaccio che fonde corrisponde al grado 32. La temperatura dell'acqua che bolle corrisponde
invece al grado 212. La graduazione risulta quindi suddivisa in 180 parti uguali. L'unita' di misura e' il grado Fahrenheit °F.
Riportiamo l'equivalenza tra le differenti scale termometriche:
C : 100 = R : 80 = (F-32) : 180
L'unità di misura della temperatura è nel SI il Kelvin ( K ) e la sua scala è detta scala assoluta; comunemente si usa il grado centigrado
( °C ) della scala centigrada. Entrambe le unità di misura si equivalgono ( 1K = 1°C ), ma lo zero della scala assoluta è posto a -273.15°C
e si chiama zero assoluto. Ne deriva che lo zero della scala centigrada è posto a 273.15 K. Le temperature assolute si indicano con T
mentre quelle centigrade con t.
Se con il trasferimento di calore si ha un passaggio di stato il calore trasferito è detto calore latente perché la temperatura, fino a che non
è ultimato il processo di cambiamento di stato, è costante.
A seconda del passaggio di stato si hanno:
Calore latente di fusione: quantità di calore necessaria a far passare 1g di sostanza dallo stato solido a quello liquido. Ad esempio il
calore latente di fusione dell'acqua è pari a 80 cal / g:
Calore latente di vaporizzazione o ebollizione: quantità di calore necessaria a far passare 1g di sostanza dallo stato liquido a quello di
vapore. Ad es. il calore latente di ebollizione dell'acqua è di 540 cal / g.
La quantità di calore richiesta da una data quantità di sostanza durante il passaggio di stato è data dalla relazione:
Q = calore latente × massa in g della sostanza.
Per calore specifico ( c ) di una sostanza si intende la quantità di calore necessaria a far aumentare di 1°C 1g di sostanza,
e si esprime nel SI, in J / g °C; si utilizza anche la cal / g °C.
Quantità di calore
•
•
•
•
•
•
Per capacità termica ( C ) di un corpo si intende la quantità di calore necessaria a far aumentare di 1°C la sua
temperatura; l'espressione è data dal prodotto del calore specifico per la massa del corpo (C = c × m) e si esprime
con le stesse unità di misura del calore specifico.
Nelle trasformazioni fisiche ove non abbiano luogo reazioni chimiche o passaggi di stato, un corpo assorbe e cede
calore secondo la relazione Q = m × c × Δt ( Δt = t finale - t iniziale ).
Ad esempio, la quantità di calore necessaria per riscaldare 500 g di ferro ( cmedio = 0.115 cal / g °C) da 50°C a 120
°C è:
Q = 500 g × 0.115 cal / g °C × 70 °C
Q = 4025 cal .
Il primo principio della termodinamica
Poiché scambi di forme diverse di energia tra l'ambiente e un sistema possono essere attivi contemporaneamente,
l’espressione completa del bilancio che esprime la conservazione di tutte le forme di energia in gioco si può
rappresentare con lo schema seguente:
Lo schema si traduce nella relazione
L+ER +Q=DU
che esprime il primo principio della termodinamica. Essa può essere considerata una definizione operativa
dell’energia interna di un sistema termodinamico e consente di misurarla.
Per l'interpretazione della relazione scritta è opportuno ricordare che:
- L indica il lavoro compiuto dall'esterno sul sistema (ed è negativo nei casi in cui le forze applicate dall'esterno sul
sistema "arretrano");
- ER indica l'energia raggiante che il sistema assorbe dall'esterno (ed e' negativa nei casi in cui è il sistema ad
emettere radiazioni);
- Q è il calore ceduto dall'esterno al sistema (ed è negativo se il sistema è a temperatura maggiore
dell'esterno).
•
•
•
•
•
•
•
•
•
•
•
•
Quantità di calore
Per facilitare la comprensione dei concetti di energia interna, calore e lavoro e della loro relazione ci sembra
opportuno ricordare l'analogia proposta da Herbert Callen nel suo libro Thermodinamics, che chiamiamo “la
metafora del lago”, .
Un uomo possiede un piccolo lago, che ha un immissario (corrente di acqua che entra) e un emissario (corrente di
acqua che esce). Il lago riceve anche acqua in modo saltuario dalla pioggia e ne perde per evaporazione (pioggia
negativa).
Il lago è il sistema
l’acqua nel lago è l’energia interna
l’acqua trasferita dalla corrente dell'immissario e dell'emissario è lavoro
l’acqua trasferita come pioggia o per evaporazione è calore
Si può notare come nessuna osservazione del lago, ad un dato istante, possa indicare quanta della sua acqua sia
entrata per mezzo della corrente e quanta per mezzo della pioggia. Il termine pioggia indica semplicemente un
modo per trasferire acqua.
Supponiamo che il proprietario del lago voglia misurare la quantità di acqua nel lago. Ha a disposizione dei
flussometri che gli consentono di misurare la quantità di acqua che entra ed esce tramite la corrente, ma non
possiede un pluviometro. Può però coprire il lago con un telo e renderlo quindi impermeabile alla pioggia o
all'evaporazione (pareti adiabatiche).
L’uomo dispone un palo verticale nel lago, inserisce i flussometri e copre il lago con il telo. Regolando la corrente
in entrata e quella in uscita, può variare a piacere il livello del lago e, utilizzando i flussometri, può tarare la scala
del palo in modo da poter misurare i livelli. Lavorando quindi sul sistema racchiuso in pareti adiabatiche egli può
misurare, per ogni stato del lago, il suo contenuto di acqua.
A questo punto l’uomo toglie il telo per permettere alla pioggia di entrare e si propone di misurare quanta acqua
entra nel lago in un dato giorno. Per questo procede nel modo seguente: misura la variazione del contenuto di
acqua del lago leggendo il livello sul bastone verticale e da questa toglie la quantità di acqua totale entrata tramite
la corrente. Questa differenza rappresenta la misura della quantità di pioggia.
Tradotto da Thermodinamics Herbert Callen, cap.1, pag. 19, J. Wiley & sons, New York, 1960.
La metafora del lago mette in evidenza, in particolare, come una volta che a un sistema è stata trasferita energia
come calore, o come lavoro, questa diventa energia interna del sistema e non rimane traccia del modo in cui è
stata trasferita.
La metafora non prevede esplicitamente un termine corrispondente al trasferimento di energia come radiazione
elettromagnetica; questo termine potrebbe essere costituito da un'altra corrente misurabile con un apposito
flussometro.
Concentrazione di soluzione
•
•
•
•
•
percentuale in peso: indicante la massa di soluto (in g) contenuta in 100 g di soluzione;
percentuale in volume: indicante il volume di soluto (liquido o gas), in cm3 contenuto in 100 cm3 di solvente;
percentuale in peso di soluto per volume di soluzione: indicante la massa di soluto (in g) contenuta in 100
cm3 di soluzione;
molarità (M): indicante il numero di moli di soluto disciolte in 1 dm3 di soluzione;
molalità (m): indicante il numero di moli di soluto disciolte in 1000 g di solvente puro;
frazione molare: esprime il rapporto tra numero di moli del componente e le moli totali della soluzione;
normalità: numero di grammi equivalenti (peso equivalente) per litro di soluzione;
KATAL: esprime la quantità di catalizzatore trasformato in 1 sec. da cui il katal = 1 mole/secondo. (1 kat = 1
mol/s);
ppm: parts per million (parti su milione) (*)
ppb: parts per billion (parti su miliardo)
pphm: parts per hundred millions (parti su 100 milioni)
ppt: parts per trillion (parti su trilione)
Il bilione secondo l'uso contemporaneo francese e statunitense è pari ad un miliardo, mentre nell'uso italiano
antico e contemporaneo tedesco ed inglese risulta pari a un milione di milioni (1000 miliardi).
Il trilione secondo l'uso contemporaneo italiano, francese e statunitense è pari a mille miliardi, mentre secondo
l'uso italiano antico e contemporaneo tedesco ed inglese, corrisponde a un miliardo di miliardi.
(*) è sempre usata con unità omogenee. Per i gas = cm3/m3, per le soluzioni = mg/Kg, oppure g/t, che per le
soluzioni acquose praticamente equivalgono, date le piccolissime con L'energia interna di un sistema centrazioni,
a mg/l oppure g/m3
Energia interna
Consideriamo l'esperienza dello schiacciamento di un blocchetto di cera da modellare (citata in Osservazioni dall'esperienza
quotidiana: Esperienze da riconoscere) come esempio del fatto che si può aumentare la temperatura di un sistema senza
ricorrere al contatto con un corpo a temperatura maggiore) tenendo conto ora dell'energia in gioco.
•
•
•
•
•
•
E' ovvio che durante lo schiacciamento si compie lavoro sul sistema: il pollice e l'indice infatti esercitano sulla cera due forze di
verso opposto e aventi la stessa intensità che compiono spostamenti della stessa lunghezza e di verso opposto nella direzione
delle forze.
Indicando rispettivamente con F e s il valore delle due forze e quello dei due spostamenti, il lavoro complessivo risulta:
L = 2Fs
Poichè il blocchetto è tenuto fermo e lo schiacciamento è lento, non c'è variazione di energia cinetica né rispetto al laboratorio
né rispetto al centro di massa del sistema. Come si salva allora il principio di conservazione dell'energia, cioè "dove va a finire" il
lavoro compiuto sul sistema?
Si deve ipotizzare che il lavoro compiuto dall'esterno produca l'aumento di una energia, confinata nello spazio occupato dalla
cera: chiameremo questa energia energia interna. Il ragionamento può essere visualizzato dallo schema:
Nel caso della cera l'aumento di energia interna è rivelato macroscopicamente dall'aumento di temperatura.
Energia interna
•
•
•
•
•
Altri processi, come quelli descritti in Esperienze da riconoscere, portano a un risultato analogo:
energia meccanica si trasforma in energia interna al sistema, con aumento della temperatura.
L'aumento della temperatura di un sistema può quindi essere considerato come indicatore
di un aumento di energia interna.
Se indichiamo con U l'energia interna posseduta dal sistema, e con L l’energia meccanica che
“entra” nel sistema, si può scrivere la variazione di energia interna come:
DU = L
A questo punto ci si può chiedere se un sistema può compiere lavoro utilizzando parte della
propria energia interna.
E' la situazione che si verifica per la bomboletta di smacchiatore quando viene attivato il getto. Il
gas contenuto nella bomboletta cede energia al liquido che viene espulso con aumento di energia
cinetica. Ciò avviene a scapito della energia interna del gas che resta all'interno della bomboletta (
DU negativo), che si raffredda.
L'idea di energia interna di un sistema può essere utilizzata per chiarire come calore e radiazione
elettromagnetica siano forme di energia.
Teoria degli errori
•
•
•
•
•
•
•
•
•
ERRORI SITEMATICI E ACCIDENTALI
Gli errori si possono verificare nel risultato di una misura.
Le cause di questi errori possono essere molte; in base all’influenzamento del risultato si
distinguono in errori sistematici ed accidentali.
Gli errori sistematici agiscono sempre per eccesso o per difetto, per esempio, il nostro orologio va
avanti, cioè le sue lancette si muovono più velocemente di quanto dovrebbero perciò il tempo
risulterà sempre maggiore di quello che è in realtà.
Talvolta si ricorre in errori grossolani: per esempio quando ci si dimentica di spostare la lancetta
dell’orologio in avanti e perciò tutte le indicazioni orarie del giorno dopo saranno sistematicamente
sbagliate per difetto di un’ora.
Questo ci fa capire che gli errori sistematici agiscono sul valore della misura.
Gli errori accidentali fanno cambiare il risultato in modo imprevedibile per eccesso o per difetto, le
loro cause sono le continue variazioni delle grandezze ambientali, e anche le condizioni degli
strumenti,poco stabili.
Gli errori accidentali si avvertono quando si effettuano misure con strumenti sensibili (calibro,
micrometro…); ci si accorge dell’errore perché il risultato cambia in modo casuale.
Anche una persona può influenzare il risultato, perché cambiando posizione lo sguardo cade a
destra o a sinistra della direzione perpendicolare alla scala dello strumento; perciò egli valuta le
misure per eccesso o per difetto, questo errore viene detto “parallasse”.
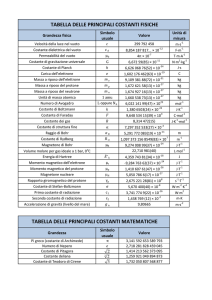
Grandezze fondamentali
•
•
•
•
•
•
•
•
Il sistema internazionale nasce nel 1960 e stabilisce le regole per tutte le misure in tutto il mondo
(escluso gli USA).
Il sistema internazionale si basa su sette grandezze fondamentali (tempo, lunghezza, massa,
temperatura, intensità di corrente, intensità luminosa e quantità di materia).
Per capire ciò bisogna conoscere cos’è una grandezza fondamentale e una derivata.
Tutte le grandezze che possono essere misurate direttamente sono chiamate fondamentali; al
contrario, le grandezze misurate indirettamente vengono chiamate derivate.
Una misura può essere diretta, in tal caso fornisce subito il risultato; oppure viene definita indiretta
quando si richiedono più misure e la loro elaborazione.
A seconda delle misure occorre utilizzare strumenti adeguati; per far questo è necessario definire
due proprietà essenziali degli strumenti:
La portata è la misura più grande che uno strumento può eseguire (massima estensione della
scala).
La sensibilità è la più piccola misura che uno strumento può eseguire (la più piccola divisione
della sua scala).
Grandezze fondamentali
Lunghezza
Massa
Tempo
Temperatura
Corrente
elettrica
Mole
Intensità
luminosa
Radiante
Steradiante
Lunghezza
•
•
•
•
•
•
•
•
•
•
•
•
•
•
DEFINIZIONE:
Il metro è la lunghezza del tragitto percorso nel vuoto dalla luce in un intervallo di tempo pari alla
frazione 1/299.792.458 di un secondo.
UNITA’ DI MISURA CON APPLICAZIONI:
L’unità fondamentale della lunghezza è il metro la cui definizione è stata perfezionata nel corso
degli anni.
Nel 1799 l’accademia delle scienze di Parigi scelse come riferimento campione per la lunghezza
Una sbarra di metallo a sezione rettangolare la cui distanza tra le facce rappresentava la
lunghezza del metro.Nel 1960 con l’affermazione del sistema internazionale venne scelta come
campione naturale 1.650.763,73 lunghezza d’onda della luce rosso-arancione emessa dagli atomi
di gas Kripton.
In fine nel 1983 è stata inventata la seguente definizione di metro:il metro è la lunghezza dal
tragitto percorso nel vuoto dalla luce in un intervallo di tempo uguale a 1/299792459 secondi.
Applicazioni
Equivalenze riferite alla lunghezza
2 km=2*1000m
1km=1000m
1m=1000mm
Strumenti di misura
Per le misure piccole i principali strumenti di misura sono il calibro e il micrometro,quest’ultimo
molto più preciso.Invece per le misure più grandi e che non necessitano di grande precisione si
usa il metro o il righello.
Massa
•
•
•
•
•
•
•
•
•
•
Definizione:
Il kg è la massa del prototipo internazionale, conservata a serves dal B.I.P.M.
Unità di misura con applicazioni: la massa di un corpo è la quantità di materia in essa contenuta.
L’attuale campione di massa è il cilindro di platino conservato a Parigi.
La sua massa, il kg è l’unità di misura del sistema internazionale.
La storia del campione di massa è molto particolare, visto che è rimasto praticamente invariato
per 2 secoli! Quando alla fine ‘700 venne presa come riferimento la massa di un decimetro cubo
di acqua distillata alla temperatura di 4°C.
Nel 1799 fu sostituito da un campione metallico fino alla presentazione nel 1899 del modello
preso ancora oggi in considerazione.
Strumenti di misura:
Il problema della misura della massa fu risolto con l’invenzione della bilancia che risale a circa
7000 anni fa.
La bilancia più comune, cioè quella con 2 bracci uguali si basa sul fatto di mettere da una parte
quello che si vuole pesare e dall’altra dei pesi di massa conosciuta finché non si raggiunge un
equilibrio.
Tempo
•
•
•
•
•
•
•
•
Definizione
Il secondo è l’intervallo di tempo che contiene 9192631770 periodi della radiazione emessa nella
transizione tra i due livelli iperfini dello stato fondamentale dell’atomo di cesio-133.
Unità di misura
Fino al 1955 l’unità di tempo in uso nella scienza, il secondo, era definito, con riferimento al moto
di rotazione della Terra, come 1/86400 del giorno solare medio.
L’evoluzione della scienza, tuttavia, richiese una definizione più precisa e rigorosa cosicché nel
1967 il secondo fu ridefinito come la durata di 9192631770 oscillazioni della radiazione emessa
dall’atomo di cesio-133 nella transizione fra due livelli iperfini del suo stato fondamentale.
Applicazioni
1 ora = 60 minuti
1 minuto = 60 secondi
1 ora = 3600 secondi
1 giorno = 24 ore
Strumenti di misura
Per la misura del tempo vi sono vari strumenti che si sono sviluppati nel corso degli anni.Partendo
dalla meridiana che si basava sugli spostamenti del sole siamo infine arrivati ai più moderni
cronometri che possono misurare fino ad un millesimo di secondo, anche lo strumento più usato
al mondo per la misurazione del tempo è l’orologio da polso.
Temperatura
•
•
•
•
•
•
•
•
Definizione
Il Kelvin è la frazione 1/273,16 della temperatura termodinamica del punto triplo dell’acqua.
Unità di misura
Per misurare la temperatura sono state usate nel corso degli anni varie scale di misura. Oggi
esistono tre scale che vengono usate in modo molto frequente.La scala centigrada che si basa sul
punto di ebollizione e di solidificazione dell’acqua.La scala Fahrenheit,usata soprattutto negli stati
uniti che si basa anch’essa sul punto di ebollizione e di solidificazione dell’acqua.Infine vi è la
scala Kelvin che viene soprattutto usata per definire lo zero assoluto.
Applicazioni
0 K = -273.15°C
100 °C = 373.15 K
Srumenti di misura
Notoriamente il più usato strumento di misura è il termometro a mercurio che negli ultimi anni è
stato perfezionato fino a poter misurare anche i millesimi di grado.
Corrente elettrica
•
•
Definizione
La corrente elettrica è un flusso ordinato di portatori da carica elettrica sotto l’effetto di un campo
elettrico.I portatori possono essere tutti dello stesso segno(come in un conduttore metallico),nel
qual caso partecipano al moto d’insieme movendosi in media tutti nello stesso verso,oppure di
segno opposto,come in una soluzione salina,nel qual caso contribuiscono alla corrente
movendosi in versi opposti.Infatti ai fini dell’intensità di corrente,uno spostamento di carica
positiva in un verso equivale ad uno spostamento di un uguale carica negativa in verso opposto
•
•
Unità di misura:
L’unità di misura dell’intensità di corrente elettrica è l’ampere.Un corpo conduttore è attraversato
dalla corrente di un ampere se per una sua qualunque sezione trasversale passa la quantità di
carica di un coulomb nell’intervallo di tempo di un secondo; in formule, A = C / s. Il nome dell’unità
di misura è ispirato allo scienziato francese Andrè Marie Ampère, che studiò la proprietà delle
correnti e i loro effetti magnetici.
Mole
•
•
Definizione
La mole è la quantità di sostanza di un sistema che contiene tante parti elementari quanti sono gli
atomi contenuti in 0.012 kg di carbonio 12.
•
•
Unità di misura
Una mole di qualunque sostanza contiene sempre lo stesso numero di particelle: tale numero è
detto numero di Avogadro e il suo valore, determinato attraverso metodi diversi, è fissato a
6.023*10²³ .Quindi , sapendo che un atomo di carbonio a massa pari a circa 12 atomi di idrogeno,
12 g di carbonio e uno di idrogeno allo stato atomico conterranno lo stesso numero di particelle.
Intensità luminosa
•
•
•
•
L'intensità luminosa è l'energia che attraversa nell'unità di tempo la superficie unitaria posta
perpendicolarmente alla direzione di propagazione della luce. La luce emessa da una sorgente
puntiforme si propaga radialmente in tutte le direzioni. Le superfici perpendicolari alla direzione di
propagazione sono le superfici sferiche aventi centro nella sorgente. Se la sorgente emette
uniformemente in tutte le direzioni, detta P l'energia emessa nell'unità di tempo dalla sorgente,
l'intensità luminosa I, ad una distanza r dalla sorgente, è data da:
I = P/ 4pr2
Unità di misura:candela(cd)
Radiante
•
•
•
•
•
Unità di misura convenzionalmente adottata per gli angoli. Data una qualsiasi circonferenza, il
radiante è definito come l’ampiezza dell’angolo che sottenda un arco di lunghezza pari al raggio.
Di conseguenza la lunghezza in radianti di un angolo è espressa in funzione del rapporto tra l’arco
sotteso dall’angolo e il raggio della circonferenza.
E’ semplice ricavare una relazione che permetta di trasformare la misura di un angolo in radianti
nella corrispondente misura in gradi. La formula che esprime la lunghezza di una circonferenza è
2πr dove r è il raggio della circonferenza e π è il numero 3.14; ciò significa che una
circonferenza contiene esattamente 2π raggi, e poiché un arco di lunghezza r sottende l’angolo di
un radiante,ne segue che
2 π radianti = 360°
Steradiante
•
Unità di misura degli angoli solidi nel sistema internazionale, analoga al radiante per gli angoli
piani. Per definizione, lo steradiante è l’angolo solido, con il vertice nel centro della sfera, che
sottende una calotta sferica di area equivalente a quella di un quadrato di lato pari al raggio della
sfera. Poiché l’area di una sfera di raggio r è 4πr*r, e quindi l’area della sfera di raggio unitario è 4
π, l’angolo solido totale è 4 π steradianti.