Vitamine: generalità
Vitamine liposolubili A, D, E, K
Meccanismo della visione
Calcio
Coagulazione del sangue
VITAMINE
Micronutrienti organici, richiesti in quantità pari a
milligrammi o microgrammi
Per la maggior parte dovono essere introdotte con la dieta
(non sintetizzate o sintetizzate in parte dall’organismo)
Non vengono usate per produrre energia né per usi
strutturali
•
•
•
•
fanno parte di coenzimi,
sono precursori di ormoni,
agiscono da antiossidanti,
partecipano come substrati a reazioni specifiche
Le VITAMINE sono classificate in LIPOSOLUBILI ed IDROSOLUBILI
sulla base della loro insolubilità o solubilità in acqua
La denominazione con le lettere dell’alfabeto ha origini storiche
1910-20 - isolate sostanze che in piccola quantità erano necessarie
per prevenire malattie e denominate
sostanza liposolubile - fattore A
sostanza idrosolubile - fattore B
fattore A suddiviso in
A - fattore della crescita - visione notturna
D - antirachitica
fattore B suddiviso in
B - fattore anti beri beri
C - fattore antiscorbuto
fattore B ulteriormente suddiviso in
B1 - fattore anti beri beri
B2 - altre vitamine del complesso B
13 vitamine sono essenziali per l’uomo
LIPOSOLUBILI
Vitamina A - retinolo
Vitamina D - colecalciferolo (malattia da carenza: rachitismo)
Vitamina E - tocoferolo
Vitamina K - fillochinone
IDROSOLUBILI
Vitamina C - acido ascorbico (malattia da carenza: scorbuto)
Vitamina B1 - tiamina (malattia da carenza: beri-beri)
Vitamina B2 - riboflavina
Vitamina B3 - niacina (acido nicotinico ed ammide) (carenza: pellagra)
Vitamina B5 - acido pantotenico
Vitamina B6 - piridossina, piridossale, piridossammina
Vitamina B7 - biotina
Folati
Vitamina B12 - cobalammina (malattia da carenza: anemia perniciosa)
Vitamine del complesso B: sintetizzate dai vegetali tranne la B12 sintetizzata
solo da batteri
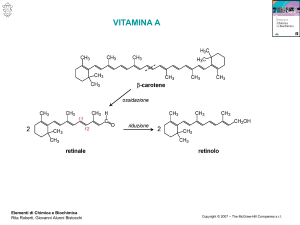
Vitamina A
VITAMINA A o retinolo (costituito da 4 unità
isopreniche)
Si trova negli alimenti di origine animale (fegato, olio di pesce, pesce,
latte non scremato, burro, tuorlo)
CAROTENOIDI (costituiti da 8 unità isopreniche)
I carotenoidi sono presenti nelle piante; alcuni hanno attività
vitaminica e sono denominati provitamina A
Si trovano negli alimenti di origine vegetale (frutta, verdura, olio d’oliva)
CH3
C
C
CH3 CH3
CH3
CH3
principale
provitamina:
beta carotene
Struttura chimica: dimero della vitamina A
ma da un punto di vista metabolico la bioconversione si assume di 1:12
CH2OH
Le linee rosse evidenziano le 4 unità isopreniche
anello -iononico essenziale per l’attività; è
presente nei carotenoidi con attività provitaminica
tutto-trans retinolo
(forma alcolica)
Vitamina
Il gruppo alcolico è esterificato da acidi
grassi (in genere acido palmitico) nella
forma di riserva della vitamina
retinolo deidrogenasi + NAD (reazione reversibile di ossidazione ad aldeide)
CHO
retinale
(forma aldeidica)
Ruolo nella visione
retinale deidrogenasi + NAD (reazione irreversibile di ossidazione ad acido)
COOH
acido retinoico
Ligando di fattori
di trascrizione
FUNZIONI
I. PERCEZIONE VISIVA
Fotoisomerizzazione
11cis retinale -> tutto trans retinale
molto veloce: 10-12 s
assorbe luce
di 500 nm
RODOPSINA (pigmento dei bastoncelli deputati alla visione notturna )
opsina (apoproteina) + fotorecettore
legato tramite base di Schiff con lisina (Lys 296)
praticamente non vi è isomerizzazione spontanea e quindi il rumore di fondo
è molto basso; ciò permette di percepire anche pochi fotoni
Sintesi delle rodopsina a partire dalla vitamina A
Ciclo retinoide: via enzimatica che rigenera 11cis retinale
Rodopsina
luce
trasportatore
opsina
11 cis retinale
trans retinale
Deidrogenasi NAD+
11 cis retinolo
trasportatore
La rigenerazione avviene al
buio, nelle cellule epiteliali
adiacenti ai fotorecettori
Per esportare il retinale dal
bastoncello alle cellule
epiteliali
MUTAZIONE:
degenerazione maculare
di Stargardt
Reduttasi NADPH
trans retinolo
Isomerasi
Lecitina retinol acil transferasi
trans retinolo estere
MUTAZIONE : retinite pigmentosa
II. FUNZIONE TRASCRIZIONALE
Lega fattori di trascrizione: Recettori dell’ Acido Retinoico (RXR)
RXR forma eterodimeri con i recettori per
- ormoni steroidei
- Vit D
- ormoni tiroidei
.
Anche questi recettori sono fattori trascrizionali attivati dal
legame con l’ormone e dalla dimerizzazione con RXR, con
conseguente inibizione o attivazione di specifici geni
Questo spiega i numerosi fenomeni biologici in cui è coinvolta
la vitamina A
Base molecolare per il ruolo fisiologico nel
differenziamento,
proliferazione,
sviluppo embrionale.
vitamina D
VITAMINA D
FONTI
- sintesi endogena: esposizione alla luce solare
- dieta (necessita di lipidi e sali biliari per l’assorbimento)
PRECURSORE dell’ormone steroideo 1,25-diidrossi colecalciferolo
FUNZIONI dell’ormone: agisce a livello trascrizionale
• omeostasi del calcio, in particolare assorbimento
a livello intestinale: geni codificanti per il trasportatore del calcio e
per la “proteina legante il calcio“
• mineralizzazione ossea
• secrezione dell’insulina
• crescita, differenziamento
• sistema immunitario
PELLE
I.
HO
7-deidrocolesterolo
LUCE SOLARE
fotolisi da raggi UV
280-315 nm
7
2HC
6
temp corporea 37° C
cambio
conformazionale
4
1
3
HO
2
HO
Pre-vitamina D3
CH2
5
vitamina D3
colecalciferolo
biosintesi dell’ormone 1,25-diidrossi colecalciferolo 1,25 (OH)2 D3
Vit D3
II. FEGATO
25 idrossilasi (mitocondriale o microsomiale)
non regolata
25 OH D3
III. RENE
24,25 (OH)2 D3
se è presente ipercalcemia
forma non attiva
Enzima: 1 idrossilasi (mitocondriale)
punto di controllo
della biosintesi
1,25 (OH)2 D3
paratormone
se è presente ipocalcemia
Alcune funzioni del CALCIO
Struttura (osso e denti)
Coagulazione del sangue (vedi vitamina K)
Contrazione muscolare
Attivazione di enzimi -amilasi pancreatica, protein chinasi C,
fosfofruttochinasi
Rilascio di ormoni e neurotrasmettitori
Le funzioni regolatorie prevalgono sulle funzioni scheletriche
perturbazioni nell’omeostasi sono tamponate da tessuto osseo
Adulto: Calcio corporeo (1000 - 1200 g )
Livello plasmatico = 10 (9-11) mg/dL (2,4 mM)
50% ione non complessato - fisiologicamente attivo
40% legato a proteine (albumina)
10% sale fosfato, citrato, bicarbonato
Scarsa tolleranza alle deviazioni di [Ca++]:
Ipocalcemia: ipereccitabilità, convulsioni tetaniche
Ipercalcemia: paralisi muscolare, coma
Ormoni di controllo di [Ca++]:
Ormone paratiroideo (PTH)
Vitamina D
REGOLAZIONE DEL METABOLISMO DEL CALCIO
azione concertata a livello intestinale, renale, osseo.
Azione sinergica ipercalcemizzante di
- Vitamina D
- Ormone paratiroideo (PTH)
Vita D ++
Fluido
extracellulare
PTH++
PTH ++
IN CIRCOLO
1,25 (OH)2 D
1,25 (OH)2 D
Legata a
Vit D binding protein
VDRi +
Acido retinoico
eterodimero VDR- RXR
NUCLEO
VDRa
VDRa RXR
Il legame della vit D induce
cambio conformazionale ed
attivazione del “recettore per la
vit D” che quindi trasloca nel
nucleo dove si lega a specifiche
sequenze del promotore
CITOPLASMA
____VDRE_____ gene bersaglio
mRNA
Proteine leganti calcio
VDR - Recettore Vit D
VDRE - Vitamin D Response Elements
RXR - Recettore Acido Retinoico (derivato vitamina A)
ASSORBIMENTO DEL CALCIO
A livello del duodeno, digiuno, ileo, colon (4%)
Assorbito il 20-30% del calcio assunto - nei bambini fino al
70%
trasporto dal lume intestinale all’eneterocita
ATTIVO transcellulare, saturabile (sotto il controllo di
1,25(OH)2D)
.
transito nell’enterocita (è la tappa limitante).
tramite Calcium Binding Protein (CBP) (sotto il controllo
di 1,25(OH)2D)
• estrusione dalla cellula intestinale
tramite Ca ATPasi e scambio Ca/Na
CARENZA di Vit D
RACHITISMO: bambino
Deficiente mineralizzazione con deformità delle ossa
sconosciuto nei paesi tropicali, scandinavi, esquimesi
nell’ 800 trattato con olio di fegato di pesce e esposizione al sole,
nel 1930 identificata la vitamina
OSTEOMALACIA: adulto
osteopenia con aumentato rischio di frattura ed un diffuso dolore
osseo
anche per mancata sintesi dell’ormone o mancata risposta
ormonale
-
Vitamina E
VITAMINA E
-tocoferolo
STRUTTURA CHIMICA
anello funzionale fenolico
con una catena laterale isoprenica
scoperta nel 1922 nei vegetali verdi (è sintetizzata solo
dalle piante fotosintetiche) e denominata vit E
quindi messa in relazione con la fertilità e chiamata
tocoferolo: tokos (nascita) phero (porto) olo (alcol)
FONTI: soprattutto in alimenti di origine vegetale, olio di oliva, noci,
mandorle, vegetali verdi
LOCALIZZAZIONE: zone ricche in lipidi quali membrane cellulari,
lipoproteine, depositi di grasso
FUNZIONE
protezione da auto-ossidazione degli acidi grassi polinsaturi.
previene ossidazione lipoproteine (LDL)
MECCANISMO: antiossidante che interrompe la catena di radicali che
reagiscono più velocemente con la vi tE che con acidi grassi
ROO• + Vit E-OH Vit E-O• + ROOH
Vi E-O• reagisce con vitamina C o altro donatore di di idrogeno e ridiventa
Vit E-OH
Vitamina K
VITAMINA K: naftochinone con una catena laterale poli-isoprenica
fillochinone, sintetizzata dalle piante
menachinone, sintetizzato dai batteri della
flora intestinale
6-11
menadione
forma sintetica farmacologica, non attiva come
tale, ma viene isoprenilata dall’organismo
Dicumarolo: antivitamina presente in
alcune piante; inibitore della reduttasi
che rigenera la forma atttiva della
vitamina (vedi diapositiva successiva)
Dicumarolo
FUNZIONE BIOCHIMICA
cofattore di carbossilasi per la sintesi
dell'acido -carbossiglutammico (Gla)
a partire dall’acido glutammico di proteine
proteina-HN-CH- CO-proteina
I
CH2
I
CH-COO–
I
COO–
Gla
Modificazione post-sintetica di
proteine
La forma funzionale è l’idrochinone che nell’attività catalitica è ossidato a chinone, e
quindi rigenerato da reduttasi NADPH dipendente. Inibitori della reduttasi sono
anticoagulanti.
Farmaci con azione antivitaminica
• anticoagulanti: warfarina
• antibiotici: cefalosporina inibitore della vit k-epossido reduttasi
L’amminoacido Gla, avendo due cariche negative, lega bene il
calcio ionizzato (Ca2+) con 2 cariche positive
La vitamina K interviene come fattore antiemorragico nella coagulazione
del sangue.
La coagulazione implica una attivazione a cascata di enzimi proteolitici
già presenti nel plasma come precursori inattivi: la specifica proteolisi
rende attivo il fattore (reazione finale: fibrinogeno fibrina)
In tale processo le proteine che hanno Gla legano il Ca2+ che si lega
anche ai fosfolipidi negativi della superficie delle piastrine attivate; tale
legame è indispensabile per subire l’attivazione
I fattori della coagulazione vit K-dipendenti sono:
Protrombina
Fattore VII
Fattore IX
Fattore X
In assenza di Ca2+ non si legano alle piastrine attive e non vengono
trasformati nella forma attiva dall’enzima proteolitico di cui sono substrato
Ca2+ fattore IV
FL: fosfolipidi delle piastrine attivate
VIA INTRINSECA
Fattore XII XIIa
In rosso: enzimi proteolitici
In verde: fattori attivanti
Fattore XI (Ca2+, FL) XIa
VIA ESTRINSECA
Fattore IX (Ca2+, FL) IXa
VIIa (Ca2+, FL) Fattore VII
Fattore VIII VIIIa
Fattore X (Ca2+, FL) Xa
Fattore V Va
Protrombina (Ca2+, FL) trombina
monomero di fibrina fibrinogeno
XIIIa Fattore XIII
polimero di fibrina (insolubile)
Gla
protrombina
La TROMBINA è una proteasi specifica che
idrolizza il legame Arg-Gly
1
La trombina ha un ruolo centrale agendo su
diversi fattori ed amplificando il processo
Il fattore Xa scinde
i due legami
274 Arg-Thr
A
323 Arg -Ile
Fibrinogeno
XIII
VIII
V
VII
fibrina
XIIIa (fattore regolatorio)
VIIIa(fattore regolatorio)
Va(fattore regolatorio)
VIIa (proteasi)
S
B
S
e forma la trombina,
costituita dalle due subunità A
e B legate da ponte disolfuro
582
La scissione avviene in presenza di legame della
protrombina a Ca2+ e fosfolipidi di membrana di piastrine
attivate, tramite i residui di GLA, presenti nella parte Nterminale che viene persa nella trombina
Il fibrinogeno (AB)2 ha carica negativa che impedisce interazione con altre
molecole di fibrinogeno.
La trombina elimina i fibrinopeptidi altamente negativi, creando un centro positivo
che permette l’interazione tra i monomeri di fibrina ()2
-
-
-
-
+
-
-
+
fibrinogeno
+
-
+
+
-
fibrina
Il legame ionico viene quindi stabilizzato dalla
formazione di legami covalenti fra le catene laterali per
azione del fattore XIIIa
ANTITROMBINA
Proteina plasmatica: inibisce la trombina legandosi con
un complesso 1:1
EPARINA:
si lega alla antitrombina e ne aumenta l’attività di
centinaia di volte