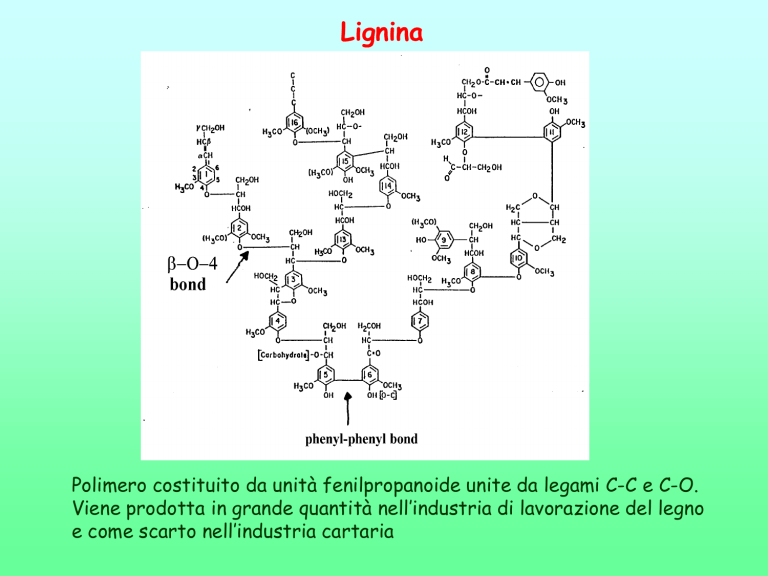
Lignina
Polimero costituito da unità fenilpropanoide unite da legami C-C e C-O.
Viene prodotta in grande quantità nell’industria di lavorazione del legno
e come scarto nell’industria cartaria
Biodegradazione della lignina
In natura esistono organismi che sono capaci di degradare la lignina.
sono funghi del genere Phanerochaete chrysosporium
Il fungo produce durante il metabolismo secondario 2 enzimi capaci
di degradare la lignina: lignina perossidasi (LiP) e manganese perossidasi
(MnP)
Produce un sistema che genera H2O2 (enzimi come gliossal ossidasi)
Produce molecole organiche come alcol veratrilico e ossalato, coinvolti
nella degradazione della lignina
Perossidasi
• Sono divise in tre
grandi famiglie
– Da pianta
• Piante
• Funghi
• Batteri
– Animali
– Altra origine
• Le perossidasi da
pianta sono suddivise
in base all’origine, i.e.
se estratte da:
– Procarioti – Classe I
– Funghi – Classe II
– Piante – Classe III
Perossidasi da pianta
• Classe I
– CcP
– APX
• Classe II
– LiP
– MnP
– CiP
• Classe III
– PNP
– HRP
2 domini
LiP e MnP
Sia LiP che MnP sono emeproteine.
Il meccanmismo di entrambe è simile: formano 2 intermedi ossidati, il composto I
e il composto II
Lip ossida, in presenza di H2O2 una grande varietà di substrati aromatici (fenolici
o non fenolici) formando un catione radicale.
Questo catione radicale è capace di generare reazioni non enzimatiche di rottura
del legame C-C e C-O.
MnP e’ una proteina Mn-dipendente. La sua espressione è regolata dalla presenza
di Mn nel mezzo di coltura.
Ossida il Mn2+ a Mn3+ in presenza di H2O2 e acidi organici chelanti.
Mn è un forte ossidante, Ossida una grande varietà di composti fenolici e può
agire come ossidante diffisubile sulla lignina
Mechanisms of LiP and MnP. LiP and MnP exhibit similar mechanisms to other peroxidases.
The initial reaction in both systems involves a two electron cleavage of the peroxide dioxygen bond
to produce water and a two-electron oxidized form of the enzyme (compound I).
Compound I oxidizes a substrate by one electron to produce a free radical product and the
one-electron reduced form of the enzyme (compound II). Transfer of a second electron from
substrate to compound II is the final step of the catalytic cycle, reducing the enzyme back to
its native state. Substrate A can be a phenolic or nonphenolic compound, but nonphenolics are the
preferred substrates (Paszczynski et al., 1986). For MnP, B can be Mn2+, which is then oxidized to
Mn3+ (as in reaction step 3) or a phenolic substrate. Step 3 requires Mn2+ (Wariishi et al., 1988),
and the Mn2+ must be chelated to an organic acid chelator (Kuan et al., 1993).
Sito catalitico della Mn perossidasi
Il ciclo catalitico delle
perossidasi
Composto II
Composto I
Ruolo del veratril alcol
Tre ipotesi sono state fatte sul ruolo dell’alcol 3,4-dimetossi benzilico
(Veratril alcol) nella degradazione della lignina da parte della LiP
1) Mediatore redox: LiP catalizza l’ossidazione monoelettronica del VA formando
Un catione radicale che diffonde dal sito attivo e ossida alcol anisilico o
metossimandelico ai rispettivi cationi radicali. Questo modello suggerisce un
meccanismo per cui la LiP potrebbe ossidare il substrato ingombrante a distanza
dal sito attivo.
2) Protegge dall’inattivazione dovuta a H2O2. In eccesso di H2O2 e in assenza di
substrato LiP viene inattivata per formazione di complesso con il diossigeno
(composto III). Cationi radicali del veratril alcol possono riconvertire il composto
III alla specie nativa dell’enzima.
3) Agisce per completare il ciclo catalitico, in presenza di substrati che non
possono riconvertire il composto II all’enzima nativo. Substrati con potenziale
redox piu’ basso del composto I, ma piu’ alto del composto II non sono in grado
di completare la reazione. VA serve come substrato del composto II completando
il ciclo.
Structure of aromatic alcohol substrates and their corresponding aldehydes.
Ruolo del veratril alcol
Ruolo dell’ossalato
L’ossalato viene prodotto contemporaneamente alla MnP.
MnP necessita Mn2+. La reazione dell’enzima con Mn2+ a Mn3+ è stato visto
essere dipendente dalla presenza di acidi organici come ossalato.
Ipotesi sul ruolo dell’ossalato.
1) Sulla base di una bassa reattività del Mn 2+ libero con il composto II è
stato ipotizzato che formi complessi chelati sia con il Mn 2+ che con il Mn3+
2) Chela solo il Mn 3+ e lo stabilizza. I complessi stabili di Mn 3+ possono agire
come ossidanti diffusibili di substrati lontani dal centro attivo.
Ruolo dell’ossalato
Dati recenti hanno indicato che la MnP lega sia Mn2+ che Mn3+.
L’ossalato non rimuove Mn2+ dalla MnP, ma lega Mn3+ formando un complesso
Che diffonde.
Questa ipotesi contrasta con i dati cinetici che indicano bassa velocità di
riduzione del composto II, da parte del Mn2+ in assenza di ossalato.
Tutti i risultati possono essere riconciliati sulla base del seguente meccanismo
L’ossalato non lega Mn2+ . L’ossidazione del Mn2+ da parte del composto II per
rendere l’enzima nativo e Mn3+ viene favorita dalla complessazione del Mn3+
con ossalato, guidando la reazione verso la formazione dei prodotti.
Il sito di legame del Mn(II)
LiP – proprietà strutturali
Sono glicoproteine globulari, costituite prevalentemente da eliche.
MW 40000 –
343-344 AA
Oltre al Mn, legano 2 ioni Ca.
Presentano diversi siti di glicosilazione.
L’eme divide la proteina in 2 domini (distale, sotto il piano dell’eme e prossimale,
sopra il piano dell’eme.
L’eme, sprofondato all’interno della proteina, presenta un canale di accesso molto
stretto che non consente l’ingresso di substrati ingombranti come la lignina,
mentre può accogliere molecole piu’ piccole come VA
Helices are depicted as coils and b-strands as arrows, the two calcium ions as spheres.
The haem with the proximal and distal histidine, His82 at the entrance of the haem-access
channel (left-hand side), four carbohydrate molecules, Trp171 and the disulphide bridges are
represented as ball-and-stick models. The distal domain is below and the proximal domain
above the haem plane.
VA modelled into the haem-access channel of LiP
In this position the substrate is with its 4-methoxy group within van der Waals distance of the
8-methyl substitutent and the propionate group of the pyrrole ring A of the haem. A hydrogen
bond of the hydroxy group of VA with His82 at the entrance of the channel is depicted as a white line.
L’indagine strutturale ha messo in evidenza una significativa densità eletronica sul C del
Trp 171, attribuibile alla presenza di un gruppo OH.
Tale idrossilazione avviene in presenza di H2O2.
Trp 171 sembra coinvolto nel meccanismo catalitico, comportandosi come donatore interno
di elettroni e generando un radicale catione Trp.
Il residuo 172, contiguo al Trp, è in contatto di Van der Waals conL’eme e puo’ rppresentare
una via di passaggio degli elettroni dal Trp 171 al cofattore.
Il gruppo OH, con effetto elettron attrattore sull’anello indolico, puo’ stabilizzare il radicale catione
e la sua reattività
Struttura della MnP
MnII, lega un propionato dell’eme e le catene laterali di 3 AA, Glu35, Glu39,
and Asp179, e a 2 molecole di solvente
Rappresentazione stereo del sito attivo
Il residuo del sito attivo Arg 42 è mostrato nelle 2 conformazioni, nativa e composto I.