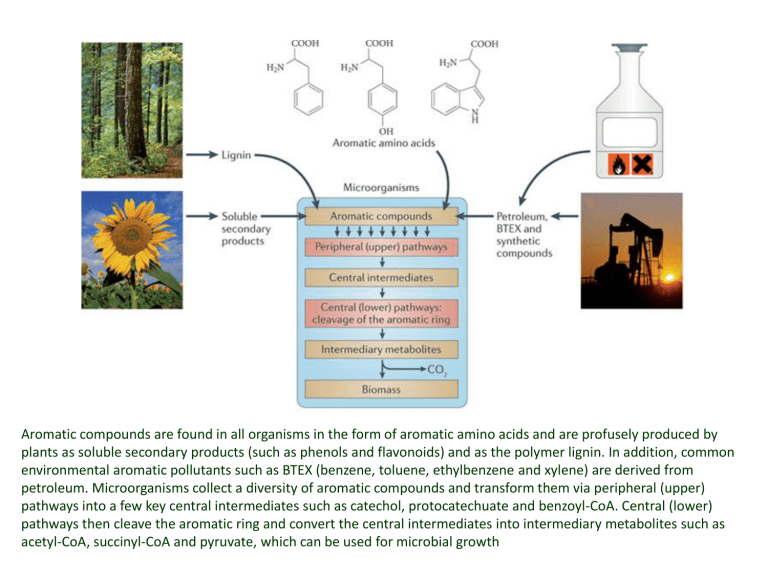
Aromatic compounds are found in all organisms in the form of aromatic amino acids and are profusely produced by
plants as soluble secondary products (such as phenols and flavonoids) and as the polymer lignin. In addition, common
environmental aromatic pollutants such as BTEX (benzene, toluene, ethylbenzene and xylene) are derived from
petroleum. Microorganisms collect a diversity of aromatic compounds and transform them via peripheral (upper)
pathways into a few key central intermediates such as catechol, protocatechuate and benzoyl-CoA. Central (lower)
pathways then cleave the aromatic ring and convert the central intermediates into intermediary metabolites such as
acetyl-CoA, succinyl-CoA and pyruvate, which can be used for microbial growth
Reazioni di ossigenazione nella biodegradazione dei
composti aromatici
extradiolo diossigenasi
OH
O2
H
OH
H
OH
COOH
CHO
OH
O2
OH
COOH
diossigenasi idrossilanti
COOH
intradiolo diossigenasi
Ciclo di
ossidazione
dei
composti
aromatici
Diossigenasi Idrossilanti
ISP: iron-sulfur protein
Bertini, Cremonini, Ferretti, Lozzi, Luchinat, Viezzoli
Coord.Chem.Rev. 1996
monomeri
Multimero (a3b3)
PM: 200’000
EteroMultimeri
(anbn)
OmoMulti
meri (an)
Gibson & Parales
Curr.Op.Biotech.
2000
Naftalene
diossigenasi
Naftalene
Indolo
Naftalene cis-diidrodiolo
Karlsson et al. Science 2003
2 enantiomeri
2NTDO = 2-nitrotoluene
diossigenasi
2 regioisomeri
Ring-cleaving diossigenasi
COOH
CHO
COOH
protocatecuato
OH
COOH
OH
O2
3,4 PCD
O2
COOH
COOH
COOH
OH
CHO
COOH
OH
semialdeide a-idrossi-carbossi muconica
COOH
COOH
OH
HO
acido b-carbossicis,cis muconico
COOH
O2
gentisato
semialdeide a-idrossi-carbossi muconica
1,2 GTD
O2
O
COOH
HO
acido maleil piruvico
Posizione centrale di PCA e GTA nei pathways di degradazione degli aromatici
Schema dei siti metallici in intra- e extradiolo diossigenasi
Tyr
His
His
HO
His
OH 2
Fe III
Fe II
Tyr
Glu
OH 2
His
intra-diolo
extra-diolo
protocatecuato
3,4 diossigenasi (3,4 PCB)
2,3diidrossi-bifenile
1,2-diossigenasi (BphC)
Siti di coordinazione liberi o occupati da molecole di solvente e disponibili per
legare O2 e substrato
Fe(II)
(Tyr)-O- (Asp)-O- (Glu)-O- His-N (Cys)-SFe(III)
Leganti che stabilizzano il ferro(II) rispetto al ferro(III)
Proprietà molecolari di intradiolo diossigenasi
Struttura di 3,4 PCD da P.aeruginosa
Le 12 subunità a sono disposte ai 4 vertici di un tetraedro.
Le subunità b formano la struttura centrale dell’enzima e determinano la stabilizzazione
della struttura quaternaria
Fe3+ è situato all’interfaccia tra le subunità a e b.
E’ coordinato a 4 residui appartenenti alla subunità b (Tyr-108, Tyr-147, His-160 e His-162) e
giace in una tasca formata da un lato da residui della subunità b e dall’altro della a.
Residui della subunità a, che si affacciano sul Fe3+ , contribuiscono ad orientare correttamente il
substrato. Sono la Pro-15 (orienta anello aromatico) e l’Arg-133 (stabilizza il COO-)
Allargamento iperfine del segnale EPR (g=4.28) in presenza del substrato
EPR in presenza di substrato con 17O sugli OH indica il legame del substrato con entrambi gli OH.
Non si osserva invece variazioni se al complesso si aggiunge H2O arricchita con 17O, indicando
che l’acqua viene allontanata.
Dati EXAFS indicano la presenza di 5 leganti (N/O) a distanza media di 1.99 Å.
Ipotesi sul legame del substrato
alla protocatecuato 3,4 diossigenasi
R
R
R
R
R
R
OH
O
O
+
N
N+
O
OH
Fe
HO
O
O
OH
Fe
NH
R
+
N
N+
H 2O
NH
R
NH
R
NH
R
R
Meccanismo
di rottura
intradiolica
catalizzata da
Fe(III)
diossigenasi
R
R
R
R
Schema completo
(sulla base di calcoli
DFT alcune
alternative sono
possibili per il
riarrangiamento
dell’intermedio h fino
al prodotto m)
Proprietà molecolari di extradiolo diossigenasi
Meno stabili delle intradiolo. Per la purificazione è necessario introdurre stabilizzanti che
impediscono la perdita del Fe(II) (cys, solventi organici, Fe2+). Esposizione a ossidanti disattivano
l’enzima
Struttura di 2,3 diidrossibifenile 1,2 diossigenasi
The enzyme consists of two domains which share the same fold; each domain contains two ßaßßß repeats.
The three iron ligand residues are provided by the Cterminal domain. Note that the protein binds two
iron atoms: an active site iron buried in the domain B and an adventitious iron present with partial
occupancy and is derived from the crystal stabilising solution
Geometria di coordinazione del ferro
Ipotesi sul legame del substrato a extra-diolo diossigenasi
EXAFS indica presenza di 2 His nel sito di coordinazione del Fe2+
Possibili leganti del Fe2+
2 His, H2O / Glu (non ci sono evidenze spettroscopiche)
Da X-ray di 2,3 diidrossibifenile 1,2 diossigenasi (BphC)
His
OH 2
His
Fe
OH 2
His
Glu
His
S
O
Fe
O
Glu
Meccanismo di
rottura
extradiolica
catalizzata da
Fe(II)
diossigenasi
Confronto tra intra- ed extra-diolo diossigenasi
INTRAFe3+ (acido di Lewis) attiva il substrato per l’attacco nucleofilo su
O2 .
Il substrato può cambiare tipo di coordinazione (da bidentato a monodentato) in
seguito al legame dell’O2.
EXTRAFe2+ può essere sostituito da Mn2+. Il suo ruolo è quello di
orientar e correttamente i due reagenti e di modificarne le
configurazioni elettroniche.
Il substrato non cambia tipo di coordinazione in seguito al legame dell’O2
sul Fe2+.
Schema della degradazione di un idrocarburo
alifatico saturo a catena lineare (n-alcano) mediante
ossidazione del gruppo metilico terminale
TOL pathway
Ciclo di
ossidazione
dei
composti
aromatici
Schema generale della degradazione di composti aromatici
Modalità di apertura
dell’anello aromatico
del catecolo.
Le due vie in meta
sono usate anche in
funzione della
presenza di
sostituenti sull’anello
Modalità di apertura dell’anello aromatico di
composti diidrossilati diversi dal catecolo.
Un esempio di via periferica che porta alla
formazione di catecolo.
Le possibili vie
periferiche per la
degradazione del
toluene
Degradazione dello stirene
A: attacco iniziale di una
monossigenasi sul vinile
B: attacco iniziale di una
diossigenasi sull’anello
Diverse vie per la degradazione
degli xileni
Orto-xylene: è preferito attacco
sull’anello
Meta- e para-xylene: è preferita
la via TOL
Il simbolo indica l’arresto del
processo di biodegradazione
Biodegradazione del trimetil benzene attraverso la via TOL (A). In B la via TOL porta a un
intermedio non ulteriormente biodegradabile
The aerobic degradation of benzoate
in bacteria and fungi is shown here
as an example of a classical O2dependent strategy for aromatic-ring
cleavage. Fungi convert benzoate
mainly to protocatechuate, by monoand dioxygenases, whereas most
bacteria form catechol. Centralpathway ring-cleaving dioxygenases
cleave the ring either between the
two hydroxyl groups (ortho-cleavage,
seen in the β-ketoadipate pathway)
or next to one of the hydroxyl groups
(meta-cleavage).
Pathways of
aromatic compounds
degradation
OH
Degradazione di naftalene e antracene
Regolazione (negativa) della degradazione del bifenile in
Pseudomonas KKS102
HOPDA
Gli enzimi sono espressi debolmente in assenza di bifenile
Gene, Volume 256, 2000, Pages 223-228 Y. Ohtsubo et al.
Regolazione della degradazione del bifenile in P. pseudoalcaligenes KF707:
due regolatori
1
2
La regolazione di BphR2 non è nota