E’ vecchia esperienza che attraverso i suoi errori la Natura ci offre spesso
possibilità inattese di intuire i suoi segreti che sarebbero altrimenti impenetrabili
A.Loewy e C. Neuberg
Evoluzione
Variabilità
genetica
Selezione naturale
Diversità
• Nuovi modi di sfruttare efficacemente l’ambiente
• Competizione con le altre specie
• Riprodursi con successo
La variabilità genetica causa la formazione
di nuove specie
I meccanismi fondamentali che provocano
variabilità genetica sono:
• Le mutazioni
• La riproduzione sessuale
Le mutazioni sono variazioni della
sequenza nucleotidica del DNA.
Possono essere causate da:
• errori durante la duplicazione del DNA
• esposizione delle cellule ad agenti fisici o chimici (agenti
mutageni)
Effetti delle mutazioni
Alterazione della funzione di una proteina
Nessun effetto sulla proteina
Un miglioramento della funzione
Alterazione della funzione di una proteina
A1
A
A
A1
Nessun effetto sulla proteina
A
A
A1
Un miglioramento della funzione
A
A
A1
Cicli ripetuti di errori e prove
Evoluzione
“Il caso e la necessità”
A1 – B1
A–B
A2 – B2
A1
A2
B1
B2
soluzione ottimale
soluzione indifferente
soluzione letale
soluzione indifferente
peggiore di A1
Alcune parti del genoma cambiano più
facilmente di altre nel corso
dell’evoluzione
Altre, invece, sono altamente conservate e
corrispondono a regioni funzionalmente
importanti di geni che codificano per
proteine o per RNA essenziali
Rimangono perfettamente riconoscibili in
tutte le specie viventi
e sono quelli che dobbiamo utilizzare se
vogliamo ricercare relazioni di parentela
tra i diversi organismi
PROTEIN SEQUENCES ALIGNMENT
RNA ribosomiale
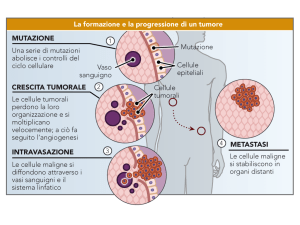
Mutazioni somatiche e germinali
Le conseguenze che una mutazione genica avrà
sull’organismo dipendono:
•Da quando è cambiata la sequenza aminoacidica
della proteina;
•Dalla variazione quantitativa
Localizzazione
• Extragenica
• Promotore
• Introni
• Siti di splicing
• Sequenza codificante
Le mutazioni geniche che determinano
una variazione quantitativa o qualitativa
di una proteina possono causare la comparsa di
un fenotipo patologico
CDS
Mutazioni puntiformi
• Sostituzione (missense mutations; nonsense
mutations)
• Inserzione o Delezione (frameshift mutations)
Sostituzioni
Transizioni
Purina-purina o pirimidina – pirimidina
Transversioni
Purina – pirimidina o pirimidina - purina
La sostituzione di un nucleotide all’interno della
CDS può causare:
• La comparsa di un codone che codifica per lo
stesso aminoacido;
• La comparsa di un codone che codifica per un
diverso aminoacido
• La comparsa di un codone di STOP
Inserzione o Delezione
L’aggiunta o la rimozione di 1 o 2 nucleotidi
provoca lo scivolamento della corretta cornice di
lettura (Frameshift). Di solito si ha l’interruzione
della sintesi proteica in quanto si vengono a
trovare nella nuova cornice di lettura numerosi
segnali di arresto.
11_14.jpg
11_11_2.jpg
11_12.jpg
5’ UTR
3’ UTR
Effetto di alcune mutazioni sull’mRNA e
sulla proteina
Mutazioni dinamiche
Espansioni di triplette
11_05.jpg
11_05_2.jpg
X fragile
(309550)
Frequenza: 1/4000 maschi.
Ereditarietà: Legata al cromosoma X. Malattia causata da mutazione
dinamica.
Genetica: Nel 1991 è stato identificato il gene responsabile. La mutazione è
caratterizzata dall’amplificazione di un tratto di DNA costituito da una
specifica sequenza ripetuta (CGG). Nei soggetti normali è presente un
numero di ripetizioni variabili da 6 a 55. Esistono due differenti tipi di
mutazione: la premutazione (56-200) e la mutazione completa (>200). La
probabilità di espansione aumenta con le dimensioni della premutazione
e quindi con il passare delle generazioni (Paradosso di Sherman).
Diagnosi: La diagnosi molecolare (Southern blot) permette di individuare
anche gli individui con la premutazione.
Malattia di Huntington
(143100)
Frequenza: 5-10/100.000 nati vivi
Ereditarietà: autosomica dominante. Malattia causata da mutazione dinamica
Genetica: Il gene responsabile della malattia ed il suo prodotto proteico sono stati
identificati. Il gene definito Intersting Transcript (IT-15), è localizzato sul braccio
corto del cromosoma 4 (4p16.3). La malattia è associata all’amplificazione
patologica di una specifica sequenza ripetuta (CAG) nell’allele mutato. Nella
popolazione normale la tripletta è ripetuta 10-30 volte. Nei pazienti affetti il
numero di ripetizioni varia da 36 a più di 100. Un numero intermedio di
espansioni 30-35 volte, è considerato una premutazione.
Diagnosi: Il test genetico si basa sulla determinazione del numero di espansione
della tripletta.
Informally, the term mutation is often used to refer to a
harmful genome variation that is associated with a
specific human disease, while
the word polymorphism implies a variation that is
neither harmful nor beneficial.
However, scientists are now learning that many
polymorphisms actually do affect a person's
characteristics, though in more complex and sometimes
unexpected ways.
SNPs are very common variations
scattered throughout the genome.
Because they are fairly easy to
measure and are also remarkably
stable, being inherited from
generation to generation,
they have become useful as gene
"markers.”
If a particular SNP is located near a
gene, then every time that gene is
passed from parent to child, the SNP
is passed on also.
This enables researchers to assume
that when they find the same SNP in
a group of individual genomes, the
associated gene is present also.
Variations Causing No Changes
Variations Causing Harmless Changes
Variations Causing Harmful Changes
Finally, there are genetic
variations that have "latent"
Variations Causing Latent Changes
effects.
These variations, found in
coding and regulatory regions,
are not harmful on their own,
and the change in each gene
only becomes apparent under
certain conditions.
Such changes may eventually
cause some people to be at
higher risk for cancer, but only
after exposure to certain
environmental agents.
They may also explain why one
person responds to a drug
treatment while another does
not.
Individual SNP Profiles
The genome of each individual contains its
own pattern of SNPs.
Thus, each individual has his or her own
SNP profile.
When scientists look at all the patterns from
a large number of people they can organize
them into groups.
SNPs occur in both coding and noncoding regions and
can cause silent, harmless, harmful, or latent effects.
SNPs can be markers for cancer.
SNPs may also be involved in the different levels of
individual cancer risk observed.
In the future, SNPs databases may be used to improve
cancer diagnosis and treatment planning.
MUTAZIONI CROMOSOMICHE
Di numero
(Aneuploidie – Monosomie – Trisomie)
Di struttura
(Delezioni, inserzioni, traslocazioni, inversioni)
Delezione
Sindrome
Fenotipo
5p-
Cri du chat
Pianto simile al miagolio di
un gatto, diverse anomalie
del viso, severo ritardo
mentale
11q-
Tumore di
Wilms
Tumore renale
13q-
Retinoblastoma
Tumore dell’occhio
15q-
Sindrome di
Prader-Willi
Astenia ed accrescimento
lento nei neonati
Obesità ed attacchi
compulsivi di fame nei
bambini e negli adulti
Delezioni del braccio corto del cromosoma
5
02_20.jpg
Cromosomi acrocentrici 13, 14, 15, 21,22
02_21.jpg
02_22.jpg
Duplicazioni o delezioni
Acquisto o Perdita di materiale genetico
Di solito comportano alterazioni fenotipiche
Inversioni o traslocazioni
Trasferimento di materiale genetico
Spesse volte non comportano alterazioni fenotipiche
ma possono causare infertilità
Disomia uniparentale
Sindrome di Prader-Willi
Entrambi i cromosomi (15) sono ereditati dalla madre
Sindrome di Angelman
Entrambi i cromosomi sono ereditati dal padre
imprinting genomico
In alcuni casi l’espressione di alcuni geni può
variare secondo se sono stati ereditati per via
paterna o materna. Questa espressione
differenziale viene definita “imprinting
genomico”
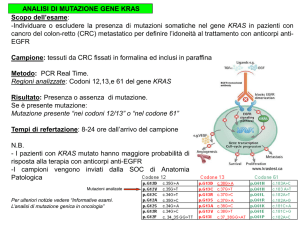
L’analisi delle mutazioni permette di:
• Identificare gli
presintomatica
individui
in
fase
• Individuare gli eterozigoti a rischio di
trasmettere una malattia genetica
• Effettuare la diagnosi prenatale
• Comprendere le basi genetiche delle
malattie complesse più comuni