Genoma Umano e malattie genetiche
lezione 3-4
Martedì 5 Maggio
le regioni regolative
non ci sono molti esempi già studiati
il primo classico è quella del locus della globina
una Locus Control Region fa parte di un cluster genetico
a livelli superiori mancano degli esempi più chiari
potrebbero mancare oppure sono da scoprire
regioni regolative con funzione
bidirezionale
per ora gli esempi più chiari stanno nelle Regioni Regolative
costituite da Enhancers
questo livello è molto vicino alla attività trascrizionale dei
geni che controllano e che costituiscono il cluster genico
questo tipo di controllo può essere bidirezionale:
TOP - DOWN
BOTTOM - UP
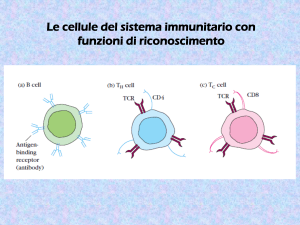
esempio del cluster delle Ig
la risposta immunitaria è data dall’interazione di molte
cellule e di molte funzioni collegate
con la regolazione dell’espressione delle Ig sono collegate
molte altre funzioni che sono coregolate o coordinate
il coordinamento deve prevedere:
- interazioni intracellulari
“
extracellulari
intracellulari: sopravvivenza, selezione, controllo moltiplicativo
extracellulari: interazioni con le altre cellule della risposta
immune “cross talking” tramite interleukine
partiamo da un esempio
un sistema piuttosto noto ed interessante
la regolazione delle immunoglobuline e dei linfociti B
la maturazione e l’attivazione vanno di pari passo
sistema multifattoriale
esempio di interazione genoma ambiente
the study of the 3’RR
TOR VERGATA
different aspects of the study of a regulatory region
interactions of a regulatory region: unidirectional flux ?
the jerarchy of the regulation
the genome is controlled by epigenetic events
interactions of genome and environment
these events open the possibility of a non univocal flux
needs to be bidirectional
TOR VERGATA
interactions and jerarchy
epigenetic modifications of the region:
nucleosome remodeling;
methylation
tools for a RR study
TOR VERGATA
the tools : - evolutionary conservation and transformations
- polymorphisms in humans (any kind!)
- transgenic models in mouse
- in vitro assays with cell lines (mouse and human)
“La regione regolativa 3’ della catena
pesante delle Ig: struttura e funzioni”
La tragedia dei linfociti B nati per morire all’ 80%
Il 20 % che sopravvive svolge il suo ruolo solo nella vecchiaia
(a parte le memory cells che sono minoranza)
- processi di maturazione ed interazioni
- cluster delle IgH (heavy) e struttura della regione regolativa
- processo evolutivo
- instabilità e regioni duplicate
- nell’uomo la regione IgH3’RR duplicata
- l’enhancer HS1,2-A/B è duplicato e polimorfico
- studio dell’attività tramite geni reporter in cellule trasfettate
- studio dei fattori che legano la sequenza enhancer EMSA
cascata di fosfatasi e kinasi
nel processo di maturazione dei linfociti B si verifica una
cascata di segnali
CD45
Rap 1
MAPKs
prima degli eventi di riarrangiamento messo in moto dal
preBCR
Locus
Catene
leggere
D-J
processing
V-DJ
VDJ
processing riarrangiato
VDJ
riarrangiato
VJ
riarrangiato
VJ
riarrangiato
VDJ
riarrangiato.
IgM prodotto
in membrana
VDJ
riarrangiato.
IgM prodotto
in membrana.
Lo splicing
produce anche
IgD
CELLULE B
Locus
Catene
pesanti
V-J
processing
ANTIGENE INDIPENDENTE
ANTIGENE DIPENDENTE
maturazione
Fig. 5A Schema del riarrangiamento delle catene leggere e pesanti dell’immunoglobuline in
correlazione con la maturazione dei linfociti B.
Locus
Catene
leggere
CELLULE B
Locus
Catene
pesanti
VJ
riarrangiato
VJ riarrangiato
Ipermutazioni
somatiche
VJ riarrangiato
Ipermutazioni
somatiche
VDJ
riarrangiato.
Le catene m
prodotte in
forma di
membrana
Switch isotipico
a Cg, Ca o Ce.
Ipermutazione
somatica
Switch isotipico.
Ipermutazione
somatica. Catene
pesanti prodotte in
forma di membrana
Switch isotipico.
Catene pesanti
prodotte in forma
secreta.
VDJ riarrangiato
Catene m prodotte
in forma secreta.
Centrociti
Cellule Memoria
Plasmacellule
Plasmacellule
Cellule B
attivate
ANTIGENE DIPENDENTE
VJ riarrangiato
Ipermutazioni
somatiche
VJ
riarrangiato
DIFFERENZAZIONE FINALE
maturazione II
Fig. 5B Schema del riarrangiamento delle catene leggere e pesanti dell’immunoglobuline in
correlazione con la maturazione dei linfociti B.
induzione dello switch
PLASMACELLULE
Cellule B proliferanti
IgG2a o IgG3
Cellula B attivata
(centroblasto)
IgA o IgG2b
IL-2; IL-4;
IL-5;
IgE o IgG1
Citokine proliferanti:
IL-2; IL-4; IL-5;
Citokine per il differenzamento:
IL-2; IL-4; IL-5; IFN-g; TNF-;
IL-2; IL-4;
IL-5;
cellule denditriche e T-helper
Fig. Azione delle citochine sulla ricombinazione class switching (CSR)
IgM
ricombinazione
VH
DH
JH
CH
Ricombinazione
V(D)J
V(D)J m
d
g3
g1 2b
e
a
• Consiste di sequenze
ripetute tra 1 e 10 kb
Ricombinazione class
switching (CSR)
IgM
V(D)J e
2a
Switch region:
m
a
2a
d
IgE
Risultato dello switch
2b
g3
• Il filamento non
stampo è ricco in G
g1
Circolo exciso
Fig. Ricombinazione class switching (CSR) nel topo.
• Sm, Sa ed Se hanno
un repeat di 5 bp. Sg
ha un repeat di 49 bp.
mappe dei loci IgH e IgL
LOCI DELLE CATENE PESANTI E LEGGERE DELL’Ig
Locus catena leggera l
Cromosoma 22
Locus catena leggera k
Cromosoma 2
Locus catena pesante
Cromosoma 14
il riarrangiamento
Trascrizione regione S
A
1
CSR
ricombinasi?
A
B
C
D
E
F
2
AID?
Modifica l’RNA e/o le
strutture del DNA delle
regioni S accessibili
RNA
editing ?
Riconoscimento delle
regioni S accessibili
B
C
AID?
CSR
ricombinasi?
A
B
Formazione di strutture secondarie (R loop?)
D
C
A
F
B
Formazione di breaks al DNA
E
AID?
una regione S
S
A B C
Delezioni intra-switch
Riparazione
dei breaks
C
A
AID?
due regioni S
D
F
E
Attivazione dei sistemi
di riparazione del DNA
B
Switch su un altro cromosoma
S S
A B E F
Class switching recombination
A
S
c-myc
traslocazione
Modelli che spiegano la Ricombinazione class switching (CSR).
Activation-induced cytidine deaminase (AID)
C
espressione nelle fasi di sviluppo
Sviluppo dei linfociti B indipendente dall’ antigene
pro-B “committed” esprimono B220 (CD45) e anche CD 43,
TdT terminal deossitransferasi, RAG-1, RAG-2, CD19
pre-B diminuzione di CD43, RAG-1 e 2, scomparsa di TdT,
riarrangiamento della catena pesante, pBCR pre B cell
receptor, riarrangiamento produttivo della catena leggera
espressione di membrana di IgM
Trascrizione dei surrogati delle catene leggere m Ig a/
formano il pre-B cell receptor complex di membrana
essenziale per le fasi di sviluppo
(CD45 - B220 - fosfotirosin fosfatasi PTPase integra i
segnali durante lo sviluppo, non necessario per la
linfopoiesi, forse è un’attività ridondante)
CD19 interagisce con le tirosin-kinasi, non è essenziale,
però favorisce l’entrata nel circolo periferico
maturazione nel germinal center
avviene in associazione intima con cellule THelper e cellule
dendritiche del follicolo :
-proliferazione clonale
-ipermutazioni somatiche
-selezione di affinità (self ed altro)
-selezione negativa
-switch isotipico
strutture regolative della trascrizione e
indirettamente del riarrangiamento delle IgH
promotori dei geni V
enhancer
intronico iEm
ECS (evoluz. conserved seq.) intervening 5’ CH genes
3’ Ig heavy 3’ enhancer complex o regulat. region
k intronico iEk
3’kE
l light chain El
si attivano per la trascrizione sterile insieme a RAG1/2 con altri
enzimi del riparo, variazione di metilazione e di struttura
cromatinica,
gli enhancers necessari anche per la ricombinazione V(D)J
I riarrangiamenti sono regolati da fattori di trascrizione ubiquitari
e tessuto specifico
Cluster organization:
evoluzione delle Ig
Sharks (hom shark)- multiple loci of each type except IgMgj
IgM
IgNAR
IgW
IgM1gj
(V DDJ Cm)200 (V DDDJ NAR)>2 (V DD J C)<10(VD J Cm1gj)<10
(multiple chromosomes)(not L chain-associated)
Translocon organization:
Channel catfish (700 - 800kb)
Cm
9J’s
many V’s VDJ D,J’s 100-200 V’sD’s
teleostei
Cm Cdsec Cdmem
IgM
lungfish
several V’s D, J’s Cm
dipnoi
several V’s D, J’s C
Presumptive arrangement
IgM
coelacanths
Cm
VD’s(>100) J’s
Xenopus (~800 kb)
IgW
VD’s(>100) J’s
IgM
V’s(100-200) D(>15) J(8-9) Sm Cm
crossopterigi (latimera)
C
IgY
IgX
S C
?S C
48 kb (duck); 80kb (chicken)
Duch and chicken
pseudoV’s(~100)
Cattle
V D’s J Sm Cm
C a Sa
S C
Transcriptional orientation
150 kb (cattle)
J(2)
E
7 geni costanti
V’s(~15) D(>3) Sm Cm Sd Cd Sg3 Cg3Sg1 Cg1Sg2 Cg2 Se Ce Sa Ca
Rabbit
J(6)
V’s(~100) D(14)
Sm Cm Sg Cg Se Ce Sa Ca Sa Ca Sa Ca Sa Ca Sa Ca Sa Ca
J(4)
Mouse
forse 13 geni costanti
E
200 kb
E
V’s(~100) D(14) Sm Cm Cd
J(6)
Human
13 Ca genes
E
V’s(~100) D(27) Sm Cm Cd
S Cg3 S Cg1 S Cg2b S Cg2a S Ce S Ca
E
8 geni costanti
350 kb
S Cg3 S Cg1 S e S Ca1
E
S Cg2 S Cg4 S Ce S Ca2
E
10 geni costanti
cluster Ig topo-uomo
centromero
a e
mta1 crip2 crip1 hole
Mouse Igh cluster
Chromosome 12
telomero
g2a g2b
g1
g3 d
m
trascrizione
mta1
J DV
Em
J
D
V
12F1
BAC199M11(AF450245)
a2 e
mta1 crip2 crip1 hole
Human Igh cluster
Chromosome 14
(rischio riarrangiamenti)
g4 g2 g
a1 e g1 g3 d m
Em
mta1
J
D
V
14q32.33
IgH3’RR-A
J DV
3’a2
g elk 2.1
3’a1
hs4
hs1.2
hs3 20bp
a1
3’a1
86,035,000
IgH3’RR-B
86,040,000
86,050,000
86,055,000
elk 2.2
hole
85,894,500
86,045,000
85,904,500
85,914,500
85,924,500
86,060,000
86,065,000
86,070,000
hs4
hs1.2
85,934,500
85,944,500
86,075,000
hs3 20bp a2
85,954,500
3’a2