ANTICORPI
Immunità specifica
Agisce in senso specifico, ossia per ogni tipo di
stimolo viene innescata una risposta che vale per
quello stimolo e non per altri. Questa specificità
assicura un alto grado di efficienza, in quanto
evita le risposte non necessarie. Ha memoria
immunologica.
I
componenti
dell’immunità
specifica
linfociti ed i loro prodotti, gli anticorpi.
sono
i
L’immunità specifica può essere di 2 tipi
* umorale (mediata da anticorpi).Le cellule
responsabili dell’immunità umorale sono i
linfociti B.
* cellulo-mediata (mediata dai linfociti T).Le
cellule responsabili dell’immunità cellulomediata sono i linfociti T.
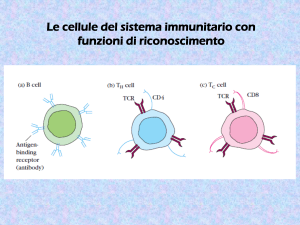
Cellule dell’ Immunità Specifica
•Linfociti B (Anticorpi)
•Linfociti T
GLI ANTICORPI
Gli anticorpi sono molecole prodotte in risposta
ad un antigene e sono capaci di formare un
legame specifico con la sostanza che li ha
indotti.
Gli anticorpi sono glicoproteine ed appatengono
alla famiglia delle GLOBULINE (proteine
globulari del siero).
Le Ig, o molecole anticorpali, sono
glicoproteine costituite da due tipi di catene
legate da ponti S-S, e da una quota di 4-18%
di carboidrati.
L'unità di base delle Ig ha un PM di circa 150
KD. Consta di due catene leggere denominate L
(light) e di due pesanti denominate H (heavy).
Le catene sono unite tra loro soprattutto da
ponti S-S ed in minor misura da forze non
covalenti.
STRUTTURA DELLE
IMMUNOGLOBULINE
Ciascuna catena è costituita da una parte
costante (CH e CL) ed una variabile (VH e VL).
Nelle regioni V, equivalenti al sito di legame
per l'Ag la sequenza di Aa varia nei diversi
anticorpi.
Le catene sono ripiegate tridimensionalmente in
loops o domains (domini globulari), determinati
da legami S-S intracatena: le catene leggere
hanno una sola VL ed una CL. Le pesanti hanno
invece VH, CH1, CH2, CH3.
Catene leggere
E’ stato dimostrato che le catene leggere della
maggior parte dei vertebrati esistono in due
forme strutturalmente distinte
Kappa e lambda
Qualsiasi tipo di catena leggera può combinarsi
con ciascuna catena pesante, però, in ogni Ig, sia
le catene pesanti che quelle leggere sono dello
stesso tipo.
CLASSI E SOTTOCLASSI
DELLE IMMUNOGLOBULINE
Nell’uomo vi sono 5 classi principali ed alcune
sottoclassi di immunoglobuline con proprietà
chimico-fisiche
biologiche
(peso
molecolare,
(opsonizzazione)
e
carica…),
sierologiche
(reazione con l’antigene) diverse che dipendono
essenzialmente dalla struttura primaria delle
catene pesanti.
Possiamo distinguere cinque tipi di
catene pesanti che determinano la
classe dell’anticorpo:
•Gamma: γ
IgG
•Alfa: α
IgA
•Mu: µ
IgM
•Delta: δ
IgD
•Epsilon: ε
IgE
FUNZIONI DELLE
IMMUNOGLOBULINE
Tutti
gli
isotipi
di
immunoglobuline,
l’eccezione delle IgD sono bifunzionali:
•Legano l’antigene
•Presentano una o più funzioni effettrici.
con
IgG
Caratteristiche delle IgG
•Costituiscono la principale componente delle
immunoglobuline; hanno un peso molecolare di
150kDa e si presentano come MONOMERI
•Sono in grado di legarsi ad un gran numero di
cellule (granulociti, macrofagi e cellule NK).
•Sono in grado di attraversare la placenta
•Sono in grado di attivare il complemento
(Attraverso la via classica; tranne sottotipo Ig4)
IgM
Caratteristiche delle IgM
•Possono trovarsi sia in forma MONOMERICA
(presenti sulla membrana del linfocita B maturo),
o in forma PENTAMERICA (circolanti nel
siero).
•Sono le prime Immunoglobuline ad essere
prodotte.
•Sono presenti
basse (8-10%).
in
concentrazioni
piuttosto
•Hanno un’elevata capacità di attivazione del
complemento.
IgA
Caratteristiche delle IgA
•Rappresentano la seconda classe di Ig circolanti
con circa il 15% ma si trovano in percentuale
molto più alta nelle secrezioni (Latte, saliva,
lacrime, secrezioni nasali) e a livello delle mucose
del tratto bronchiale e digerente dove svolgono
un importante ruolo nei meccanismi di difesa in
quanto impediscono l’aderenza dei microrganismi
all’epitelio impedendone la proliferazione
•Si trovano in forma MONOMERICA (Ig di
membrana) o in forma DIMERICA (Ig nel siero).
Il ruolo delle IgA a livello delle mucose è
importantissimo (unici due apparati che mettono
in comunicazione l'interno con l'esterno sono
digerente ed il respiratorio) Le IgA sono
prodotte in forma dimerica;
Le cellule che producono le IgA si trovano nella
tonaca mucosa, proprio al di sotto dell'epitelio.
Il recettore legato alla IgA viene quindi internalizzato per
endocitosi nella cellula epiteliale della mucosa, e viaggia in
una vescicola endocitotica fino al versante luminale della
cellula: a questo punto, la vescicola si fonde con la
membrana plasmatica e la porzione del recettore poli-Ig
contenente i cinque domini Ig viene clivata e secreta nel
lume assieme alla IgA, prendendo così il nome di
"componente secretoria".
Le IgA secrete nel lume vanno a mischiarsi nel muco
prodotto dalle cellule epiteliali e costituiscono una prima
barriera difensiva contro i microbi.
IgE
Caratteristiche delle IgE
•Le IgE umane hanno circa un peso di 190 kDa e
sono presenti nel siero delle persono normali alla
concentrazione di 0.003%
•Una volta prodotte, si legano ai recettori per il
frammento Fc espresso dai mastociti, si
aggregano e danno inizio ad un processo detto di
DEGRANULAZIONE mediante il quale si liberano i
mediatori chimici tra cui l’ISTAMINA.
•Negli
individui
non
allergici,
un’elevata
concentrazione di IgE indica una infestazione di
tipo parassitario.
IgD
Caratteristiche delle IgD
•Si presentano come monomeri ed hanno un
peso di circa 150 kDa.
•Costituiscono circa l’1% delle Ig circolanti.
•La
loro
funzione
tuttavia
non
è
chiara:
sembra che queste immunoglobuline abbiano
funzione di recettore per l’antigene.
Come può un genoma di per sé
limitato, fornire le informazioni
richieste per il vasto repertorio di
molecole di anticorpo che un
individuo può sintetizzare
Teoria dell’inizio XX secolo
Eventi di ricombinazione somatica erano
capaci di coinvolgere una quantità limitata di
materiale genetico e produrre un numero
quasi infinito di combinazioni, creando un
vasto
repertorio
di
recettori
antigeni.
•RICOMBINAZIONE SOMATICA
•MUTAZIONE SOMATICA
per
gli
Riarrangiamento della catena pesante (1)
Il DNA germinale che codifica per le catene delle
immunoglobuline mostra un elevato livello di complessità:
l’informazione per le regioni VARIABILI è presente in
segmenti genici V, D e J che combinano a livello del DNA.
La ricombinazione dei segmenti VDJ genera una sequenza
continua che codifica per il dominio V,separata dai domini C.
Il DNA che codifica per l’inizio e la fine del gene C viene
trascritto in un RNA eterogeneo (hnRNA). Questo RNA
viene elaborato e si ottiene un mRNA che codifica per i
segmenti V e C che verranno tradotti in proteina.
Riarrangiamento della catena pesante (2)
Il locus della catena
pesante è sul cromosoma
14. Il riarrangiamento
produttivo del locus
genico Vh è un evento
obbligatorio nella
generazione delle cellule B
e precede il
riarrangiamento delle
catene leggere.
Segmenti V da 38-45
Segmenti D da 1-23
Segmenti J da 1-6
Riarrangiamento della catena leggera (1)
Il locus della catena
leggera k è sul cromosoma
2.
Segmenti V da 31-35
Segmenti J da 1-5
Il locus della catena
leggera l è sul cromosoma
22.
Segmenti V da 29-33
Segmenti J da 7-11
Ricombinazione delle catene
pesanti/leggere
La ricombinazione dei segmenti genici germinali è un
aspetto chiave nella generazione del repertorio primario
degli anticorpi. Come avviene?
Ciascun segmento V, D e J è affiancato da sequenze
segnale per la ricombinazione (RSS)
•Un eptamero (i 7 nucleotidi CACAGTG)
•un nonamero (i 9 nucleotidi ACAAAAACC) separati da un
sequenza spaziatrice che può contenere o 12 o 23 bp.
Il processo di ricombinazione è attivato da due proteine
chiamate RAG 1 e RAG 2 (geni attivanti la ricombinazione)
•Il complesso RAG1 e RAG2 riconosce le sequenze RSS e
porta queste due sequenze ad unirsi complesso sinaptico
•Le due proteine RAG iniziano a tagliare nella parte 5’
dell’eptamero e della regione codificante
•Le proteine RAG trasformano questo taglio in una vera e
propria rottura del doppio filamento
•lo spezzone di DNA contente le RSS viene rimosso sotto
forma di anello (per i legame fra le sequenze segnale) e la
conseguente unione dei segmenti (possibile azione della
desossiribonucleotidil transferasi terminale)