SISTEMA IMMUNITARIO
Sistema complesso caratteristico dei vertebrati con
funzioni di sorveglianza dell’ambiente interno e difesa
dall’invasione di materiale ‘non-self’ (e quindi
potenzialmente patogeno)
L’osservazione della capacità di acquisire un’immunità
verso molti patogeni è molto antica,
Tucidide V sec. A.C. solo i sopravvissuti alla peste
potevano curare i malati
1798 Jenner, primo vaccino contro il vaiolo
Pasteur (1822-1895) sviluppo anche di altri vaccini
1890 viene dimostrato che il siero di animali
immunizzati contro la difterite è in grado di trasferire lo
stato immune ad altri animali (risposta immunitaria
umorale), solo nel 1930 vengono identificati i mediatori
di questo trasferimento (gli anticorpi o
immunoglobuline)
In alcuni casi per il trasferimento dell’immunità è
necessario il trasferimento di cellule (immunità cellulomediata)
Immunità innata e Immunità adattativa
La prima è solo parzialmente specifica, interviene in tempi
molto brevi, spesso è sufficiente a evitare il diffondersi
dell’infezione
Nei casi in cui ciò non si verifica entra in gioco la Risposta
Immunitaria Adattativa
Risposta immunitaria adattativa è caratterizzata da:
•
Specificità Ag diversi inducono risposte diverse
•
Diversificazione capacità di rispondere a moltissimi
Ag diversi
•
Memoria potenziamento in caso di secondo
incontro con il medesimo Ag
•
Non reattività verso il self
E’ divisa in due fasi:
RICONOSCIMENTO del ‘non-self’
RISPOSTA (neutralizzazione)
Risposta primaria e risposta secondaria
STRUTTURA DELLE Ig (mediatori della risposta adattativa)
Digestione
parziale con
enzimi
proteolitici
L’IMPORTANZA DELLA REGIONE CERNIERA
La scoperta che individui affetti da mieloma
multiplo (tumore derivato da una plasmacellula)
producono in grande quantità Ig con un’unica
specificità antigenica, ha reso possibile il
sequenziamento delle catene leggere (L) e pesanti (H)
delle Ig
Il confronto delle sequenze ottenute da pazienti
diversi ha evidenziato che, sia le catene L che le H,
presentano una porzione Costante (ca.110 aa nelle
catene L e ca. 330 o 440 nelle H) che è pressoché
uguale in tutte le Ig e una porzione Variabile (ca. 110
aa sia per le catene L che per le H) specifica per la
singola Ig
Sulla base della sequenza amminoacidica
della porzione costante le catene pesanti
possono essere suddivise in 5 differenti classi
(e alcune classi possono essere suddivise in
sottoclassi) che vengono indicate con lettere
dell’alfabeto greco (a, g, d, e, m)
Le catene leggere possono essere suddivise in
2 differenti tipi (k e l) e le k in sottotipi
Le catene pesanti g, d e a
hanno 3 domini C
Le catene pesanti m e e
hanno 4 domini C
LE CINQUE CLASSI DI Ig
Le Ig vengono prodotte come proteine
secrete o di membrana
LE TRE REGIONI IPERVARIABILI (CDR = Complementarity
Determining Region) DEL DOMINIO VARIABILE
Le CDR delle catene L ed H vengono a trovarsi spazialmente vicine nella struttura quaternaria
sito di legame per l’Ag
Differenze isotipiche
Individui della stessa
specie presentano
tutti gli stessi isotipi.
Il numero di diversi
isotipi varia da
specie a specie
Differenze allotipiche
Si riscontrano tra
individui della stessa
specie
Differenze idiotipiche
Si riscontrano tra
linfociti B dello stesso
individuo
La struttura delle Ig presenta alcune caratteristiche difficili
da conciliare con i modelli genetici classici dell’epoca in
cui la loro struttura è stata in gran parte chiarita
Enorme diversità (= grande repertorio, dell’ordine di
108 -109) in ciascun individuo
Presenza nella stessa molecola di una regione
variabile (sostanzialmente unica, cioè presente solo
in quel clone cellulare) e di una regione costante
Esistenza di Ig di classi diverse ma con la stessa
specificità antigenica
1965 - Dreyer e Bennett ipotizzano che sia le catene
pesanti che le leggere siano codificate da due
segmenti genici distinti che in qualche modo ad
un certo stadio dello sviluppo dei linfociti
riarrangiano e formano un unico gene che viene
trascritto e tradotto (viene contraddetto il
dogma un gene una catena polipeptidica)
Essi inoltre ipotizzano l’esistenza di molti (centinaia o
migliaia) segmenti V e di pochi segmenti C
Solo nel 1976 si è avuta la prova definitiva
della sostanziale esattezza di questa ipotesi
Hozumi e Tonegawa confronto tra i DNA
estratti da cellule di mieloma e da cellule embrionali
digeriti con RE e ibridati con due sonde: una
corrispondente al completo mRNA della Ig, l’altra
ottenuta dalla porzione 3’ dell’mRNA della Ig il
pattern di bande ottenute con queste due sonde è
diverso nei due DNA
Sonda mRNA completo: due bande dal
DNA embrionale e una sola dal DNA di
mieloma (diversa dalle due del DNA
embrionale)
Sonda mRNA 3’: una sola banda sia dal
DNA embrionale che da quello di mieloma ma
di dimensioni diverse
Organizzazione dei cluster genici delle catene
leggere e delle catene pesanti delle
Immunoglobuline nell’uomo
Catene L: il riarrangiamento (V-J) a livello di DNA
porta alla formazione di un gene funzionante
Catene pesanti: ricombinazione V-D-J
La regione Variabile è codificata dai segmenti
genici riarrangiati:
V e J nelle catene leggere
V, D e J nelle catene pesanti
Il riarrangiamento avvicina sequenze
Promotrici e sequenze Enhancer
Il linfocita B maturo che non ha ancora
incontrato l’Ag esprime mIgM e mIgD
Splicing
alternativo
In ciascun linfocita B viene espresso un solo
allele per le catene pesanti ed un solo allele
per le catene leggere (esclusione allelica)
Grandezza del repertorio anticorpale generato
dall’unione combinatoriale dei diversi tipi di
segmenti
Il no. esatto dei segmenti V e D non è noto e probabilmente varia da individuo a
individuo
MATURAZIONE DEI LINFOCITI B
1. Riarrangiamento dei segmenti genici della catena pesante
produzione di catene m (e d) da un solo allele
2. Riarrangiamento dei segmenti genici della catena leggera k
produzione di una IgM (e IgD) completa (con catene k
prodotte da un solo allele)
3. Se lo step 2. non è stato produttivo, si ha riarrangiamento
dei segmenti genici della catena l produzione di una IgM
completa (con catene l prodotte da un unico allele)
Se non si arriva alla formazione di un gene VH E di un gene VL
funzionanti il pre-linfocita non sarà in grado di produrre
alcuna Ig e morirà per apoptosi
Il riarrangiamento produttivo del 1° allele blocca il riarrangiamento del 2°
allele – Se nessuno dei due alleli effettua un riarrangiamento produttivo
il linfocita muore per apoptosi
COME AVVIENE LA RICOMBINAZIONE DEI
VARI SEGMENTI GENICI ?
Sono necessarie sequenze segnale che
fiancheggiano le regioni che devono essere unite
e
sistemi enzimatici (sia ubiquitari che linfocitaspecifici)
STRUTTURA DELLE SEQUENZE SEGNALE (RSS =
Recombination Signal Sequence)
1. Riconoscimento delle RSS da parte
di RAG-1 e RAG-2 (complesso
enzimatico linfocita-specifico) e
sinapsi delle RSS i due segmenti
genici vengono avvicinati
2. Taglio di un singolo filamento di DNA
3. Taglio del secondo filamento e
formazione di ‘forcine’ a protezione
delle estremità tagliate
4. Taglio casuale delle forcine
5. Riunione delle estremità catalizzata
dal complesso enzimatico DSBR
(Double Strand Break Repair)
I punti di giunzione
possono variare.
Questa flessibilità
giunzionale può dare
origine a
riarrangiamenti non
produttivi
Si stima che solo nel
10% dei pre-linfociti si
verifichino
riarrangiamenti
produttivi per le catene
L e per le H
Un’ulteriore fonte di variabilità deriva dal
taglio casuale delle forcine e dall’aggiunta di
nucleotidi nel sito di riunione
Aggiunta di nucleotidi P e N
Origine della variabilità nelle tre CDR
Ig dello stesso isotipo e con uguale regione V vengono
prodotte sia come proteine di membrana che secrete
attraverso un meccanismo di splicing alternativo
Eventi di splicing alternativo producono anche Ig con la
stessa regione variabile ma diversa regione costante
Un altro fenomeno caratteristico dei
linfociti B è l’ipermutazione somatica
avviene solo in seguito al legame
con l’Ag
TCR = T Cell Receptor
Proteina di membrana dei linfociti T, scoperta e
caratterizzata all’inizio degli anni ’80, non esiste la forma
secreta
TCR = T Cell Receptor
I cluster genici del TCR nell’uomo
La ricombinazione dei segmenti genici del TCR
I meccanismi
di generazione
della diversità
nelle Ig e nei
TCR
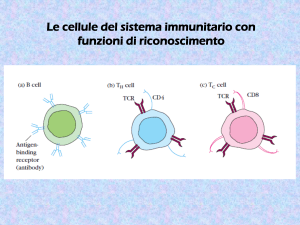
Il tipo di risposta effettrice dipende da quale cellula ha
riconosciuto l’antigene (linfocita B, linfocita TH o linfocita TC)
Linfociti B e T diversi producono BCR e TCR
diversi perché HANNO geni diversi e non perché
ESPRIMONO geni diversi
BCR e TCR il repertorio (capacità di
riconoscimento) della singola cellula è 1, il
repertorio dell’individuo è elevatissimo (108)
MHC-I e MHC-II il repertorio della cellula e
quello dell’individuo sono uguali (103)