C.T.S. S.r.l.
Pulitura del legno
e delle policromie
Seminario di restauro ligneo
"Dalle antiche vernici ai moderni
trattamenti di pulitura"
Villar Focchiardo, 4 Maggio 2007
Nuovi approcci alla pulitura
Paolo Cremonesi
e Richard Wolbers
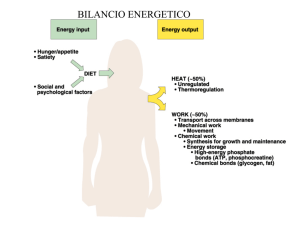
COMPOSIZIONE DELLA PATINA ORGANICA
Il materiale risultante è una
complessa miscela derivata
dalla modificazione di queste
sostanze:
GRASSI
CARBOIDRATI
BIOFILM
PROTEINE
ALTRO
Cosa intendiamo per “sporco”?
Parleremo di “sporco” impropriamente per indicare tutto ciò
che desideriamo rimuovere (quindi non ha un significato
chimico), racchiudendo:
Depositi superficiali
(polvere, smog,…)
Vernici ossidate e
ingiallite
Patinature applicate per
“anticare” l’opera o per
coprire i danni causati
da puliture eccessive
Residui di colle
Ritocchi applicati in
precedenti restauri
RESTAURO DEI BENI ARTISTICI: METODOLOGIA ATTUALE
METODO CHIMICO
METODO FISICO
METODO MECCANICO
METODO CHIMICO
SOLUBILIZZAZIONE GRADUALE DELLA PATINA ORGANICA PER APPLICAZIONE DI SOLUZIONI DI MISCELE DI
SOLVENTI:
ALCOLI
CHETONI
IDROCARBURI
CLORURATI
ALTRO
RESTAURO DEI BENI ARTISTICI: RISCHI ASSOCIATI
RISCHIO CHIMICO
ASSOCIATO AI POTENZIALI DANNI CHE I PREPARATI
POSSONO CAUSARE SIA PER EFFETTI CRONICI CHE
ACUTI, SUGLI OPERATORI CHE LI UTILIZZANO.
TOSSICO
NOCIVO
CORROSIVO
RESTAURO DEI BENI ARTISTICI: RISCHI ASSOCIATI
RISCHIO AMBIENTALE
ASSOCIATO AI POTENZIALI DANNI CHE I
RESIDUI DEI PREPARATI POSSONO CAUSARE
UNA VOLTA DISPERSI NELL’AMBIENTE (ARIA,
ACQUA E TERRENO).
INFIAMMABILE
PERICOLOSO PER
L’AMBIENTE
RESTAURO DEI BENI ARTISTICI: RISCHIO RESTAURO
PREPARATI AGGRESSIVI CHE CAUSANO DANNI IRREVERSIBILI
CHE POSSONO MANIFESTARSI ANCHE A DISTANZA NEL TEMPO
Mezzi acquosi tradizionali
Sfregamento con mostarda e lavaggio con acqua;
liscivia di ceneri vegetali o di urina; acqua forte con
sale e allume; spiriti di sale di vetriolo e di zolfo
(dal ricettario di Turquet De Mayerne 1620-1646)
Saliva_ La cui composizione è la seguente:
Acqua
solvente
Diammonio citrato
effetto chelante
Enzimi come l’amilasi
idrolizzazione
Proteine (mucina…)
tensioattivo
Meccanismi di solubilizzazione
Fisico_ si basa sulla polarità delle molecole del
solvente e dello “sporco” da rimuovere.
Devono rompersi i legami tra le molecole, ossia
gli intermolecolari, e crearsi nuovi legami
solvente-sporco (Es: un solvente idrocarburico
che scioglie una cera).
Chimico_ un “reagente” trasforma chimicamente
(ionizza, dissocia,…) lo “sporco”, creando nuovi
legami intramolecolari (Es: una base o un acido)
Chimico-fisico_ un meccanismo misto dei due
visti sopra (Es: la butilammina è un solvente,
che ha anche azione alcalina)
Solubilizzazione in mezzi acquosi
Tensioattivi_ basano la loro azione sulla
creazione di strutture a bassa energia,
rompendo i legami intermolecolari, quindi con un
meccanismo di tipo fisico.
Chelanti_ vanno a “sequestrare” un metallo
presente nella struttura dello “sporco”,
dissociandolo, quindi spezzando legami
intramolecolari, con meccanismo chimico.
Enzimi_ vanno a rompere con idrolisi i legami
intramolecolari, quindi con meccanismo chimico.
Dispersi in gel o coadiuvati da tensioattivi hanno
azione chimico-fisica
Cos’è il pH?
Il pH è una scala che definisce la
concentrazione di H+ (ioni idrogeno) nell’acqua.
Il valore 7 corrisponde alla neutralità, valori
inferiori (fino a 0) all’acidità, valori superiori (fino
a 14) all’alcalinità.
Essendo una scala logaritmica la differenza di 1
equivale ad un fattore 10.
Una soluzione di pulitura, a contatto con una
superficie acida o basica, può variare il suo pH,
perdendo capacità pulente. Possiamo utilizzare
speciali miscele, dette tamponi, capaci di
mantenere costante il pH.
Giocare con il pH
Alcune sostanze, invecchiando, diventano acide,
quindi a pH alcalini possono dissociarsi e diventare
solubili in acqua, o perlomeno rigonfiarsi.
A pH fortemente alcalini (come quello della soda)
questa reazione è violenta e incontrollabile
La vernice dammar rigonfia superato il valore 7,
l’olio oltre pH 8.5, le proteine invece, dato che
contengono sia gruppi carbossilici che amminici,
reagiscono sia in ambiente acido che basico
Attenzione! A certi pH possono avvenire reazioni
irreversibili, come la solubilizzazione del CaCO3
(Bianco S.Giovanni), sotto al pH 5.5.
“INTERVALLO DI SICUREZZA” DEL pH
5
6
7
8
9
pH
DIPINTI MOBILI
PITTURE MURALI
SOPRA pH 9 E SOTTO pH 5 DIVENTA TROPPO
FORTE IL RISCHIO DI IDROLISI DEI LEGANTI
ORGANICI, DEI MATERIALI CELLULOSICI, ecc.
Quali tamponi utilizzare?
5
6
7
8
9
pH
5-9
intervallo di sicurezza
(olio siccativo invecchiato)
Tampone
pKa
Intervallo di
pH
PM
Quantità
(g/l)
Bis-Tris
6.5
5.5-7.5
209.2
10.5
Tris o Trizma
8.1
7-9
121.1
6.1
TEA
7.8
7.3-8.3
149.2
7.5
DEA
8.9
8.2-9.5
105.1
5.3
MEA
9.5
8.9-10.2
61.1
3.1
Il deposito atmosferico
Molti sono i fattori che influiscono sulla deposizione:
La dimensione delle particelle_ Più grandi le
particelle, maggiore la forza di attrazione.
La ruvidità della superficie_ Le particelle hanno
massima tendenza ed aderire su una ruvidità media.
L’igroscopicità della superficie_ ad alte umidità
(RH>65%) l’acqua può condensare sulla superficie e
creare forze di adesione capillari.
La durezza della superficie_ più è morbida più
adesione avrò, come nel caso di vernici con Tg più
bassa della temperatura ambiente (PVA)
Composizione del deposito atmosferico
Materiale idrosolubile
15.9 %
Materiale liposolubile
7.1 %
Materiale inorganico (ceneri)
56.3 %
Umidità
3.0 %
Questo tipo di sporco è quindi solo parzialmente
solubile in acqua, il resto è disperdibile. La parte
grassa è costituita da idrocarburi. Il deposito ha un
pH neutro (6.7), quindi acidi o basi influiscono poco.
Materiali proteici
Su di una superficie policroma possono esserci
svariati materiali proteici come costitutivi dell’opera
(legante di una tempera o di una preparazione
magra) o residui di precedenti restauri (adesivi o
patinature), ed in particolare: colla di coniglio o
d’ossa, albume, rosso d’uovo.
Le proteine, disperse come colloidi in mezzo
acquoso, una volta applicate passano da stato sol
a gel, e perdendo progressivamente acqua si
denaturano, si irrigidiscono e diventano insolubili.
L’insolubilizzazione è incrementata dalla presenza
di reticolanti come sali metallici (Es: allume,calcio)
PERDITA DI COESIONE
•Da definire l’intervallo di
sicurezza !!!
BIO-DETERIORAMENTO
O IDROLISI
PROTEINE
INVECCHIATE
CROSS-LINKING
CATENE
GRANDI
RETICOLAZIONE CON
SALI METALLICI
INSOLUBILIZZAZIONE
• Necessità di idrolizzare
le catene con enzimi o
con acidi o alcali forti
ACIDI GRASSI
•Cala il pH
•Puliture con alcali
possono rigonfiare il film
•Intervallo di sicurezza 5-7
DE-ESTERIFICAZIONE
(IDROLISI)
OLI SICCATIVI
OSSIDAZIONE
SOSTANZE
POLARI
POLIMERIZZAZIONE
(CROSS-LINKING)
CATENE GRANDI
• Necessità di idrolizzare le
catene con azione
enzimatica o alcali forti
INGIALLIMENTO
Problema estetico/lettura
OSSIDAZIONE:
FORMAZIONE DI
CONIUGAZIONI
VERNICI
NATURALI
OSSIDAZIONE:
FORMAZIONE
GRUPPI
OSSIGENATI
SOSTANZE
POLARI
POLIMERIZZAZIONE
(CROSS-LINKING)
CATENE POCO
PIU’ GRANDI
Necessità di utilizzare solventi
più polari, che possono causare
il rigonfiamento del film di olio
INGIALLIMENTO
Minore delle naturali
Necessità di utilizzare solventi
più polari, che possono causare
il rigonfiamento del film di olio
OSSIDAZIONE:
FORMAZIONE DI
CONIUGAZIONI
VERNICI
SINTETICHE
OSSIDAZIONE:
FORMAZIONE
GRUPPI
OSSIGENATI
SOSTANZE
POLARI
POLIMERIZZAZIONE
(CROSS-LINKING)
STRUTTURE
TRIDIMENSIONALI
• Irreversibilità
• Necessità di rompere
le catene
RESTAURO DEI BENI ARTISTICI:
OBIETTIVO DI PRODOTTO
MIGLIOR GESTIONE DEL:
RISCHIO CHIMICO:
ELIMINAZIONE DEI
SOLVENTI PIU’ TOSSICI E NOCIVI (Xn R40 – R43, ecc.);
USO MENO CONSISTENTE DEI PREPARATI CLORURATI
E AROMATICI.
RISCHIO AMBIENTALE:
ELIMINAZIONE DELL’IMPATTO AMBIENTALE
(ABBASSAMENTO DELLE EMISSIONI).
RISCHIO RESTAURO:
INTERVENTI
ALTAMENTE SELETTIVI NEI CONFRONTI DEI
SUBSTRATI DA RIMUOVERE COL MASSIMO RISPETTO
DELL’INTEGRITA’ DELL’OPERA D’ARTE.
ENZIMI
ENZIMA LIPASI
Le Lipasi catalizzano l’idrolisi di
trigliceridi che sono i componenti
strutturali di olii e grassi.
Gli enzimi lipolitici catalizzano la
scissione nelle due posizioni
terminali, e più lentamente nella
posizione centrale, liberando una,
due o tre molecole di acido grasso.
Il monogliceride residuo o il
glicerolo e gli acidi grassi liberati
sono più solubili, e possono essere
rimossi da un mezzo acquoso.
LIPASI
O
H3 C
(CH2 )16 C
O
CH2
O
CH
O
CH2
LIPASI
O
H3 C
(CH2 )16 C
LIPASI
O
H3 C
(CH2 )16 C
Fig. 3 - Siti d'azione dell'enzima lipasi
ENZIMA LIPASI
Con le lipasi si può così intervenire su olii siccativi (vernici
oleo-resinose, “beveroni”, ridipinture).
Le lipasi agiscono come esterasi, quindi possono essere
impiegate per rimuovere cere e resine sintetiche come
esteri acrilici.
Certi metalli pesanti come il Ferro, il Piombo, il Mercurio e
il Rame agiscono come inibitori nei confronti dell’enzima.
Questi metalli sono contenuti in numerosi pigmenti, quali
Biacca, Minio, Cinabro, Ocre, Azzurrite.
Le ridipinture a velatura, con poco pigmento in molto olio,
sono attaccate dalle Lipasi, mentre ridipinture a corpo, con
tanto pigmento in poco olio, sono spesso resistenti
all’azione delle lipasi.
ENZIMA AMILASI
Le Amilasi sono presenti nella saliva e nella secrezione
delle cellule del tratto gastrointestinale e provvedono alla
digestione di carboidrati, frammentando le catene dei
polisaccaridi in mono, di e oligosaccaridi, più solubili.
Sono in grado di degradare gli amidi, contenuti nelle paste
d’amido, nelle gomme vegetali e nelle farine.
AMILASI
CH2 OH
O
H
H
H
OH
H
O
OH
CH2 OH
O
H
H
H
OH
H
O
CH2 OH
O
H
H
H
OH
H
O
CH2 OH
O
H
H
H
OH
H
H
OH
H
OH
H
OH
H
OH
CH2 OH
CH
OH
CH
OH
CH2 OH
2
2
O
O
H
O
O
H
H
H
H
H
H
H
H
H
H
H
H
OH
H
OH
H
OH
OH
H
H
O
O
O
O
OH
H
OH
H
OH
H
OH
H
OH
O
CH2
O
H
H
OH
H
H
OH
O
CH2 OH
O
H
H
H
OH
H
H
AMILASI
Fig. 5 - Formula di struttura del polisaccaride glicogeno e siti d'azione dell'enzima amilasi
OH
R
ENZIMA PROTEASI
Le Proteasi sono enzimi idrolitici in grado di degradare le
proteine e quindi sono adatti alla rimozione di materiali quali
albumine, colle e gelatine animali, uovo e caseine (non il
caseinato di calcio, presente soprattutto su dipinti
murali).
Le Proteasi scindono i legami peptidici che legano in catena
i singoli amminoacidi che formano le proteine.
PROTEASI
R
R
R
O
H
N
H2 N
O
H
N
N
H
O
H
N
N
H
O
R
O
O
R
n
OH
R
Fig.6 - Formula di struttura di una proteina e sito d'azione dell'enzima proteasi
I tensioattivi
Si definisce tensioattivo una qualsiasi sostanza
con caratteristiche sia idrofile che lipofile.
Un tensioattivo può presentare caratteristiche
più idrofile, risultando solubile in acqua, oppure
più lipofile, risultando solubile in solventi apolari.
Un tensioattivo abbassa la tensione superficiale
di un liquido, aumentando la bagnabilità.
In presenza di due fasi di diversa polarità un
tensioattivo tende a disporsi all’interfaccia.
I tensioattivi: la CMC
In acqua un tensioattivo si dispone all’interno
come un qualunque soluto. Superata una certa
concentrazione si dispone sulla superficie, con
la testa polare nell’acqua, e la coda apolare
rivolta verso l’aria. Questa concentrazione è
detta CMC, concentrazione critica micellare.
Al di sotto della CMC il tensioattivo non ha
effetto solubilizzante, che otteniamo solo
superando la CMC.
Tipologie di tensioattivi
Anionici
La testa polare è un gruppo
acido, e si dissocia dando un
anione, ossia una carica
negativa
SDS
Resin-soaps
Contrad
Cationici
La testa polare è un gruppo
basico, e si dissocia dando un
catione, ossia una carica
positiva
Sali d’ammonio
quaternari
Ethomeen
Nonionici
La testa polare non è dissociata
e non porta cariche
Tween 20
Brij 35
Triton X-100
Anfoteri
Sono presenti due teste polari,
una anionica e l’altra cationica
Mucina
I resin-soaps
Sono tensioattivi di tipo ionico la cui parte
apolare ha forte somiglianza con la struttura
delle resine naturali. La parte polare è costituita
da un gruppo carbossilico ionizzato a seguito
della reazione con trietanolammina (TEA).
I materiali di partenza sono l’acido abietico,
simile alla struttura delle resine di conifere e
leguminose (sandracca,…), e l’acido
deossicolico, simile a quella delle latifoglie
(dammar, mastice,…), e più polare, dato che
contiene due gruppi alcolici nella sua struttura.
Emulsione cerosa
Si tratta di una dispersione di cera d’api sbiancata in acqua
con stearato d’ammonio come tensioattivo, messa punto
dai ricercatori dell’Opificio delle Pietre Dure*, e
conosciuta quindi con il nome di “pappina fiorentina”.
Di per sé l’emulsione cerosa non ha capacità pulenti, ma
può essere utilizzata per la pulitura controllata di
superfici policrome sensibili, disperdendo al suo interno
piccole percentuali di solventi organici o di sostanze
alcaline (ammoniaca, trietanolammina).
Non è possibile invece aggiungere sostanze acide (acido
acetico, acido citrico) che ne causano lo smiscelamento.
* “Impiego di emulsioni quali supportanti di solventi in operazioni di
pulitura dei dipinti”, di R.Bellucci, E.Buzzegoli, M.Matteini, A.Moles;
in Metodo e Scienza, Sansoni Editore, Firenze (1982).
Emulsione cerosa: formulazione
Cera sbiancata
Acqua demineralizzata
Ammoniaca 30%
Acido stearico
= 500 gr
= 750 gr
= 12 ml
= 1.2 gr
L’acido stearico e l’ammoniaca (in eccesso) vengono
miscelati a parte, formando lo stearato d’ammonio.
L’acqua, scaldata a bagnomaria, viene addizionata con
la cera bianca (che fonde), e si aggiunge sotto
miscelazione lo stearato d’ammonio, continuando poi a
miscelare per eliminare l’eccesso di ammoniaca, fino a
raffreddamento.
I chelanti
Si definisce chelante una molecola dotata di due
o più gruppi elettrondonatori, capace di legarsi
con un catione metallico per dare un composto
stabile (detto anche complesso), e dalle
proprietà differenti da quelle del catione e del
chelante stesso.
La stabilità del complesso è indicata dalla
costante K. Per comodità utilizziamo il logaritmo:
più alto Log K, più stabile il complesso.
Molti pigmenti possono essere aggrediti da
questi reagenti, che devono quindi essere
utilizzati con estrema cautela
Tipologie di chelanti
Acido
citrico
acido tricarbossilico contenuto nel
succo di limone nell’ordine del 6%.
E’ solubile anche in alcoli e
Acetato di Etile
pH = 2.5
Alcalinizzato con NH3
forma i citrati per lavorare
in sicurezza con i pigmenti
EDTA
Sale bisodico dell’acido
etilendiamminotetracetico (EDTA
bisodico).
Nell' EDTA tetrasodico ogni
molecola si lega a due cationi
metallici.
L’EDTA si lega con tutti i cationi
metallici: ferro, rame, ma anche
calcio (rimuove incrostazioni e
patine che lo contengono, come
scialbature, patine di gesso,
solfatazioni, caseinato di calcio
L’EDTA bisodico ha un pH
4.5, il tetrasodico ha un pH
11.3.
Poiché il pH ottimale di
complessazione del calcio
è 10, in presenza di
CaCO3 come legante del
supporto è preferibile
utilizzare l’EDTA bisodico.
Concentrazioni variabili tra
il 2% ed ilfino al 15%