G. FABIANO
CRITICITA’ NELLE INFEZIONI IN
CHIRURGIA
INFLUENZA DEI MATERIALI PROTESICI E
DI SUTURA
XXII Congresso Nazionale
SIFIPAC
Padova 2 – 4 aprile 2009
L’aumentato utilizzo di materiali estranei in
molti campi della moderna chirurgia è correlato
ad un certo rischio di infezione batterica.
L’infezione delle protesi è una delle più temibili
complicanze correlate alla chirurgia in quanto
può esitare spesso in prolungata degenza, in
danni funzionali o, talora, in decesso.
Biomateriali = Corpi Estranei
In circostanze normali sono necessari
100.000 batteri per provocare una
infezione clinicamente significativa.
Quando vengono utilizzati materiali
alloplastici 100 - 1000 batteri possono essere
sufficienti.
Zimmerli 1982
Biomateriali impiantabili
Impianto permanente
Impianto temporaneo
Materiali di sutura
Protesi erniarie
Protesi mammarie
Protesi ortopediche
Protesi valvol. e vasc.
Derivazioni SNC
Protesi endo-oculari
Cateteri dialisi peritoneale
Dispositivi intrauterini
Impianti dentari
Cateteri intravascolari
Tubi endotracheali
Cateteri urinari
Dispositivi di assistenza
ventricolare
Lenti a contatto
Dispensatori di farmaci
impiantabili
Interazione materiale - ambiente biologico
L’impianto di un qualsiasi materiale estraneo
in un organismo comporta una serie di
effetti che, in ultima analisi, potranno portare
all’integrazione dell’impianto oppure, per cause
varie, al suo fallimento.
Tali effetti possono essere distinti essenzialmente
in due grandi categorie:
• quelli provocati dall’impianto sul tessuto ospite
• quelli invece provocati dal tessuto ospite
sul dispositivo impiantato.
Interazione materiale - ambiente biologico
Effetti dell’impianto sull’ospite
1. LOCALI:
a. interazioni con l’ospite
(attivazione complemento,
adesione e attivazione dei
leucociti)
b. cito ed emotossicità
c. modifica dei processi di guarigione
(infiammazione)
d. infezione
e. carcinogenesi
2. SISTEMICI e LONTANI
a. formazione di emboli
b. trasporto di materiale di rilascio ed
accumulo in organi bersaglio
c. sensibilizzazione allergica, tossicità
sistemica e reazioni immunitarie
Effetti dell’ospite sull’impianto
1. FISICO-MECCANICI
a. usura
b. fatica
c. corrosione
d. ossidazione e surface cracking
e. degradazione e dissoluzione
2. BIOLOGICI
a. absorbimento di sostanze dai tessuti
b. degradazione enzimatica
c. c. calcificazione
3. MISTI
a. environmental stress cracking
Interazione materiale - ambiente biologico
reazione da corpo estraneo
reazione da corpo estraneo
La sequenza degli eventi locali successivi
all’impianto è:
1. ingiuria tissutale
2. infiammazione acuta
3. infiammazione cronica
4. tessuto di granulazione
5. reazione da corpo estraneo
6. fibrosi.
A. L’infiammazione acuta è di breve durata, da
minuti a giorni, consiste nell’essudazione di
fluidi e proteine plasmatiche (edema) e
migrazione di leucociti (soprattutto
neutrofli).
B. L’infiammazione cronica dipende dalle
proprietà chimico-fisiche del materiale e dai
movimenti dell’impianto; in genere è di
breve durata e rimane circoscritta al sito di
impianto. Richiama monociti/macrofagi e
linfociti. Si ha neovascolarizzazione e
proliferazione di tessuto connettivo.
C. La reazione da corpo estraneo con sviluppo
di tessuto di granulazione è considerata la
risposta normale di integrazione
dell’impianto di materiali. Si ha
proliferazione di fibroblasti e cellule
endoteliali, seguita da cellule giganti
(FBGC).
D. La fibrosi o l’incapsulazione fibrotica
rappresenta in genere l’ultimo stadio della
risposta infiammatoria
Interazione materiale - ambiente biologico
Superficie del materiale
A livello della superficie del materiale, i fenomeni conseguenti
l’impianto in ordine temporale si possono così riassumere nel
modo seguente:
•adsorbimento superficiale di proteine
•adesione cellulare
•attivazione cellulare
La natura dello strato proteico adsorbito dipende dalle proprietà e
dalla topografia di superficie del materiale/dispositivo, dalle
proprietà delle proteine presenti nei fluidi circostanti e dalla
organizzazione delle proteine adsorbite.
L’adesione e l’attivazione cellulare sono invece dipendenti dal tipo di
proteine adsorbite, dalla loro conformazione e dal successivo
riarrangiamento dello strato proteico adsorbito.
Interazione materiale - ambiente biologico
Meccanismo di adesione cellulare
a) non specifica, non mediata da recettori
b) superficie non adesiva, interazione debole
c) adesione specifica, mediata da recettori
d) cellule incluse in un gel deposto in superficie
Interazione materiale - ambiente biologico
Organificazione della superficie
L’organificazione della superficie, ovvero il modo
e il tipo di adsorbimento delle proteine, condiziona
le successive interazioni con gli elementi cellulari
con cui la superficie si trova in contatto, che
dipendono ovviamente dal sito in cui il materiale è
stato impiantato e dalle relative condizioni fisiopatologiche
Interazione materiale - ambiente biologico
Proprietà di superficie dei materiali
• Le proprietà intrinseche di qualsiasi materiale dipendono
dalla sua struttura atomica o molecolare interna ed è questa
ad influire sul comportamento fisico-meccanico del
materiale stesso.
• L’interfaccia con l’ambiente in cui il materiale deve
operare gioca un ruolo cruciale nel determinare gli
eventi successivi ed in questo contesto sono di
fondamentale importanza le proprietà della superficie
del materiale.
Interazione materiale - ambiente biologico
Caratterizzazione superficiale
•la rugosità,
•la bagnabilità (i.e. tensione critica superficiale),
•la mobilità superficiale,
•la composizione chimica,
•la cristallinità
Interazione materiale - ambiente biologico
Reazioni all’interfaccia
Dopo un iniziale assorbimento di liquidi e
sostanze a basso peso molecolare (acqua, ioni,
lipidi, ecc.), si verifica l’adsorbimento di proteine;
il tipo di proteine e le modalità di adsorbimento
determinano i successivi eventi temporali di
risposta dell’organismo umano al dispositivo
impiantato.
Interazione materiale - ambiente biologico
Adesione batterica
Nella comprensione dei fenomeni di adesione batterica a
biomateriali, occorre tenere presenti le seguenti considerazioni:
• I processi di integrazione tissutale e di adesione batterica sono
paralleli dal punto di vista biochimico, possono essere competitivi e
anche mutuamente esclusivi.
• Le superfici ben colonizzate da cellule vitali tendono ad essere
resistenti alle infezioni, mentre le colonie batteriche una volta
stabilizzate sulla superficie del biomateriale, distruggono i tessuti e
sono resistenti agli antibiotici e ai meccanismi di difesa del corpo
umano
• I processi di adesione o di integrazione per i batteri e le cellule dei
tessuti sono basati su simili meccanismi molecolari
Interazione materiale - ambiente biologico
Adesione batterica
Le infezioni coinvolte con biomateriali richiedono,di
regola, il reintervento e possono portare a amputazioni,
osteomieliti o persino morte. Si pensi poi che i cateteri
intravenosi e i dispositivi urologici di durata superiore ai
pochi giorni spesso vanno incontro a infezioni o causano
infezioni secondarie nei tessuti adiacenti.
L’infezione attorno ai biomateriali e ai tessuti danneggiati
è causata proprio dall’adesione batterica a queste
superfici.
EPIDEMIOLOGIA
Negli USA 750000 ernioplastiche / anno
Infezioni 1-2%
7500 – 15000 casi
Deysine 1998
EPIDEMIOLOGIA
Probabilità di infezione di protesi ortopediche
• 1% per anca e spalla
• 2% ginocchio
percentuali probabilmente
sottostimate ( alcune perdite asettiche possono essere
causate da infezioni non diagnosticate )
Zimmerli 2004, Winder 2001
FONTI DI INFEZIONE
Ambiente della Sala Operatoria
Cute del paziente
Chirurghi
Endogena?
FONTI DI INFEZIONE
Ambiente della Sala Operatoria
In un minuto una persona disperde nell‘ambiente
circa mille batteri tramite la respirazione, i
movimenti e la traspirazione.
Di conseguenza la carica batterica in sala
operatoria aumenta proporzionalmente al numero
delle persone presenti ed alla durata
dell’intervento.
Noble 1975.
FONTI DI INFEZIONE
Cute del paziente
Inadeguata preparazione preoperatoria
Inadeguata antisepsi del campo operatorio
FONTI DI INFEZIONE
Chirurghi
Inadeguato lavaggio
Rottura di guanti
Infezioni vie aeree
FONTI DI INFEZIONE
Endogena?
Disseminazione di batteri per via ematogena da
un altro sito d’infezione (denti, vie urinarie,
cute, intestino, tratto genitale, ecc.).
EZIOLOGIA
Contaminanti di strumenti e presidi medici
Valvole cardiache meccaniche
S. aureus e S. epidermidis
Protesi vascolari
Cocchi Gram-positivi
Dispositivi ortopedici
S. aureus e S. epidermidis
Protesi di vari organi
S. aureus e S. epidermidis
EZIOLOGIA
PROTESI ANCA
Numero totale di microrganismi isolati
Cocchi Gram positivi
Stafilococco Aureo
Stafilococco coagulasi negativo
Enterococco
Streptococco
Altri Cocchi Gram positivi
Cocchi Gram negativi
Bacilli
Bacilli
Bacilli
Bacilli
Gram positivi
Gram negativi, enterobatteri
Gram negativi, non enterobatteri
anaerobi
Altri batteri
Funghi, parassiti
695
73.8 %
44.3 %
15.1 %
11.8 %
2.0%
0.6 %
0.0 %
1.4 %
9.8 %
7.5 %
0.7 %
6.5 %
0.3 %
Mongardi 2008
Classificazione delle infezioni di protesi ortopediche in
accordo con l’inizio dei sintomi dopo l’impianto
Infezione precoce ( < 3 mesi )
Acquisita prevalentemente durante l’impianto o nei giorni
immediatamente successivi e causata da microorganismi molto
virulenti
Infezione ritardata o infezione a basso grado ( 3-24 mesi )
Acquisita prevalentemente durante l’impianto e sostenuta da
microorganismi meno virulenti
Infezione ematogena ( > 3 mesi )
Zimmerli 2004
PATOGENESI
La patogenesi delle infezioni di protesi
aiuta a comprendere
il perché i segni e sintomi di infezione
risentono nel breve periodo del trattamento antibiotico,
ma recidivano rapidamente dopo la sospensione.
Gli elementi patogenetici fondamentali sono:
La produzione di Slime
Formazione del Biofilm
Mongardi 2008
PATOGENESI
Slime o Glicocalice
Sostanza amorfa polisaccaridica extracellulare prodotta
da molteplici specie di batteri
Molti ricercatori considerano lo slime come un fattore di
virulenza
Riduce la chemiotassi e l’opsonizzazione dei
granulociti neutrofili
Blocca la penetrazione degli antibiotici verso le
cellule batteriche
Promuove l’adesione cellulare e cattura i nutrienti
PATOGENESI
Slime o Glicocalice
Favorisce l’attecchimento dei batteri alle superfici in
ambienti acquatici o alle superfici di tessuti di piante e
animali
Responsabile della formazione di Biofilm
PATOGENESI
BIOFILM
I bioflilm sono costituiti da microcolonie di
cellule batteriche adese a una superficie e
incapsulate in una matrice polisaccaridica
adesiva (glicocalice) secreta dalle cellule
stesse
Rappresentano un modello di comunità
organizzata che permette ai suoi costituenti di
resistere ad aggressioni da parte di elementi esterni
ed interni come gli antibiotici e la risposta
immunitaria
PATOGENESI
Biofilm
All’ interno del biofilm i batteri:
Si organizzano in una complessa comunità che funziona
come un organismo multicellulare.
Entrano in una fase stazionaria di crescita e vengono protetti
dalla azione degli antibiotici.
.
PATOGENESI
Come si forma un Biofilm
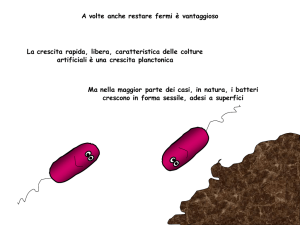
La crescita rapida, libera, caratteristica delle colture
artificiali è una crescita planctonica
Ma nella maggior parte dei casi, in natura, i batteri
crescono in forma sessile, adesi a superfici
PATOGENESI
Come si forma un Biofilm
In presenza di superfici umide a cui aderire molti
microrganismi si organizzano in biofilm
Qualunque superficie immersa è un substrato ideale per la
colonizzazione microbica perché vi si adsorbono i nutrienti
grazie alla tensione superficiale che li spinge all’interfaccia
PATOGENESI
Come si forma un Biofilm
Nei primi minuti, sulla superficie immersa si adsorbe un
monostrato di sostanza organica (polisaccaridi e proteine)
che favorisce l’attacco di batteri planctonici
Il primo adsorbimento dipende da cariche elettriche
superficiali, forze di Van der Waals e attrazione
elettrostatica, se l’associazione persiste abbastanza a lungo
l’adsorbimento si trasforma in un attacco permanente e
irreversibile
PATOGENESI
Come si forma un Biofilm
L’ adesione dei batteri
alla superficie dipende:
Proteine di superficie del batterio
AtlE
SSP1 – SSP2
CflA – CflB
AAP
BAP
Bhp
Acidi teicoici
Tipo e dalla natura del dispositivo
Trattato o non
Con rivestimento idrofilo o idrofobo
Presenza di microfratture e microcavità
PATOGENESI
Come si forma un Biofilm
Attacco dei batteri alle proteine dell’ospite
Proteine dell’ospite
Fibrinogeno
Fibronectina
Vitronectina
Fattore Von Willebrand
Albumina
Proteine di superficie di S.aureus
Adesine proteiche della famiglia
MSCRAMM
Microbial surface components recognizing
adhesive matrix molecules
Proteina legante il
Fibrinogeno
Proteina legante la
Fibronectina (FnBPA –
FnBPB)
Proteina legante il Collagene
(Cna)
Fattori agglutinanti(CflA – CflB)
PATOGENESI
Come si forma un Biofilm
I batteri iniziano a moltiplicarsi e formano
microcolonie
Nello stadio finale dell’adesione irreversibile sono
prodotte le “sostanze polimeriche extracellulari”
(EPS) formate in prevalenza da zuccheri
All’interno del biofilm le microcolonie crescono e
le EPS fanno da supporto per l’attacco di altre
specie microbiche
PATOGENESI
Come si forma un Biofilm
La formazione del biofilm è un processo molto complesso,
in cui interviene un particolare tipo di regolazione densità
dipendente:
il “QUORUM SENSING”
regolazione dell’espressione genica in risposta alle
fluttuazioni della densità di popolazione mediante la
percezione di una concentrazione soglia di una molecola
segnale (chiamata autoinduttore).
La comunicazione tra le cellule è un fattore cruciale per lo
sviluppo del biofilm
Le principali molecole segnale sono composti chemiotattici
costituiti da lattoni acilati di omoserina o da peptidi.
PATOGENESI
Come si forma un Biofilm
Adesione
Interazioni chimico-fisiche
Proteine di membrana,
Flagello…
Colonizzazione
Pili,
Polisaccaridi (alginato),
Fattori di aggregazione
cellulare (curli, ecc.)
Maturazione
EPS: produzione/organizzazione
Quorum sensing
Costerton 2002
PATOGENESI
Come si forma un Biofilm
La stuttura di un biofilm maturo è molto complessa:
Le microcolonie sono organizzate in agglomerati microbici interrotti da
canali per il passaggio dell’acqua per apporto di nutrienti ed eliminazione
delle scorie
Lo stato metabolico delle cellule nella microcolonia non è uniforme:le
cellule più interne sono più piccole e metabolicamente meno attive di quelle
superficiali
Lungo il biofilm maturo si formano dei ”nastri” e le cellule superficiali si
staccano con parte del materiale della matrice
BIOFILM
RESISTENZA AGLI ANTIBIOTICI
I batteri, sotto forma di biofilm, sono 10-1000
volte più resistenti al trattamento antibiotico
rispetto al fenotipo planctonico.
Gli antibiotici attualmente disponibili agiscono
contro il fenotipo planctonico della cellula
batterica e non contro il biofilm.
BIOFILM
MECCANISMI DI RESISTENZA AGLI ANTIBIOTICI
Crescita lenta per
cambiamenti
chimico-fisici
nel biofilm
Crescita lenta
per riduzione
di nutrienti
Sviluppo di un
fenotipo biofilm
specifico
Barriera
meccanica
Nel biofilm possono esprimersi meccanismi di resistenza diversa
Cellule superificiali
Protette dallo SLIME
Cellule intermedie
Crescita rallentata
Cellule più profonde
Esprimono un fenotipo biofilm specifico
BIOFILM
MECCANISMI DI RESISTENZA AL SISTEMA IMMUNITARIO
(A) I batteri planctonici possono
essereeliminati da anticorpi,
fagociti eantibiotici.
(B) Le cellule batteriche formano
biofilms preferenzialmente su
superfici inerti; queste comunità
sessili sono resistenti ad
anticorpi, fagociti ed antibiotici.
(C) I fagociti sono attratti dai
biofilms. La fagocitosi non
avviene, ma gli enzimi della
fagocitosi sono rilasciati.
(D) Gli enzimi della fagocitosi
danneggiano il tessuto intorno al
biofilm e batteri planctonici sono
rilasciati dal biofilm. Il rilascio
causa la disseminazione e
l’infezione acuta nei tessuti
circostanti.
FATTORI DI RISCHIO
legati all’intervento
legati alle caratteristiche
del paziente
Mantenimento della temperatura
corporea
Durata dell’intervento
Natura e struttura del biomateriale
Presenza di materiale estraneo nel sito
chir.
Tecnica Chirurgica (emostasi, trauma
tissutale ecc.)
Presenza drenaggio chirurgico
Età
Diabete
Uso di nicotina
Somministrazione di steroidi
Malnutrizione
Obesità: 20% superiore al peso ideale
Prolungata degenza pre oper.
Colonizzazione delle narici con
staphylococcus aureus
NATURA E STRUTTURA DEL BIOMATERIALE
Idrofilia
Materiali idrofobi (es. PFTE espanso) più resistenti alle infezioni di
materiali idrofili (es. polipropilene)
Deysine 1998
Irregolarità di superficie
Adesività batterica maggiore per materiale intrecciato rispetto al
monofilamento
Klinge 2002
PRESENZA DI MATERIALE ESTRANEO NEL SITO
CHIRURGICO
Attivazione della risposta fagocitaria condizionata da taglia, composizione e
densità del materiale presente:
Per particelle di piccola taglia ( 0.1 – 15 μm) attività fagocitaria proporzionale
alla quantità delle particelle
Per particelle più grandi (> 15 μm ) i fagociti si aggregano a formare
granulomi (fagocitosi frustrata)
Zimerli 1982
In tali circostanze si può osservare inibizione della attività battericida dei
fagociti
Zimmerli 1984 Bernard 2005, 2007
TECNICA CHIRURGICA
La presenza di tessuto necrotico o di ematomi costituisce un
ottimo pabulum per i batteri
Deysine 1998
Prevenzione
Dal momento che l’infezione di qualunque dispositivo
protesico comporta spesso l’indicazione alla rimozione, la
prevenzione delle infezioni è un obiettivo primario
-
appropriate misure di controllo delle infezioni
attenta tecnica chirurgica
profilassi antibiotica
materiale impregnato di antibiotico o antibatterico
Prevenzione
Appropriate misure di controllo delle infezioni
Attenta tecnica chirurgica
• Le misure di prevenzione sono determinanti per
contenere le infezioni
• Il mancato rispetto delle misure di prevenzione
può annullare l’efficacia della profilassi
antibiotica
• La profilassi antibiotica affianca e completa la
buona pratica chirurgica NON LA SOSTITUISCE
Prevenzione
ANTIBIOTICOPROFILASSI
PERIOPERATORIA
• Ha lo scopo di impedire che i
batteri venuti a contatto con il
campo operatorio si annidino nel
sito chirurgico e/o aderiscano al
materiale protesico
• L’uso profilattico degli
antibiotici nei reparti chirurgici
riguarda il 40-50% degli
antibiotici prescritti
• L’uso indiscriminato di tali farmaci
aumenta la prevalenza
di batteri antibiotico-resistenti
• Predispone alle infezioni ( es.colite
da clostridium difficile )
FATTORI CHE CONDIZIONANO LA
SCELTA DELL’ANTIBIOTICO A
SCOPO PROFILATTICO
• I batteri responsabili delle infezioni del sito
chirurgico
• La sede dell’intervento
• Le caratteristiche farmacocinetiche
dell’antibiotico
• La presenza di eventuali allergie ad antibiotici
• La tossicità intrinseca del farmaco e le sue possibili
interazioni
• L’efficacia dimostrata in studi clinici controllati
• Gli effetti sull’ecosistema
• Il costo
Prevenzione
Profilassi antibiotica in conclusione…
• Somministrarla al momento della induzione della anestesia per via venosa
• Utilizzare il dosaggio massimo consentito per singola dose
• Mantenere i livelli terapeutici sierici e tissutali per tutta la durata
dell’intervento ( somministrare una dose intraoperatoria in caso di
prolungamento dei tempi di intervento o abbondante sanguinamento )
• In caso di inserimento di materiale protesico non proseguire la
somministrazione oltre le 24 ore dall’incisione
Prevenzione
Profilassi antibiotica
Non tutti d’accordo
Perez AR, Roxas MF, Hilvano SS
A randomized, double-blind, placebo-controlled trial to
determine effectiveness of antibiotic prophylaxis for
tension-free mesh herniorrhaphy.
J Am Coll Surg. 2006 Jul;203(1):138-9.
Prevenzione
Ricoprire la protesi con sostanze capaci di neutralizzare l’adesione
delle cellule al substrato
Rivestire la protesi con sostanze chimiche capaci di inattivare i geni
che regolano la sintesi della matrice polisaccaridica extracellulare
del biofilm
Inibire la sintesi di molecole che servono da “segnale” per la
comunicazione intercellulare
Prevenzione
Materiale impregnato di antibiotico o antibatterico
Cemento impregnato di antibiotico
Trippel 1986
Reti di e-PTFE-polipropilene impregnate di clorexidina
Carbonell 2005, Cobb 2006
Suture varie impregnate di clorexidina
Harnet 2009
Suture rivestite di antibiotico (polyglactin 910 e Poliglecaprone 25 con
triclosan).
Edmiston 2006, Ming 2007, Fleck 2007, Rozelle 2008
Prevenzione
PROSPETTIVE FUTURE
Uso dei furanoni sostituiti ?
• Isolati da Delisea pulchra, un’alga rossa resistente
all’attacco dei biofilm.
• Questi composti sono simili ai lattoni acilati
dell’omoserina.
• I furanoni sostituiti si legano alle cellule
batteriche nei siti normalmente usati dalle
molecole di segnalazione e impediscono
l’emissione dello stimolo a formare biofilm
CONSIDERAZIONI CONCLUSIVE
Le infezioni dei biomateriali rappresentano uno
dei problemi principali dei programmi di controllo delle
infezioni in ambito assistenziale
L’ incidenza degli eventi è bassa, ma il crescente utilizzo di
biomateriali rende ragione dell’elevato numero assoluto di
queste infezioni
Le conseguenze sono spesso molto gravi, quindi la corretta
gestione e soprattutto la prevenzione sono elementi
fondamentali del controllo
Il rispetto delle misure di prevenzione delle infezioni in
ambito chirurgico, una buona tecnica chirurgica,la rigorosa
applicazione dei principi della profilassi antibiotica, la
conoscenza della epidemiologia e delle modalità di diffusione
dei germi interessati, l’utilizzo di materiali sempre più
affidabili sono, al momento, i passaggi obbligati di questo
percorso