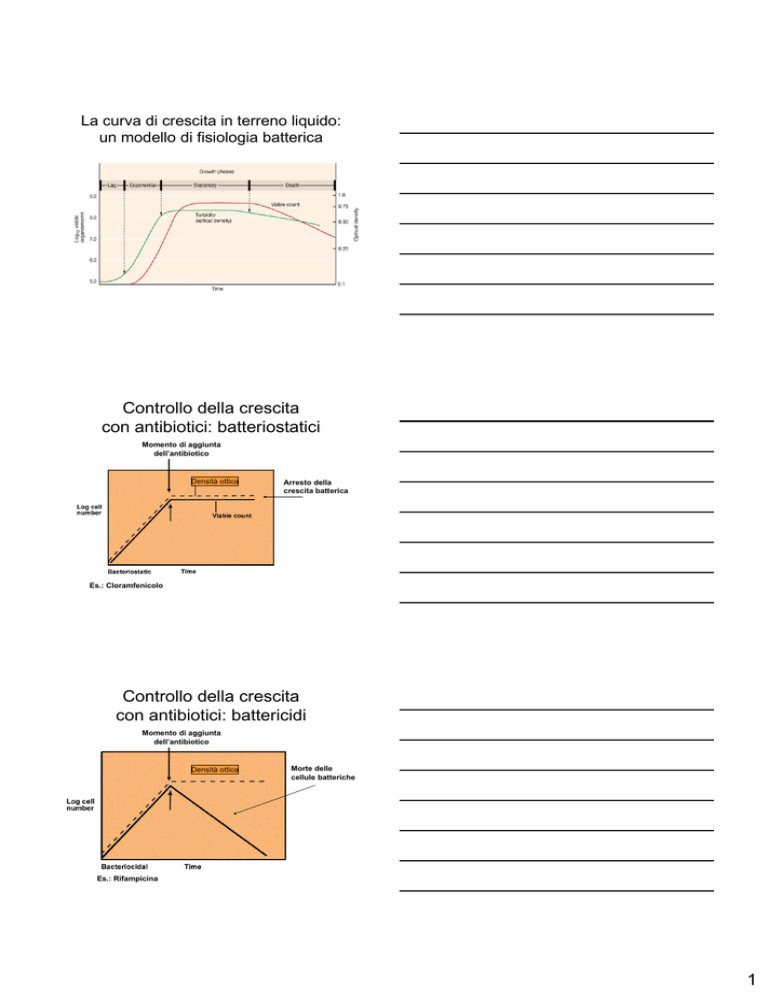
La curva di crescita in terreno liquido:
un modello di fisiologia batterica
Controllo della crescita
con antibiotici: batteriostatici
Momento di aggiunta
dell’antibiotico
Densità ottica
Arresto della
crescita batterica
Es.: Cloramfenicolo
Controllo della crescita
con antibiotici: battericidi
Momento di aggiunta
dell’antibiotico
Densità ottica
Morte delle
cellule batteriche
Es.: Rifampicina
1
Controllo della crescita
con antibiotici: batteriolitici
Momento di aggiunta
dell’antibiotico
Densità ottica
Lisi delle cellule
batteriche
Es.: Ampicillina
INIBIZIONE DA ANTIBIOTICI DELLA CRESCITA BATTERICA SU PIASTRA
INIBIZIONE DA ANTIBIOTICI DELLA CRESCITA BATTERICA SU PIASTRA
2
Meccanismo d‘azione
degli antibiotici
• Generalmente inibitori di sintesi macromolecolari
come la trascrizione (es. Rifampicina), la sintesi
proteica (es. Tetraciclina), e la biosintesi della
parete cellulare (es. Penicilline)
• „Antimetaboliti“: bloccano la sintesi dei „mattoni“
necessari ad una o più sintesi macromolecolari.
Es. Inibitori dell‘acido folico (Trimetoprim,
sulfamidici). L‘acido folico è un fattore di crescita
direttamente implicato nella sintesi delle purine e
di alcuni aminoacidi.
Bersagli degli antibiotici
• Generalmente gli antibiotici legano con alta
affinità enzimi essenziali per la cellula
(Rifampicina>>RNA polimerasi; acido
fusidico>>EF-G; Penicilline>>transpeptidasi)
• Possono legare acidi nucleici
(actinomicina>>DNA
cloramfenicolo>>rRNA 23S, inibendo peptidiltrasferasi)
• Possono legare substrati enzimatici
(vancomicina>>dipeptide D-ala-D-ala)
Es. tetraciclina
Es. Penicilline
(degradazione
dell‘anello blattamico)
Iperproduzione dell‘
enzima bersaglio
Es. Trimetoprim
Es. Streptomicina (metilazione 16S)
Rifampicina (mutazioni nel gene rpoBsubunità b dell‘RNA polimerasi)
3
Meccanismi di Resistenza
• Impossibilità per l’antibiotico di entrare nella
cellula
– Impenetrabilità “intrinseca”: es. Membrana esterna
dei Gram –
– Mutazioni che riducano l’entrata tramite trasporto
attivo
• Pompe di efflusso (espulsione dell’antibiotico)
• Inattivazione dell’antibiotico
– Degradazione enzimatica o “sequestro”
• Mutazioni della proteina bersaglio
• Iperproduzione della proteina bersaglio
La sensibilità agli antibiotici può variare
molto all’interno di una stessa specie
Le condizioni di “crescita” batterica
differiscono molto tra natura e lab
In laboratorio: tempo di duplicazione del
batterio Escherichia coli: 20-100 min
Nell’ambiente esterno: tempo di
duplicazione 2-3 giorni (???)
Nell’ospite (es. tratto intestinale di
mammifero): tempo di duplicazione 6-12
ore (???)
4
Condizioni di crescita batterica nell’ecosistema
Comunità multispecie,
adese a superfici solide
Condizioni indefinite
Fluttuazioni nella temperatura
limitazione in sostanze nutritive
(oligotrofia)
Radiazioni UV
Composti tossici
predazione…
Stato di stress cellulare
(Laboratorio: colture pure in condizioni “ottimali” )
Biologia dei biofilm
...
J. Bacte riol. 25, 277-286 (19 33)
aus C. E . Zo bell: "The effe ct o f sur faces on bacterial activity", J. Bacterio l. 46, 39 -56 (1943)
BIOFILM
Comunita‘ ben strutturata
di batteri e cellule eucariotiche
racchiuse in una matrice polimerica
prodotta dalle cellule stesse, e che cresce su
superfici (inerti o „biologiche“), soprattutto
all‘interfaccia con una fase liquida
5
Un caso “reale” di biofilm come osservato
in microscopia elettronica
Adesione
Interazioni fisico-chimiche
(idrofobicità, carica elettrica)
Flagello
Proteine di membrana
esterna,
parete cellulare, LPS…..
Colonizzazione
Maturazione
Pili
“Capsula” o EPS
Polisaccaridi (alginato)
Meccanismi di segnalazione
Fattori di aggregazione cellulare intercellulare e interspecie
(curli, ecc…)
Importanza dei biofilm microbici
• Biofilm come fattore di virulenza: infezioni da
biofilm più virulente, più tendenti a
cronicizzarsi e più resistenti alle terapie
• Batteri adesi ad una superficie solida o
“flocculati” sono utilizzati preferenzialmente in
bioreattori industriali e nella depurazione
delle acque di scarico
• I biofilm sono ubiquitari
6