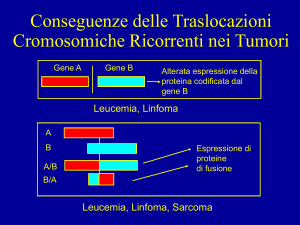
ANIMALI TRANSGENICI
• Per animali transgenici si intendono quegli
animali ottenuti attraverso una manipolazione
del genoma, inserendo uno o più geni,
appartenenti alla stessa specie, o più spesso
ad altre specie.
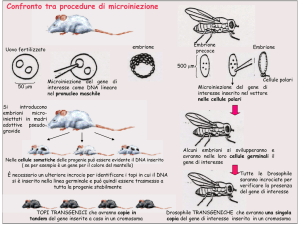
MICROINIEZIONE DI DNA
• INIEZIONE DI DNA nel pronucleo maschile di un oocita
appena fecondato. Più precisamente, si depositano con una
microsiringa 1-2 picolitri di DNA che contengono circa 100200 copie del gene da inserire. A monte del gene(cDNA) da
trasferire nel pronucleo si utilizza una sequenza promotore
che conferisce al gene la specificità di espressione in un
particolare tessuto
MICROINIEZIONE DI DNA
E PRODUZIONE DI TOPI TRANSGENICI
• Il gene inserito viene integrato nel genoma della cellula
uovo che viene trapiantata in una madre adottiva , che
darà origine alla nascita di un topino “chimera” ( mosaico
di cellule con patrimoni genetici diversi). Nella fase
successiva si effettua un incrocio riproduttivo tra il topino
chimera e un topo normale con la nascita di topini con i
nuovi geni ma eterozigotici ; solo nell’incrocio successivo
tra i precedenti avremo la nascita di topini omozigotici
per il gene introdotto
MICROINIEZIONE DI DNA E PRODUZIONE DI TOPI
TRANSGENICI
Dennis Roop and c-Myc
Myc è un oncogene che attiva la trascrizione
dei geni di stimolo di sviluppo;quando viene
espresso altera la funzione usuale dello
sviluppo e della proliferazione di controllo
delle cellule
Studio del ruolo di c-Myc nella carcinogenesi
•
•
•
•
Creazione di topi transgenici
Inserimento di c-Myc umano in topo
Overexpression di c-Myc nell’epidermide
Risultati esperimento:
-aumento di crescita cellulare
-inibizione della differenziazione
TOPI KNOCK–OUT
• I topi knock–out sono divenuti molto utili nel contribuire a
capire il genoma umano ed il relativo ruolo nelle malattie.
Generando un knock-out è stato dimostrato che è possibile
mirare l’inserimento del gene in una posizione precisa del
genoma del topo; ciò dà la possibilità di eliminare un gene
specifico con un allele inattivo o mutato. Di conseguenza gli
animali Knock-out sono considerati una tecnica investigativa
che tiene conto dell’eliminazione di un gene in particolare, nel
tentativo di definire che effetto ha nell’organismo
CLONAGGIO DEL DNA
PLASMIDI
I Plasmidi sono elementi genetici extracromosomici che si replicano nelle cellule
batteriche autonomamente. Il loro DNA è
circolare e a doppia elica.I plasmidi usati negli
esperimenti di clonaggio derivano tutti da
plasmidi trovati in natura che sono stati
“ingegnerizzati” in modo da presentare
caratteristiche che facilitino il clonaggio di
geni. I più usati sono i plasmidi di E.Coli.
Caratteristiche dei plasmidi
•
•
•
Una sequenza ORI che permette al plasmide di replicarsi nelle cellule di
E.Coli in quanto viene riconosciuta dagli enzimi di replicazione della
cellula ospite
Deve avere un marcatore selettivo, che renda le cellule di E.Coli
contenenti il plasmide, facilmente distinguibili dalle cellule che non lo
contengono; uno dei marcatori più usati è il gene amp che conferisce
la resistenza all’ampicillina
Deve avere anche un sito di taglio per un enzima di restrizione in modo
che lo si possa aprire per inserire il frammento di DNA esogeno
INSERIMENTO DEL DNA DA CLONARE
CELLULE ES
• Le cellule ES sono cellule embrionali totipotenti, infatti
possono dare origine a cellule di tessuti differenti. Le cellule
ES vengono prelevate dalla massa cellulare interna della
blastocisti(cellula embrionale indifferenziata) e mantenute
in coltura in presenza di cellule o fattori che ne impediscono
il differenziamento. In queste condizioni le cellule ES
mantengono intatta la loro capacità di differenziarsi in modo
appropriato in qualunque tessuto, una volta reintrodotte in
un embrione
RICOMBINAZIONE OMOLOGA
INIEZIONE DEL DNA RICOMBINATO
• Le cellule staminali che hanno integrato nel loro genoma il
DNA ricombinato, vengono iniettate in un embrione isolato in
stadio precoce di sviluppo.
• L’embrione precoce, composto parzialmente da cellule ES,
viene introdotto nell’utero di una femmina pseudogravida.
• Il topo “chimera” che si sviluppa da questo embrione conterrà
alcune cellule somatiche portatrici del gene alterato e
conterrà anche cellule della linea germinale che portano il
gene modificato.
TOPO CHIMERA INCROCIATO CON TOPO NORMALE
1. Il topo “chimera” verrà incrociato con un topo normale e alcuni
discendenti (2 su dieci) avranno un gene modificato in tutte le loro
cellule ( eterozigosi).
2. Incrociando tra loro questi topi portatori del gene modificato si
ottiene qualcuno dei discendenti contenente 2 geni alterati in tutte
le sue cellule (omozigosi ).
3. Se l’alterazione genica originale inattiva completamente la
funzione genica si avranno allora dei topi ad “eliminazione” (Knockout) cioè ceppi di topi che hanno un certo gene inattivato
definitivamente.
TECNICA KNOCK - OUT
USO DEL KNOCK-OUT NELLA COLORAZIONE DEL
PELO DI TOPO
•
Le cellule ES utilizzate hanno uno “STRAIN” con pelo di colore bianco
Dopo che tali cellule sono state inserite in una blastocisti, esse si divideranno in molti tessuti
differenti. Se il risultato è un topo che il pelo con macchie bianche e macchie nere vuol dire
che l’iniezione di cellule ES è riuscita. Dopo l’individuazione dei topi che hanno avuto
contributi da entrambi i tipi di cellule, si ha la trasmissione della germ-line per cui
dall’incrocio di questi topi eterozigoti con il pelo a chiazze avremo la nascita di topi Knock-out
con il pelo nero ( quindi genotipo omozigote)
TECNICA “CONDITIONAL KNOCK-OUT”
• Lo scopo dei Knock-out condizionali è
eliminare un gene in un tessuto, in un organo
o in una fase particolare di sviluppo.
• VANTAGGI:
-topi Knock-out conditional sopravvivono più a lungo
-i metodi sono anche più precisi
Il sistema di Recombinase Cre-Lox
•
•
Metodo knock-out conditional piu’ usato.
Si basa sull’azione del recombinase che è un enzima che funziona come
le forbici tagliando un frammento di DNA inserito fra due siti LOX
recombinase specifici. Poiché questo enzima è espresso soltanto in
determinati tipi cellulari, il gene designato sarà eliminato soltanto da
tali cellule. Quindi questa metodica è basata su un’inattivazione
tessuto-specifica del gene bersaglio. In una prima fase avviene la
descrizione del luogo d’interesse :il frammento di DNA compreso tra
siti Lox. Successivamente avviene la costruzione del vettore bersaglio,
la ricombinazione omologa in cellule ES, l’iniezione nell’embrione ad
uno stadio precoce e la generazione del topo chimera. Quest’ultimo,
contenete i siti Lox recombinase-specifici, verrà incrociato con un topo
CRE positivo, cioè che esprime l’enzima recombinase in un tessuto
specifico. L’espressione tessuto-specifica del recombinase permette
l’inattivazione del gene d’interesse soltanto nel tessuto in cui la
recombinase è espressa.
KO costitutivi
Il limite principale dei
topi transgenici KO
per un gene e’ la possibile
mortalita’ degli omozigoti
durante lo sviluppo.
Soluzione : l’induzione della
mutazione
tempo e tessuto specifica
KO condizionali
Il sistema cre-lox
Sistema che è alla base:
meccanismo di ricombinazione del fago P1 con i siti Lox e la ricombinasi Cre.
Si possono ottenere dei mutanti che perdono la regione voluta solo attivando la
ricombinasi Cre.
Si devono costruire dei vettori con la regione genetica da eliminare con siti Lox
all’esterno
Con questa strategia si possono ottenere topi transgenici per geni che sono letali
in fasi diverse e soprattutto con l’espressione della ricombinasi Cre tessuto
specifica, si può far avvenire il knock-out del gene solo in particolari tessuti dove
si esprime o dove si induce Cre.
SISTEMA CRE-LOX
Sistema di RICOMBINAZIONE del fago P1
CRE: ricombinasi specifica (permette la ricombinazione tra siti Lox)
cyclization recombination
LoxP: locus di crossover (2 seq palindrome di 13bp + regione centrale di 8nt)
locus of X-over P1
Cre
LoxP “attira” la ricombinasi CRE la quale ricombina le seq di DNA adiacenti
INVERSIONE
DELEZIONE
a
b
a
c
c
Ma puo’
revertire!
Non utilizzato
per topi
transgenici
c
palindrome
tandem
a
b
b
a
d
c
INTEGRAZIONE
a
b
c
b
scambio su cromat. fratelli
a
a
c
-DELEZIONE se sono in tandem
-INVERSIONE se sono palindrome
b
a
b se c’è
c
-INTEGRAZIONE
un elemento
in un plasmide, e l’altro nelle seq
di integrazione
a
c
b
c
G418
UTILIZZO SISTEMA CRE-LOX
siti LoxP derivano da fago P1 (non esistono nel genoma animale/vegetale)
quindi non possibilità di ricombinazione in altri siti del genoma
Il SISTEMA Cre-LoxP permette il controllo dell’espressione genica
nello SPAZIO e nel TEMPO
Utilizzo di un PROMOTORE
TESSUTO SPECIFICO
Utilizzo di un PROMOTORE
-dipendente dallo STADIO di SVILUPPO
-INDUCIBILE
DELEZIONE
di un GENE TESSUTO SPECIFICA
Promotore
attivo in cellule
nervose
(spazio)
ESPRESSIONE
di un GENE TESSUTO SPECIFICA
(spazio)
DELEZIONE/KO programmabile
Espressione di Cre
regolata nel TEMPO/SPAZIO
ESPRESSIONE/K-IN programmabile
Espressione di Cre
regolata nel TEMPO/SPAZIO
ESPRESSIONE/DELEZIONE
di un GENE INDUCIBILE (tempo/spazio)
Sono state prodotte proteine di fusione tra Cre e ER(T) (recettore estrogeni)
La ricombinasi è confinata nel citoplasma finche’ non viene somministrato
l’ormone sintetico (TAMoxifene) che riconosce il recettore e fa traslocare la
proteina di fusione con la ricombinasi nel nucleo dove induce la delezione del
frammento incluso tra i due siti LoxP
tempo
spazio
SISTEMA
TET-ON/TET-OFF
Sistema che deriva da
Operone Tet E.Coli
(se c’è tetraciclina, si attivano
geni per la resistenza alla Tc)
Sistema a 3 elementi:
La Tc SPEGNE
il GENE
TeT-Repressor: repressore
della trascrizione
Tc/Dox: tetraciclina
TRE: tetracycline response element
Versione mutata
di TetR
La Tc ACCENDE
il GENE
La Tc SPEGNE
il GENE
La Tc ACCENDE
il GENE
TRASFERIMENTO DEL NUCLEO clonazione
Il trasferimento nucleare è una tecnica che
permette di sostituire il genoma di una cellula
con quello derivante da un'altra.
Viene utilizzata per generare animali clonati
partendo da cellule di un individuo adulto.
Wilmut e collaboratori 1997
Sheep cloned by nuclear transfer from
a cultured cell line.
1)
2)
3)
4)
5)
Si allontana il NUCLEO di un ovulo
Si coltivano le cellule epiteliali adulte (G0)
Si fondono nucleo G0 + ovulo enucleato
Uovo rinucleato in crescita in coltura/ovidotto
Embrione si impianta nella madre adottiva
Pecora Dolly: prima dimostrazione della TOTIPOTENZA
del nucleo di una cellula di individuo adulto differenziata
2
1
3
4
Con la tecnica del TRASFERIMENTO del NUCLEO
di CELLULE SOMATICHE
(SCNT)
si creano dei CLONI
In Natura: CLONE GEMELLI identici
in seguito a riproduzione sessuale
stesso DNA mitocondriale
In Laboratorio: CLONE chi dona il nucleo/chi riceve il nucleo
utilizzo tecnica SCNT
DNA mitocondriale differente
CLONAZIONE per TRASFERIMENTO NUCLEARE: efficienza bassissima!
434 oociti
1 pecora
29 embrioni
IL NUCLEO DI UNA CELLULA SOMATICA ADULTA E’ STATO RIPROGRAMMATO
ORIGINANDO UN INDIVIDUO ADULTO.
GLI ANIMALI CLONATI…SONO SANI???
Utilizzo di YAC per produrre TOPI TRANSGENICI
1995 Lamb e Gearhart
YAC (Yeast Artificial Chromosome)
x produzione di topi transgenici
UTILIZZATI per TRASFERIRE GENI di grandi dimensioni
300-1000Kb
COME SI TRASFERISCE uno YAC nel TOPO?
1) Fusione di SFEROPLASTI (cellule Lievito senza parete) + cellule ES
(rischio di
contaminazione con genoma Lievito)
2) Purificazione di YAC (separato per elettroforesi) + microiniezione nel pronucleo
(se YAC non ha dimensioni grandi, altrimenti si frammenta)
3) Trasferimento di YAC nelle ES tramite LIPOSOMI(vescicole lipidiche artificiali per fusione con
membrana)