INTEGRAZIONE DEL
METABOLISMO
Metabolismi specifici: il fegato, il tessuto
adiposo, il muscolo scheletrico e il cervello.
Negli organismi pluricellulari e quindi anche
nell'uomo, al quale faremo riferimento, ogni
tessuto svolge le vie metaboliche studiate in
maniera specifica. Vi è quindi una "divisione del
lavoro metabolico" che sarà poi integrato e
coordinato dall'azione degli ormoni adrenalina,
glucagone ed insulina, che tratteremo a parte.
Riserve energetiche
Composizione dell’organismo e delle riserve energetiche in un soggetto umano
normale di 70 Kg
Tipo di
substrato
tessuto
Peso (Kg)
% del peso
corporeo
Valore calorico (Kcal)
LIPIDI
Tessuto adiposo
11-17
15-25
100.000-150.000
PROTEINE
Tessuto muscolare
(principalmente)
8-12
12-17
32.000-48.000
Carboidrati
Fegato (glicogeno)
0.07
<1
280
Muscolo (glicogeno)
0.2
<1
800
Sangue (glucosio)
0.02
<1
80
Tipo di substrato
Peso (Kg)
Glucosio
Acidi grassi liberi
triacilglicerolo
0.02
0.0003
0.003
Valore calorico
(Kcal)
80
3
30
L’energia
totale
immediatamente disponibile
dal plasma è estremamente
bassa e basta per circa 80 min
di metabolismo basale (1800
Kcal/giorno)
Protein
synthesis
DIETA
grassi
carboidrati
aminoacidi
glucosio
glicerolo acidi grassi liberi
Depositi
di glicogeno
+Ins
Depositi
di grassi
+Ins
-Cort
+GH
+Adrenal
+Glucag
-Ins
Pool di acidi
grassi liberi
Proteine
del
corpo
Pool di
glucosio
+Ins
-GH
Metabolismo della maggior parte dei tessuti
+GH
+Adren
+Gluca
+Cort
+T3
+GH
+Gluca
+Cort
-Ins
+Cort
+Gluca
+Ins
+GH
+Test
-Cort
Pool di
aminoacidi
Metabolismo del cervello
Aspetti generali
La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive
all’assunzione di un pasto. Durante questo intervallo si verifica un transitorio
aumento del livello ematico del glucosio, degli amminoacidi e dei triacilgliceroli,
che si trovano principalmente nei chilomicroni sintetizzati dalle cellule della
mucosa intestinale. Il tessuto insulare pancreatico risponde a un livello elevato di
glucosio e di amminoacidi con un aumento della secrezione di insulina e una
diminuzione di quella del glucagone. L’elevato rapporto insulina/glucagone e
l’immediata disponibilità di substrati in circolo che si ha nelle prime ore dopo un
pasto porta a un aumento della sintesi dei triacilgliceroli, del glicogeno e delle
proteine. Durante questa fase, praticamente tutti i tessuti utilizzano il glucosio
come fonte di energia e la risposta metabolica dell’organismo è dominata da
variazioni del metabolismo del fegato, del tessuto adiposo, dei muscoli e
dell’encefalo. Introdurremo una mappa degli organi che individua gli spostamenti
dei metaboliti tra i tessuti, permettendo di avere una visione complessiva e utile
sul piano clinico del metabolismo corporeo.
Le variazioni delle attività enzimatiche nelle
condizioni di apporto di nutrienti
Il flusso di intermedi lungo le vie metaboliche è
controllato da quattro meccanismi che
operano ciascuno secondo una scala
temporale diversa, permettendo
all’organismo di adeguarsi ad un’ampia
varietà di situazioni fisiologiche:
1. la disponibilità di substrati
2. l’attivazione o l’inibizione allosterica di
enzimi
3. le modificazioni covalenti di enzimi
4. l’induzione o la repressione della sintesi di
enzimi
In condizioni di apporto alimentare mediante
tali meccanismi regolatori dai nutrienti
disponibili si formano glicogeno,
triacilgliceroli e proteine.
Le variazioni delle attività enzimatiche nelle
condizioni di apporto di nutrienti
A. Gli effetti allosterici
B. La regolazione degli enzimi mediante la modifica covalente
C. L’induzione e repressione della sintesi degli enzimi
legenda
• intermedi del metabolismo dei carboidrati
• intermedi del metabolismo dei lipidi
Il fegato: un centro di distribuzione dei nutrienti
Il fegato occupa una posizione strategica per l’elaborazione e la
distribuzione dei nutrienti di provenienza alimentare, dal momento che il
drenaggio venoso dell’intestino e del pancreas raccoglie le sostanze
nutrienti nella vena porta epatica prima di entrare nella circolazione
generale. Il sangue che il fegato riceve dopo un pasto è quindi ricco di
nutrienti di origine alimentare e contiene un livello elevato di insulina,
secreta dal pancreas. Durante il periodo dell’assorbimento intestinale, il
fegato assume carboidrati, lipidi e la maggior parte degli amminoacidi.
Questi nutrienti sono poi metabolizzati e conservati oppure inviati verso
altri tessuti. Il fegato ha perciò il ruolo di attenuare le fluttuazioni,
potenzialmente ampie, dei nutrienti a disposizione dei tessuti periferici.
Il metabolismo dei carboidrati
Normalmente il fegato produce glucosio, piuttosto che consumarlo. Tuttavia, dopo un
pasto contenente carboidrati, il fegato trattiene circa 60 grammi di glucosio ogni 100
grammi di zucchero presenti nel sistema portale e li utilizza per tutte le sue attività. Il
metabolismo epatico del glucosio aumenta attraverso i seguenti meccanismi:
aumento della fosfolirazione del glucosio (1), aumento della sintesi del glicogeno (2),
aumento dell’attività della via dell’esoso monofosfato (HMP) (3), aumento della
glicolisi (4), diminuzione della gluconeogenesi
Il metabolismo dei grassi
• aumento della sintesi degli acidi grassi ( 5)
•aumento della sintesi dei triacilgliceroli (6)
Il metabolismo degli amminoacidi
aumento della degradazione degli amminoacidi (7)
aumento della sintesi proteica (8)
Il tessuto adiposo: un deposito di scorte energetiche
La capacità del tessuto adiposo di distribuire molecole di combustibile è inferiore soltanto
a quella del fegato. In un uomo di 70 kg il tessuto adiposo pesa, in media, 14 kg, circa la
metà della massa muscolare complessiva. Negli individui obesi il tessuto adiposo può
costituire fino al 70% della massa corporea. Lo spazio interno di un adipocita può essere
occupato quasi completamente da una goccia di triacilglicerolo.
Il tessuto adiposo: un deposito di scorte energetiche
Il metabolismo dei carboidrati:
• aumento del trasporto del glucosio (1)
•aumento della glicolisi (2)
•aumento dell’attività dell’esoso monofosfato
(HMP) (3)
Il tessuto adiposo: un deposito di scorte
energetiche
Il metabolismo dei grassi:
• aumento della sintesi degli acidi grassi
(4)
•aumento della sintesi triacilgliceroli (5)
(6)
• diminuzione della degradazione dei
triacilgliceroli
Il muscolo scheletrico a riposo
Il metabolismo energetico del muscolo scheletrico è esclusivo per la sua capacità di
rispondere ai sostanziali cambiamenti nella richiesta di ATP che accompagnano
la contrazione muscolare. A riposo il consumo di ossigeno è
approssimativamente il 30% del consumo corporeo totale, ma può raggiungere il
90% durante un esercizio fisico intenso. Quindi il muscolo scheletrico,
nonostante abbia la capacità potenziale di utilizzare, per un periodo transitorio,
la glicolisi anaerobica, è un tessuto ossidativo. Il muscolo cardiaco differisce dal
muscolo scheletrico per tre aspetti importanti:
1. il cuore è in continua attività, mentre i muscoli scheletrici si contraggono in
modo intermittente, in seguito ad una sollecitazione.
2. il cuore ha un metabolismo completamente aerobico.
3. il cuore contiene riserve energetiche ( glicogeno o lipidi) in quantità trascurabile.
Ne consegue che l’interruzione del rifornimento ematico, quale quello che si verifica
durante un infarto del miocardio, provoca rapidamente la morte delle cellule
miocardiche. Le sostanze dalle quali il muscolo cardiaco ricava energia sono il
glucosio libero, gli acidi grassi e i corpi chetonici.
Il muscolo scheletrico a riposo
Il metabolismo dei carboidrati:
1. aumento del trasporto del glucosio (1)
2. aumento della sintesi del glicogeno (2)
Il metabolismo degli acidi grassi:
Gli acidi grassi si liberano dai chilomicroni e dalle VLDL per azione della lipoproteina lipasi.
Tuttavia, nel periodo di apporto di nutrienti, gli acidi grassi sono combustibili di importanza
secondaria per il muscolo, essendo invece il glucosio la fonte primaria.
Il metabolismo degli amminoacidi:
1. aumento della sintesi proteica (3) e (4)
2. aumento dell’assunzione degli amminoacidi a catena ramificata leucina, isoleucina e valina
(3).
L’encefalo
Benché costituisca solo il 2% della massa corporea di un adulto, l’encefalo
consuma il 20% a riposo dell’ossigeno utilizzato dall’organismo. L’encefalo
consuma energia ad un ritmo costante.Poiché la sua attività è vitale per un
corretto funzionamento dell’organismo, soddisfare il suo fabbisogno energetico
diventa quindi prioritario. Per poter essere utilizzati, i substrati devono
superare le cellule endoteliali che rivestono il lume dei vasi sanguigni encefalici (
barriera emato-encefalica). Normalmente il glucosio funge da combustibile
primario, dal momento che, nel periodo di apporto di nutrienti, la
concentrazione dei corpi chetonici è troppo bassa perché essi siano una fonte
alternativa di energia. Se il glucosio ematico crolla ad un livello inferiore a circa
30 mg/100 mL ( livello normale 70-90 mg/100 mL), la funzionalità cerebrale è
compromessa. Può verificarsi un danno cerebrale grave e potenzialmente
irreversibile anche qualora l’ipoglicemia perduri per un breve periodo. I corpi
chetonici, in quanto combustibili, svolgono un ruolo significativo nei periodi di
digiuno.
L’encefalo
Il metabolismo dei carboidrati (1)
Il metabolismo dei grassi
Relazioni tra tessuti durante il periodo di assorbimento
Il digiuno: uno sguardo d’insieme
Il digiuno può dipendere dall’impossibilità di reperire del cibo, dal desiderio di
perdere peso rapidamente o da una situazione clinica che comporti l’impossibilità
ad alimentarsi in seguito ad un trauma, ad un intervento chirurgico, a una neoplasia,
a ustioni etc… In mancanza di cibo, i livelli plasmatici di glucosio, degli amminoacidi
e dei triacilgliceroli tendono a diminuire; contemporaneamente la secrezione
dell’insulina decresce mentre aumenta la liberazione del glucagone. La diminuzione
del rapporto tra il livello dell’insulina e il livello del glucagone e la ridotta
disponibilità di substrati circolanti rendono il periodo di privazioni di nutrienti un
periodo catabolico, caratterizzato dalla degradazione di triacilgliceroli, glicogeno e
proteine. Ciò mette in moto uno scambio di substrati tra il fegato, il tessuto adiposo,
il tessuto muscolare e l’encefalo, sotto la spinta di due priorità:
1. l’esigenza di mantenere un livello plasmatico del glucosio tale da sostenere il
metabolismo energetico dell’encefalo e di altri tessuti che utilizzano questo
zucchero
2. la necessità di mobilizzare acidi grassi dal tessuto adiposo e di attivare la sintesi e la
liberazione dei corpi chetonici da parte del fegato, per rifornire di energia gli altri
tessuti.
Le scorte energetiche
I combustibili metabolici presenti in un uomo di 70 kg all’esordio di un digiuno
I cambiamenti enzimatici nel digiuno
Anche nel digiuno il flusso di intermedi lungo le vie del metabolismo intermedio è
controllato da quattro meccanismi:
1.la disponibilità dei substrati
2.l’attivazione o l’inibizione allosterica di enzimi
3.la modificazione covalente di enzimi
4.l’induzione o la repressione della sintesi di enzimi
Enzimi: stato fosforilato (inattivi)
Eccezioni: glicogeno fosforilasi, fruttosio bisfosfato fosfatasi-2 e lipasi sensibile agli ormoni del
tessuto adiposo, sono inattive nello stato defosforilato
Molte delle modificazioni osservate nel digiuno sono l’opposto di quelle che si verificano in
condizione di apporto di nutrienti.
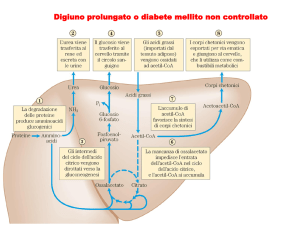
Il fegato durante il digiuno
Il ruolo primario del fegato nel
metabolismo energetico durante il
digiuno è la sintesi e la distribuzione
di molecole di combustibile ad altri
organi
si
parla
quindi
di
“metabolismo
epatico”
e
di
“metabolismo
extraepatico
o
periferico”.
Il metabolismo dei carboidrati.
Le fonti di glucosio ematico dopo
l’assunzione di 100g di zucchero.
Il metabolismo dei carboidrati
• Aumento della demolizione del glicogeno (1)
• Aumento della gluconeogenesi (2)
Il metabolismo dei grassi
• Aumento dell’ossidazione degli acidi grassi (3)
• Aumento della sintesi dei corpi chetonici (4) (principalmente 3-idrossibutirrato)
Aumento della sintesi dei corpi chetonici
Il fegato ha la capacità esclusiva di sintetizzare e
liberare i corpi chetonici, principalmente il 3idrossibutirrato, che i tessuti periferici possono usare
come combustibile. Il fegato non può utilizzare i
corpi chetonici come combustibile. La sintesi dei
corpi chetonici è favorita quando la concentrazione
dell’acetil CoA prodotto dal metabolismo degli acidi
grassi eccede la capacità ossidativa del ciclo dei TCA.
Una sintesi significativa di corpi chetonici ha inizio
durante i primi giorni di digiuno. Contrariamente agli
acidi grassi, i corpi chetonici sono idrosolubili e
compaiono nel sangue e nell’urina a partire dal
secondo giorno di digiuno. Nel digiuno la
disponibilità di corpi chetonici in circolo è
importante, perché la maggioranza dei tessuti può
utilizzarli come combustibile, compreso l’encefalo,
una volta che il loro livello ematico abbia raggiunto
un valore sufficientemente elevato. Ciò riduce il
bisogno di sintetizzare glucosio attraverso la
gluconeogenesi a partire dagli scheletri carboniosi di
amminoacidi, rallentando quindi la perdita di
proteine essenziali.
La concentrazione ematica degli acidi grassi e
del 3-idrossibutirrato durante il digiuno
Il tessuto adiposo durante il digiuno
Il metabolismo dei carboidrati: il trasporto del
glucosio dentro gli adipociti e il suo successivo
metabolismo sono depressi a causa del basso
livello di insulina in circolo. Ne consegue una
diminuita sintesi di acidi grassi e triacilgliceroli.
Il metabolismo dei grassi
Aumento della degradazione dei triacilgliceroli:
l’aumento dell’adrenalina e della noradrenalina,
liberate dalle terminazioni simpatiche, stimola
l’attività della lipasi sensibile agli ormoni con
conseguente idrolisi dei triacilgliceroli depositati
nell’adipocita (1)
Aumento della liberazione degli acidi grassi:
gli acidi grassi liberi prodotti dall’idrolisi dei
triacilgliceroli di deposito sono rilasciati nel sangue
e legati all’albumina raggiungono una molteplicità di tessuti e sono utilizzati per produrre
energia. Il glicerolo è utilizzato dal fegato come precursore gluconeogenetico. Gli acidi grassi
sono convertiti in acetil-CoA, che entra poi nel ciclo dei TCA liberando energia.
Diminuzione dell’assunzione degli acidi grassi: nel digiuno l’attività della lipoproteina lipasi è
bassa per cui i triacilgliceroli circolanti sotto forma di lipoproteine non sono disponibili per la
sintesi dei triacilgliceroli nel tessuto adiposo.
Il muscolo scheletrico a riposo durante il digiuno
Nel digiuno, il muscolo a riposo utilizza gli acidi grassi come fonte principale di energia. Al contrario
il muscolo in esercizio inizialmente utilizza come fonte di combustibile le proprie scorte di glicogeno
durante uno sforzo intenso, il glucosio 6-fosfato derivante dal glicogeno è convertito in lattato con la
glicolisi anaerobica. Quando le scorte di glicogeno si esauriscono, gli acidi grassi liberi derivanti
dalla mobilizzazione dei triacilgliceroli del tessuto adiposo diventano la fonte dominante di energia.
Metabolismo dei carboidrati: il trasporto del glucosio all’interno delle fibre del muscolo scheletrico
e il conseguente metabolismo sono depressi a causa del basso livello di insulina in
circolo.Metabolismo dei lipidi: durante le prime due settimane di digiuno, il muscolo utilizza come
combustibili gli acidi grassi derivanti dal tessuto adiposo e i corpi chetonici prodotti dal fegato (1 e
2).
Dopo
circa
tre
settimane
di
digiuno,
l’utilizzo
dei
corpi
chetonici
diminuisce
e
il
muscolo
usa
quasi
esclusivamente
gli
acidi
grassi,
con
ulteriore
aumento
dei
corpi
chetonici
in
circolo e loro maggior utilizzo da parte dell’encefalo. Metabolismo delle proteine: durante i primi
giorni di digiuno si verifica una rapida demolizione delle proteine muscolari
che
forniscono
al
fegato
amminoacidi
(principalmente
alanina
e
glutammina)
per
la
gluconeogenesi
(3).
Dopo
varie
settimane
di
digiuno
la
proteolisi
muscolare
diminuisce
perché
l’encefalo
ha
un
minore
bisogno
di
glucosio
perché
utilizza, come fonte di energia, i corpi chetonici.
L’encefalo nel digiuno
Durante i primi giorni di digiuno, l’encefalo continua ad utilizzare come fonte di energia
esclusivamente il glucosio (1). La gluconeogenesi epatica riesce a mantenere il livello ematico
del glucosio utilizzando precursori glucogenici quali gli amminoacidi forniti dalla rapida
demolizione della proteine muscolari. Nel digiuno protratto (2-3 settimane) i corpi chetonici
raggiungono livelli significativamente elevati e l’encefalo li utilizza come combustibili in aggiunta
al glucosio (2).
Ciò riduce la richiesta del catabolismo proteico per alimentare la
gluconeogenesi. I cambiamenti metabolici che si verificano durante il digiuno
garantiscono a tutti i tessuti un apporto adeguato di molecole combustibili.
Relazioni metaboliche tra i
tessuti durante il digiuno
SISTEMI COINVOLTI NEL CONTROLLO DELL’ASSUNZIONE DI CIBO
Neurotrasmettitori periferici e centrali che regolano l’assunzione di cibo ed il
dispendio energetico
Sistema nervoso
periferico
Noradrenalina (effetto alfaadren)
2
Noradrenalina (effetto betaadren)
1
Sistema nervoso
centrale
2
Intake di cibo
Consumo di energia
1
•Inibiscono l’intake di cibo e aumentano il consumo energetico
2
•Stimolano l’intake di cibo e diminuiscono il consumo energetico
Galanina, oppioidi, NA e A
(alfa),GABA
1 Dopamina, Serotonina, CCK, NA
e A (beta)
DOPAMINA
La D esercita un tono inibitorio fisiologico sul consumo di cibo
attraverso l’attivazione dei recettori D2 dopaminergici centrali.
Sono soprattutto i cibi ricchi in proteine e lipidi ad essere assunti
in quota minore, in seguito all’azione della D e degli agenti che
ne inducono il rilascio (amfetamina e derivati)
Scarsi effetti si registrano sul consumo di carboidrati.
La D riduce il consumo di cibo anche causando un ritardo
dell’inizio del pasto.
Noradrenalina (NA) e Adrenalina (A)
controllano l’adiposità e l’equilibrio energetico attraverso parecchi
meccanismi:
promuovono il catabolismo dei trigliceridi e del glicogeno
stimolano l’assunzione di cibo
attivano la termogenesi nel tessuto adiposo bruno
regolano la perdita di calore attraverso la modulazione della
vasocostrizione periferica .
Recettori α2-adrenergici: nel nucleo paraventricolare (PVN)
ipotalamico.
assunzione di cibo
Ritardo o inibizione della sazietà per i carboidrati
Recettori β-adrenergici: A livello dell’area perifornicale
dell’ipotalamo laterale (PFH);
Soppressione dell’assunzione di cibo
Serotonina
Causa diminuzione dell’assunzione di cibo.
Recettori post-sinaptici di tipo 5-HT1B, che sono concentrati nel
nucleo ipotalamico mediale (sensibili al digiuno).
Diminuzione selettiva di carboidrati rispetto alle proteine.
Topi transgenici non in grado di esprimere recettori 5-HT2C
diventano obesi per un alterato controllo del comportamento
alimentare.
Gaba
L’acido -aminobutirrico (GABA) è un aminoacido che iniettato nel
PVN ipotalamico è in grado di potenziare il consumo di cibo ricco
di zuccheri.
Recettori di tibo GABA-A.
Le benzodiazepine determinano un aumento dell’assunzione di
cibo aumentando la percezione della piacevolezza dei cibi.
Galanina
E’ sintetizzata nell’ipotalamo.
L’infusione cerebro-ventricolare di galanina stimola l’appetito.
Ruolo non cruciale (sebbene interagisca con il GHRH nella
regolazione del GH e possa inoltre modulare l’apporto di cibo
attraverso connessioni sinaptiche con i terminali assonali dei
neuroni NPY secernenti).
Fattori bioumorali che regolano l’intake di cibo e la spesa
energetico-metabolica
L’OMEOSTASI DEL GLUCOSIO
A digiuno l’utilizzo di glucosio in un individuo di 70 Kg è
approssimativamente di 2mg/Kg/min (200g/24h). La concentrazione
plasmatica di glucosio riflette l’equilibrio tra l’assorbimento dal tratto
gastrointestinale, l’utilizzo a livello dei tessuti e la produzione
endogena. L’omeostasi del glucosio è controllata principalmente
dall’ormone anabolico insulina e da diversi fattori di crescita simili
all’insulin. Molti ormoni catabolici (glucagone, catecolamine, cortisolo
e ormone della crescita) contrastano l’azione dell’insulina e sono noti
come ormoni anti-insulina o ormoni anti-regolatori.
La concentrazione plasmatica di
glucosio
è
il
risultato
dell’equilibrio
tra
l’azione
ipoglicemizzante dell’insulina e
l’azione iperglicemizzante degli
ormoni anti-insulina
L’insulina è secreta dal pancreas in risposta all’aumento del glucosio plasmatico
dopo un pasto. L’insulina diminuisce la concentrazione plasmatica di glucosio
promuovendo l’entrata di glucosio nei tessuti, il metabolismo intracellulare del
glucosio e la sintesi di glicogeno. Gli ormoni anti-insulina stimolano sia il rilascio
di glucosio dalle riserve di glicogeno che la sua sintesi de novo causando
l’aumento della concentrazione di glucosio nel plasma (iperglicemia). L’equilibrio
tra l’azione dell’insulina e quella del glucagone rappresenta un elemento chiave
nel controllo del metabolismo energetico.
L’insulina induce lo
stato
anabolico
spostando
il
metabolismo
verso
l’accumulo
di
carboidrati, lipidi e la
sintesi di proteine.
Questo ormone agisce
su
tre
tessuti
principali: il fegato, il
muscolo e il tessuto
adiposo.
Nel fegato l’insulina stimola la glicolisi e la glicogenosintesi. Allo stesso tempo blocca
la lipolisi e promuove la sintesi di acidi grassi a lunga catena (lipogenesi). I lipidi
vengono successivamente assemblati a lipoproteine a densità molto bassa (VLDL)
che vengono rilasciate nel sangue. Nei tessuti periferici l’insulina induce la
lipoproteina lipasi, un enzima che libera i trigliceridi sia dalle VLDL epatiche che dai
chilomicroni, idrolizzandoli in glicerolo e acidi grassi. Stimola anche nel tessuto
adiposo la sintesi di trigliceridi a partire dal glicerolo 3-fosfato. Nel muscolo,
l’insulina stimola il trasporto del glucosio, il metabolismo del glucosio e la sintesi di
glicogeno; stimola inoltre l’assorbimento cellulare di aminoacidi e la sintesi di
proteine.
Il controllo endocrino della glicemia : rilascio di Insulina
Il meccanismo cellulare che controlla il rilascio di
insulina
- Controllo della Glicemia
– Controlli sulle cellule b
- Il controllo endocrino della glicemia
Regolazione dell’Insulina
1. Rilasciata in risposta ad un aumento dei livelli
plasmatici di glucosio
2. Rilasciata a seguito di un aumento dei livelli
plasmatici di aminoacidi e chetoacidi
• Circola libera nel plasma
• Circa il 50% è rimossa dal fegato durante il primo
passaggio
• La maggior parte viene degradata a seguito
dell’internalizzazione del complesso recettoreinsulina
Azione dell’insulina sui trasportatori del glucosio Glut-4 nei
tessuti bersaglio (muscolo e tessuto adiposo, ma non fegato)
- Azione dell’insulina sul fegato
Il glucagone è un piccolo peptide a singola catena costituito da 29
aminoacidi e un peso molecolare di 3485 Da. Il glucagone concentra
il metabolismo energetico verso la produzione endogena di glucosio.
Il suo principale effetto è la mobilizzazione delle riserve di nutrienti
per mantenere una adeguata concentrazione ematica di glucosio tra i
pasti. Il glucagone inibisce le vie implicate nell’utilizzo del glucosio e
blocca l’accumulo dei nutrienti metabolici. Esso agisce rapidamente
sul fegato stimolando la glicogenolisi e inibendo la sintesi di
glicogeno, la glicolisi e la lipogenesi. Contemporaneamente stimola
la gluconeogenesi e la chetogenesi. Il glucagone induce la produzione di
glucosio da ogni fonte disponibile. Inoltre stimola la lipolisi e la chetogenesi a
partire dall’AcetilCoA.
Controllo della Glicemia – il
GLUCAGONE
Ormone peptidico di 29 aa
Sintetizzato dalla cellule a
PARASIMPATICO
aumento
gluconeogenesi
epatica
aumento
glicogenolisi
epatica
SIMPATICO
aumento
lipolisi
aumento
GLICEMIA
Depositi di
grasso
GH
glucagone
adrenalina
insulina
Carboidrati
della dieta
Acidi grassi liberi e
glicerolo nel sangue
FEGATO
insulina
Glucosio
nel sangue
insulina
metabolismo
del cervello
glucagone
adrenalina
gluconeogenesi
Sintesi di
glicogeno
glicogenolisi
Glicogeno cortisolo
aminoacidi
muscolare
nel sangue
e proteine
insulina
Effetti dell’adrenalina sul metabolismo
•
•
•
•
Aumentata glicogenolisi nel fegato e nel muscolo
Aumentata lipolisi nel tessuto adiposo
Diminuita secrezione di insulina
Aumentata secrezione di glucagone
C
I
B
O
Effetti del cortisolo sui
flussi energetici
•facilita la mobilizzazione
di nutrienti (catabolico)
•mantiene la produzione
di glucosio dalle proteine
•facilita il metabolismo
dei grassi
STIMOLA
INIBISCE
L’ipoglicemia è una situazione caratterizzata da una concentrazione di
glucosio nel sangue inferiore a 2,5 mmol/L (45 mg/dL). Una
diminuzione della concentrazione plasmatica di glucosio stimola il
sistema nervoso simpatico. L’adrenalina e il glucagone sono rilasciati in
risposta allo stress e manifestano i loro effetti con sudorazione,
tremori, aumento della frequenza cardiaca e sensazione di appetito.
Se il glucosio ematico continua a diminuire le funzioni cerebrali
vengono compromesse dalla mancanza di glucosio. I pazienti
manifestano confusione e possono perdere conoscenza.
Solitamente l’ipoglicemia in soggetti sani è lieve e può
verificarsi durante l’attività fisica svolta dopo un periodo di
digiuno, oppure come il risultato dell’assunzione di alcol. L’alcol
infatti aumenta il rapporto NADH/NAD+ all’interno della
cellula, il quale favorisce la conversione del piruvato a lattato e
riduce la quantità di piruvato disponobile per la gluconeogenesi.
Risposta
endocrina
all’ipoglicemia
Metabolismo in
condizione di sazietà
Meccanismi di regolazione della
glicemia
63
Il pancreas secerne due importanti ormoni coinvolti nella regolazione
del metabolismo del glucosio, dei lipidi e delle proteine:
Insulina
Glucagone
Aumento di glucosio nel sangue
Diminuzione di glucosio nel sangue
liberazione di insulina
liberazione di glucagone
Si lega a recettori di
membrana nelle
cellule epatiche
Incrementa l’attività della
glicogeno-sintetasi
Lega recettori di
membrana negli adipociti
e nelle cellule muscolari
Si lega ai recettori di membrana
Esocitosi e attivazione dei
trasportatori di glucosio
Aumento di cAMP, attivazione della
chinasi cAMP-dipendente
Incrementa la rimozione
del glucosio
Rimozione del glucosio dal sangue
Deposito come glicogeno
Attivazione dell’adenilato ciclasi
Attivazione della
glicogeno fosforilasi
Inibizione della
glicogeno sintetasi
Degradazione di glicogeno a glucosio
Rilascio di glucosio nel sangue
64
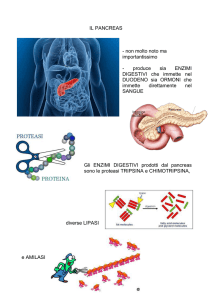
Il pancreas è costituito da due tipi principali di tessuto:
gli Acini che secernono succo digestivo destinato a riversarsi nel
duodeno
gli Isolotti di Langherans che secernono insulina e glucagone
direttamente nel sangue
Il pancreas umano contiene da 1 a 2 milioni di Isole di Langherans,
ciascuna con diametro di 0,3 mm in stretto contatto con i capillari
sanguigni
Contengono 3 tipi principali di cellule: alfa, beta, delta.
65
66
69
Insulina
Ormone polipeptidico prodotto dalle
cellule β degli isolotti di Langerhans
(1-2% del parenchima pancreatico)
del pancreas. E’ l’ormone più
importante nel coordinamento
dell’utilizzo delle sostanze nutrienti
da parte dei tessuti. Ha effetti
metabolici di tipo anabolico che
favoriscono in particolare la sintesi
del glicogeno, dei triacilgliceroli e
delle proteine.
71
Alfa sono circa il 25% del totale, secernono glucagone
Beta sono le più numerose, il 60% del totale, secernono insulina
Delta il 10% secernono somatostatina
È presente inoltre almeno un altro tipo di cellule, denominato PP che
secernono un ormone a funzione incerta chiamato peptide pancreatico
Legato probabilmente alla regolazione della secrezione esocrina del
pancreas.
INSULINA E LE SUE FUNZIONI
Questo ormone, isolato per la prima volta dal pancreas nel 1922, da
Banting e Best, ha mutato radicalmente il destino del diabetico grave
Storicamente la nozione di insulina è associata allo zucchero nel
sangue
Ma sono soprattutto le turbe del metabolismo dei grassi, che
sono le usuali cause di morte tra i diabetici, per aterosclerosi
ed acidosi.
Sono gravi anche le alterazioni del metabolismo proteico che
portano il diabetico a grave consunzione
Prima dell’avvento dell’insulina i soggetti con diabete mellito di tipo 1
non potevano sopravvivere più di qualche giorno o mese (solo
raramente la sopravvivenza era di qualche anno).
Gli effetti metabolici dell’insulina e del glucagone
Aspetti generali: il fegato, il tessuto adiposo, il
muscolo e l’encefalo sono i quattro tessuti che
svolgono un ruolo dominante nel metabolismo
energetico perché contengono un corredo di
enzimi particolare che permette loro di
specializzarsi nell’accumulo, nell’utilizzo e
nella produzione di specifiche sostanze
combustibili. Questi tessuti sono collegati l’un
l’altro attraverso un sistema di comunicazione
che dipende dal sistema nervoso, dalla
disponibilità di sostanze nel circolo sanguigno
e dalla variazione del livello degli ormoni
plasmatici. L’integrazione del metabolismo è
controllata principalmente da insulina e
glucagone e supportata dalle catecolamine,
adrenalina e noradrenalina. Il livello circolante
di tali ormoni permette all’organismo di
accumulare energia e di utilizzare l’energia
accumulata a seconda delle condizioni
metaboliche.
Struttura dell’insulina
Sintesi dell’insulina
Peptide C: è indispensabile
per il corretto ripiegamento
della proinsulina e poiché
la sua emivita plasmatica è
più lunga è un buon
indicatore della produzione
e della secrezione
dell’insulina nella diagnosi
di diabete giovanile.
L’insulina è conservata in
granuli citoplasmatici che si
liberano per esocitosi se
stimolati. E’ degradata
dalla insulinasi (fegato e
reni). La breve emivita
plasmatica (6 minuti ca.)
permette la rapida
variazione della
concentrazione
dell’ormone in circolo.
Regolazione della secrezione dell’insulina
La stimolazione della secrezione
dell’insulina.
La sintesi e la secrezione dell’insulina sono
stimolate da:
a) il glucosio (glucochinasi delle cellule β)
b)gli amminoacidi (arginina)
c)gli ormoni gastrointestinali (secretina) che
provocano un aumento anticipato del livello
dell’insulina nella vena porta, prima che si
verifichi un effettivo aumento del livello
ematico di glucosio.
L’inibizione della secrezione dell’insulina
La sintesi e la secrezione dell’insulina
diminuiscono quando le sostanze nutrienti della
dieta scarseggiano e nei periodi di stress (febbre
o infezione). Questi effetti sono mediati
principalmente dall’adrenalina secreta dalla
midolla surrenale in risposta allo stress, a un
trauma o a un esercizio fisico molto intenso. In
tali condizioni la liberazione dell’adrenalina è
controllata soprattutto dal sistema nervoso.
Questo ormone ha un effetto diretto sul
metabolismo energetico e provoca una rapida
mobilizzazione delle riserve energetiche, tra cui
il glucosio presente nel fegato (prodotto per
glicogenolisi o per gluconeogenesi) e gli acidi
grassi del tessuto adiposo. L’adrenalina può
talvolta precedere e annullare la normale
liberazione di insulina stimolata dal glucosio.
Nelle situazioni di emergenza, il sistema nervoso
simpatico si sostituisce al livello plasmatico del
glucosio come fattore di controllo della
secrezione da parte delle cellule β.
Gli effetti metabolici dell’insulina
1) Gli effetti sul metabolismo dei carboidrati (fegato, muscolo e tessuto adiposo).
- Fegato: l’insulina fa diminuire la sintesi di glucosio inibendo la gluconeogenesi e
glicogenolisi.
- Muscolo e fegato: l’insulina fa aumentare la glicogenosintesi.
- Muscolo e tessuto adiposo: l’insulina fa aumentare l’assunzione di glucosio
aumentando il numero dei relativi trasportatori presenti sulla membrana plasmatica.
2) Gli effetti sul metabolismo dei lipidi.
-Diminuzione della degradazione dei triacilgliceroli: l’insulina fa diminuire il livello
degli acidi grassi in circolo inibendo l’attività della lipasi sensibile agli ormoni nel
tessuto adiposo (defosforilazione).
-L’aumento della sintesi dei triacilgliceroli: l’insulina fa aumentare sia il trasporto del
glucosio negli adipociti, che il suo metabolismo per produrre acidi grassi e glicerolo 3fosfato per la sintesi dei triacilgliceroli. Inoltre fa aumentare la sintesi della
lipoproteina lipasi del tessuto adiposo, per cui nelle cellule si accumulano acidi grassi
esterificabili.
3) Gli effetti sulla sintesi delle proteine: nella maggior parte dei tessuti l’insulina
stimola l’ingresso degli amminoacidi nelle cellule e la sintesi delle proteine.
Meccanismo d’azione dell’insulina
L’insulina si lega a specifici
recettori ad alta affinità
presenti nella membrana
plasmatica delle cellule nella
maggior parte dei tessuti, tra
cui il fegato, il muscolo e il tessuto adiposo innescando una
serie di reazioni a cascata che produce una varietà di effetti
biologici.
1. Il recettore dell’insulina
2. la traduzione del segnale (proteine substrato del recettore
dell’insulina IRS)
Meccanismo d’azione dell’insulina
3. Gli effetti dell’insulina sulle membrane (trasportatori
del glucosio insulina sensibili GLUT-4) (muscolo
scheletrico e tessuto adiposo).
4. La regolazione dei recettori (down-regulation)
5. I tempi delle risposte all’insulina (induzione, sintesi di
glucochinasi, fosfofruttochinasi e piruvato chinasi).
Caratteristiche del trasporto del glucosio in vari tessuti
Alcuni tessuti hanno un sistema di
trasporto del glucosio indipendente
dall’insulina. Per esempio gli
epatociti, gli eritrociti e certe cellule
del tessuto nervoso, della mucosa
intestinale, dei tubuli renali e della
cornea non necessitano
dell’insulina per assumere
glucosio.
Il glucagone
Il glucagone è un ormone polipeptidico secreto dalle cellule α degli isolotti di
Langerhans del pancreas. Assieme all’adrenalina, al cortisolo e all’ormone della
crescita (ormoni controregolatori) contrasta molte delle azioni dell’insulina. Mantiene
costante il livello ematico di glucosio attivando la glicogenolisi epatica e la
gluconeogenesi. Il glucagone è un’unica catena polipeptidica composta da 29
amminoacidi (la stessa in tutte le specie di mammiferi esaminate a tutt’oggi). Il
glucagone è sintetizzato sottoforma di un precursore più grande che poi è convertito
nell’ormone vero e proprio attraverso una serie di tagli proteolitici selettivi, simili a
quelli che avvengono nella biosintesi dell’insulina.
La stimolazione della secrezione del glucagone
Le cellule α rispondono a una varietà di stimoli che segnalano un’ipoglicemia
effettiva o potenziale. I fattori che aumentano la secrezione del glucagone sono:
1) un basso livello ematico del glucosio.(digiuno notturno o prolungato).
2) gli amminoacidi.(pasto proteico: aumenta sia insulina che glucagone).
3) l’adrenalina.
L’inibizione della secrezione del glucagone
La secrezione del glucagone è ridotta in modo significativo da un elevato livello ematico
di glucosio e di insulina. Entrambe le sostanze aumentano in seguito all’assunzione
di glucosio o di un pasto ricco di carboidrati. Gli effetti metabolici del glucagone:
1) Gli effetti sul metabolismo dei carboidrati
2) Gli effetti sul metabolismo dei lipidi
3) Gli effetti sul metabolismo delle proteine
Meccanismo d’azione del glucagone
Ipoglicemia
La sindrome ipoglicemica è caratterizzata da:
1) Sintomi che coinvolgono il SNC, quali stato confusionale, comportamento aberrante o
coma.
2) Allo stesso tempo, un livello del glucosio ematico pari o inferiore a 40mg/dL.
3) Sintomi che scompaiono dopo pochi minuti dalla somministrazione di glucosio.
L’ipoglicemia è un’emergenza medica, perché il SNC ha l’assoluta necessità di un continuo
apporto ematico di glucosio, per alimentare il proprio metabolismo energetico.
L’ipoglicemia transitoria può provocare una disfunzione cerebrale, mentre l’ipoglicemia
grave e prolungata provoca la morte cerebrale. Non sorprende quindi che l’organismo
disponga di molteplici meccanismi per impedire o correggere l’ipoglicemia. I
cambiamenti ormonali più importanti per contrastare l’ipoglicemia sono l’aumento del
glucagone e dell’adrenalina, insieme alla diminuzione del rilascio di insulina.
I sintomi dell’ipoglicemia:sono suddivisi in due categorie, adrenergici e neuroglicopenici.
I sintomi adrenergici (ansia, palpitazioni, tremori e sudorazione) sono mediati dalla
secrezione di adrenalina, regolata dall’ipotalamo in risposta all’ipoglicemia. Si verificano
quando il livello del glucosio ematico crolla improvvisamente.
I sintomi neuroglicopenici, cioè la cessazione della fornitura di glucosio all’encefalo,
compromette le funzioni di quest’organo provocando cefalea, stato confusionale,
difficoltà della parola, convulsioni, coma e morte. Sono dovuti spesso a una graduale
diminuzione del glucosio ematico a un livello inferiore a 40mg/dL.
Sistemi glucoregolatori
Negli esseri umani ci sono due sistemi sovrapposti di regolazione del glucosio, entrambi attivati dall’ipoglicemia:
1) gli isolotti di Langerhans che liberano il glucagone.
2) alcuni recettori dell’ipotalamo che rispondono a concentrazioni anormalmente basse del glucosio ematico.
I glucorecettori ipotalamici possono innescare sia la secrezione di adrenalina (mediata dal sistema nervoso autonomo, sia
la liberazione dell’ACTH e dell’ormone della crescita (GH) da parte dell’ipofisi anteriore. Il glucagone, l’adrenalina e il
cortisolo sono a volte chiamati ormoni “controregolatori”, perché ciascuno di essi contrasta l’azione dell’insulina
sull’utilizzazione del glucosio.
• Glucagone e adrenalina
• Cortisolo e ormone della crescita
I tipi di ipoglicemia
Vengono considerati tre tipi di ipoglicemia:
1) Ipoglicemia indotta dall’insulina:
si verifica spesso in pazienti diabetici sottoposti ad insulina. A
pazienti coscienti con leggera ipoglicemia si somministrano
oralmente carboidrati.
A pazienti ipoglicemici che perdono coscienza o non riescono più
a coordinare la deglutizione si somministra glucagone per via
sottocutanea o intramuscolare.
2) Ipoglicemia post-prandiale (ipoglicemia reattiva):
è piuttosto frequente e consiste in una eccessiva liberazione di
insulina dopo un pasto, determinando un’ipoglicemia transitoria
che cessa senza assunzione di cibo. ( Terapia:frequenti piccoli
pasti).
3) Ipoglicemia da digiuno, inclusa quella da intossicazione alcolica:
è piuttosto rara e tende a produrre i sintomi della neuroglicopenia
e può dipendere da una riduzione della velocità alla quale il
fegato produce il glucosio. Ciò può dipendere da un danno
epatico, da insufficienza surrenalica oppure si può manifestare in
individui a digiuno che abbiano assunto una quantità rilevante di
etanolo. Oppure da un aumento della velocità alla quale i tessuti
periferici consumano il glucosio in seguito a un livello elevato di
insulina provocato da un tumore pancreatico delle cellule β.
Senza trattamento il paziente affetto da ipoglicemia da digiuno
può perdere coscienza, avere le convulsioni o entrare in coma.
Ipoglicemia da intossicazione alcolica
a) la gluconeogenesi normale se non si assume etanolo
b) l’inibizione della gluconeogenesi epatica da metabolismo dell’etanolo nel fegato
concentrazione
Effetti della
rimozione del
pancreas sulla
glicemia e sulla
concentrazione
plasmatica di acidi
grassi liberi (non
esterificati) e di acido
acetacetico
giorni
92
INSULINA: ORMONE ANABOLIZZANTE
La sua secrezione è associata ad una grande disponibilità di energia cioè
viene secreta quando è abbondante l’apporto di alimenti energetici con la
dieta
È indispensabile per immagazzinare le sostanze energetiche in eccesso
I carboidrati: vengono immagazzinati come glicogeno nel fegato e nel
muscolo
I grassi: l’ormone ne favorisce l’accumulo nel tessuto adiposo converte inoltre in grassi tutti gli zuccheri non depositati come glicogeno
Le proteine: l’insulina favorisce la captazione degli Aa e la sintesi proteica
intracellulare
93
L’insulina è una proteina di piccole dimensioni PM 5.808
Secreta come prepro-ormone PM 11.500 viene scissa nel reticolo endoplasmico in pre-ormone PM 9.000, che viene successivamente degradato nel
golgi nella forma attiva, che viene impacchettata nei granuli secretori
94
Il meccanismo cellulare che controlla il rilascio di insulina
nelle cellule beta pancreatiche
95
– controlli sulle cellule b
96
l’insulina secreta nel sangue si trova in forma non legata ha un emivita di
soli 6 minuti, viene allontanata dal circolo dopo circa 10÷15 minuti
tranne la quota legata ai recettori l’insulina viene degradata ad opera
dell’enzima insulinasi del fegato, e in minor misura nel rene
per poter avere effetto sulle cellule bersaglio l’insulina si deve legare ad
un recettore di membrana
la proteina recettore di PM 300.000 daltons, viene attivata dal legame con
l’ormone
È il recettore attivato che determina gli effetti metabolici successivi
97
IL RECETTORE INSULINICO HIR
Si presenta in due isoforme che differiscono per la presenza HIR-B o
meno HIR-A di una catena di 12 Aminoacidi localizzata all’estremità
COOH terminale della subunità A extracellulare del recettore
Le due isoforme hanno una diversa affinità di legame per l’ormone ed
anche una diversa cinetica di internalizzazione il che suggerisce che le
diverse isoforme abbiano una diversa attività biologica tale da modulare
nei diversi tessuti una adeguata risposta allo stimolo insulinico
98
IRS-1
IRS-1
99
100
PROTEINE Carrier
L’azione dell’insulina sul trasporto del glucosio coinvolge la trasduzione di
proteine trasportatrici definite carrier
L’insulina è in grado di regolare la sintesi di tali trasportatori e di
promuovere la traslocazione energia-dipendente delle vescicole intracellulari
che contengono tali trasportatori verso la membrana plasmatica; questo
effetto è reversibile, infatti i trasportatori ritornano a livello intracellulare
dopo la rimozione dell’insulina.
I trasportatori di glucosio rappresentano una famiglia di proteine con
differenti isoforme tessuto-specifiche denominate GLUT
101
Trasportatori di glucosio
Km glucosio
(mmol/L)
Funzione
1÷2
Captazione basale del
glucosio, trasporto
attraverso la barriera
emato-encefailca
GLUT 2
Cellule B pancreatiche,
fegato, rene, intestino
15÷20
Regolazione del rilascio di
insulina, altri aspetti
dell’omeostasi glucidica
GLUT 3
Cervello, rene,
placenta, altri tessuti
<1
Captazione nei neuroni e
in altri tessuti
GLUT 4
Muscolo, adipe
=5
Captazione di glucosio
mediata da insulina
GLUT 5
Intestino, rene
1÷2
Assorbimento intestinale
del fruttosio
Trasportatore
GLUT 1
Tessuti
Tutti i tessuti
specialmente eritrociti, cervello
102
EFFETTO DELL’INSULINA
SUL METABOLISMO DEI CARBOIDRATI
MUSCOLO
TESSUTO ADIPOSO
FEGATO
103
INSULINA E MUSCOLO
la membrana del muscolo a riposo è poco permeabile al glucosio
durante la maggior parte della giornata, il muscolo dipende, per le sue
richieste energetiche, dagli ac.grassi non dal glucosio
la permeabilità della membrana muscolare al glucosio aumenta quan-do è
sotto l’effetto dell’insulina
104
Se lo zucchero non viene utilizzato immediatamente dal muscolo per fini
energetici, viene depositato sotto forma di glicogeno
La quantità di glicogeno depositato non supera il 2%, ma essendo la
massa muscolare corporea rilevante, i depositi di glicogeno muscolari
sono ovviamente importanti
Il glicogeno depositato viene utilizzato al bisogno quando cioè il muscolo si contrae in condizioni anaerobiche nelle quali il glicogeno vie-ne
degradato ad acido lattico
durante l’esercizio fisico
in questo caso l’utilizzo del glucosio non richiede elevate quantità di
insulina poiché il muscolo in queste condizioni diviene molto permea-bile
al glucosio, per ragioni non ancora note, anche in assenza dell’ormone
105
Azione dell’insulina sui trasportatori del glucosio Glut-4 nei
tessuti bersaglio (muscolo e tessuto adiposo, ma non fegato)
106
INSULINA E FEGATO
uno degli effetti più importanti dell’ormone è quello di immagazzina-re
come glicogeno nel fegato la maggior parte del glucosio assorbito
dall’intestino dopo un pasto
il glicogeno immagazzinato viene poi degradato a glucosio e liberato nel
sangue, quando tra un pasto e l’altro la concentrazione dello zuc-chero
diminuisce così da impedire che la glicemia si abbassi troppo
107
INSULINA E FEGATO
Meccanismo d’azione
l’insulina inibisce la fosforilasi epatica che provoca la scissione del
glicogeno in glucosio
aumenta l’attività della glicochinasi, enzima che induce la fosforilazione del glucosio entrato nell’epatocita
aumenta l’attività degli enzimi che inducono la sintesi del glicogeno,
fosfofruttochinasi, glicogenosintetasi
l’effetto è quello di aumentare la quantità di glicogeno nell’organo fino a
100 gr. circa il 6% della massa epatica
108
Azione dell’insulina sul fegato, trasportatore GLUT-2
109
Effetti dell’ormone sul cervello
le cellule cerebrali utilizzano solamente glucosio
sono permeabili al glucosio senza l’intervento dell’insulina (GLUT-1)
É essenziale che la glicemia sia mantenuta sopra ad un determinato livello critico.
Se la quantità dello zucchero va al disotto di 20-50 mg/100 ml si ha shock
ipoglicemico che si manifesta con irritabilità, convulsioni, perdita di
coscienza e coma.
110
EFFETTO DELL’INSULINA
SUL METABOLISMO DEI GRASSI
l’insulina induce l’aumento dell’immagazzinamento dei grassi
quando il glucosio nel fegato non può più essere depositato come
glicogeno, viene degradato in Piruvato e convertito in Acetil CoA
l’attivazione dell’acetil Coa carbossilasi converte acetilCoA in
malonilCoA prima tappa della sintesi degli ac. Grassi
gli ac. grassi vengono convertiti in trigliceridi che liberati dagli
epatociti sono trasportati al tessuto adiposo legati a lipoproteine entrano
negli adipociti grazie alla lipoprotein-lipasi che scinde i trigliceridi in
ac. grassi che possono essere così assorbiti
111
l’insulina ha altri due effetti importanti nell’immagazzinamento dei
grassi nelle cellule adipose
inibisce la lipasi ormono-sensibile e questo inibisce la liberazione
degli ac. grassi nel sangue
promuove il trasporto nelle cellule adipose del glucosio che è utilizzato sia per la sintesi di ac. grassi che di a-glicerofosfato sostanza
che fornisce il glicerolo per la sintesi dei trigliceridi
la mancanza di insulina provoca negli epatociti:
1: la rapida b-ossidazione dei grassi nei mitocondri… vengono
prodotte forti quantità di CoA
2: questo eccesso di CoA
viene convertitoin Ac. acetace-
tico e liberato nel sangue viene metabolizzato in
ACIDO BETA IDROSSIBUTIRRICO
ACETONE
INDUCENDO CHETOSI
ED ACIDOSI
EFFETTO DELL’INSULINA
SUL METABOLISMO DELLE PROTEINE
-L’insulina promuove il trasporto di molti Aa all’interno delle cellule
(val, leu, isoleu, phe)
**(anche l’ormone della crescita ha lo stesso effetto, ma gli Aa sono
diversi)
-l’insulina agisce sui ribosomi aumentando la trasduzione dell’ mRNA
e aumenta inoltre la trascrizione di porzioni di DNA
-inibisce il catabolismo delle proteine
-deprime la gliconeogenesi epatica
L’INSULINA HA AZIONE SINERGICA CON
L’ORMONE SOMATOTROPO
dopo la rimozione del pancreas e dell’ipofisi, nessuno dei due ormoni
è in grado di far riprendere la crescita agli animali trattati se sono
somministrati singolarmente, ma se gli ormoni sono somministrati in
associazione si manifesta la ripresa della crescita in maniera
eclatante
il sinergismo si manifesta poiché i due ormoni agiscono favorendo l’assorbimento e il metabolismo di Aa differenti
CONTROLLO DELLA SECREZIONE
a valori normali di glicemia 80÷90 mg/100ml la secrezione di
insulina è minima 25 ng/min/kg di peso
quando la conc. di glucosio plasmatico sale di 2-3 volte rispetto al valore normale la secrezione dell’ormone aumenta in due fasi distinte
l’aumento della conc. plasmatica di insulina indotta dal glucosio può
arrivare ad essere anche 400÷600 volte superiore rispetto al basale,
quindi un aumento drammatico che ricade altrettanto rapidamente
quando la conc. di glucosio torna ai valori di digiuno
GLUCAGONE E LE SUE FUNZIONI
Glucagone
Diminuzione di glucosio nel sangue
il glucagone, secreto dalle cellule a
ha effetti diametralmente opposti a
quelli dell’insulina
liberazione di glucagone
Si lega ai recettori di membrana
Attivazione dell’adenilato ciclasi
Aumento di cAMP, attivazione della
chinasi cAMP-dipendente
Attivazione della
glicogeno fosforilasi
l’effetto principale è quello di far
aumentare il tasso glicemico
come l’insulina il glucagone è un
grosso polipeptide PM 3490 costituito
da una catena di 29 Aa
Inibizione della
glicogeno sintetasi
Degradazione di glicogeno a glucosio
Rilascio di glucosio nel sangue
per le sue proprietà di aumentare la
glicemia viene indicato come fattore
IPERGLICEMIZZANTE
il GLUCAGONE
Ormone peptidico di 29 aa
Sintetizzato dalla cellule a
PARASIMPATICO
aumento
gluconeogenesi
epatica
aumento
glicogenolisi
epatica
aumento
GLICEMIA
aumento
lipolisi
118
Risposta
endocrina
all’ipoglicemia
119
Effetto del glucagone sul flusso
totale dei substrati energetici
GLICOGENO
glucosio
Glucosio-6-P
amino
acidi
glucosio
acidi
grassi
liberi
chetoacidi
Tessuto
adiposo
120
EFFETTI SUL METABOLISMO DEL
GLUCOSIO
_1_AUMENTO DELLA GLICOGENOLISI
Glycogen
phosphorylase
active
121
122
_2_AUMENTO DELLA GLUCONEOGENESI
_3_AUMENTO DELLA LIPOLISI
Effetto stimolante dell’attività fisica
L’aumento dell’attività fisica induce l’aumento della secrezione
del glucagone, anche se non se ne conosce la causa questo effetto
ha il vantaggio di impedire l’abbassamento della glicemia
durante lo sforzo muscolare
ALTRI ORMONI IPERGLICEMIZZANTI
Altri ormoni che aumentano la glicemia:
GH ormone della crescita dall’ipofisi anteriore
Cortisolo dalla corteccia surrenale
Adrenalina dalla midollare del surrene
Gh e Cortisolo inibiscono l’utilizzazione di glucosio
favorendo quella dei grassi
L’Adrenalina aumenta la glicogenolisi epatica e stimola la
lipasi ormono sensibile sul tessuto adiposo
Glucocorticoidi e cortisolo
• Sotto controllo di ACTH ipofisario
– Ritmo diurno (10x la mattina vs la sera)
– Proteina di trasporto: Cortisol binding protein (CBG)
– T1/2=100 min
• EFFETTI:
– Aumento di gluconeogenesi, glicogenolisi, lipolisi, biosintesi
proteica (come glucagone, ma più lento)
• Può causare diabete (diabete surrenalico)
– Soppressione di risposta immunitaria ed infiammatoria
(specialmente cortisone)
• PATOLOGIE PRINCIPALI
– Morbo di Addison: insufficienza surrenalica ipoglicemia,
intolleranza a stress, debolezza, ipotensione
– Sindrome di Cushing: eccesso di glucorticoidi (somministrazione
farmacologica o adenoma delle surrenali) iperglicemia,
catabolismo delle proteine, perdita di massa corporea
Effetti del cortisolo sui
flussi energetici
•facilita la mobilizzazione
di nutrienti (catabolico)
•mantiene la produzione
di glucosio dalle proteine
•facilita il metabolismo
dei grassi
STIMOLA
INIBISCE
127
Effetti dell’adrenalina sul metabolismo
Aumentata glicogenolisi nel fegato e nel muscolo
• Aumentata lipolisi nel tessuto adiposo
• Diminuita secrezione di insulina
• Aumentata secrezione di glucagone
128
129
Depositi di
grasso
GH
glucagone
adrenalina
cortisolo
insulina
insulina
Carboidrati
della dieta
Glucosio
nel sangue
insulina
metabolismo
del cervello
glucagone
adrenalina
Glicogeno
muscolare
e proteine
Acidi grassi liberi e
glicerolo nel sangue
FEGATO
gluconeogenesi
Sintesi di glicogeno
glicogenolisi
cortisolo
insulina
aminoacidi
nel sangue
SOMATOSTATINA
Le cellule Delta delle isole del Langherans secernono somatostatina
che è un piccolo polipeptide di 14 Aa con una emivita nel sangue di
soli 3 minuti
Tutti i fattori correlati all’ingestione di cibo possono indurre la
secrezione della somatostatina
Aumento della glicemia
Aumento del tasso ematico di aminoacidi
Aumento degli acidi grassi
Aumento della concentrazione di vari ormoni gastrointestinali
131
A sua volta la somatostatina ha vari effetti inibitori
Agisce all’interno delle stesse isole del Langherans inibendo la
secrezione dell’insulina e del glucagone
Riduce la motilità dello stomaco, della cistifellea e del duodeno
Riduce l’attività secretoria e di assorbimento in tutto il tratto
gastroinestinale
Impedendo la secrezione di insulina e di glucagone riduce l’utilizzo ed il
rapido esaurimento dei nutrienti assorbiti rendendoli disponibili per più
tempo
La somatostatina viene secreta anche dall’ipotalamo come ormone
inibitore dell’ormone della crescita che va ad inibire la secrezione di
ormone Somatotropo dall’adenoipofisi
132
CLASSIFICAZIONE DEL DIABETE MELLITO
Diabete mellito insulino-dipendente (IDDM o di tipo I)
Diabete mellito non insulino dipendente (NIDDM o di tipo II)
Diabete mellito gravidico
FORME SPECIFICHE
Diabete giovanile insorgente in età adulta (MODY)
Mutazioni del recettore dell’insulina
Dabete tropicale (pancreatite cronica associata a fattori tossici o
nutrizionali)
Diabete secondario a interventi chirurgici o a pancreatite
Diabete secondario a sindromi genetiche
Diabete secondario a endocrinopatie.
Diabete ipofisario e diabete surrenalico
133
- Controllo della Glicemia - diabete
134
TERAPIA INSULINICA
Le preparazioni insuliniche possono essere classificate in funzione
della loro durata d’azione in composti a:
Breve durata d’azione
Intermedia durata d’azione
Lunga durata d’azione
E in funzione della specie di origine in:
Derivati umani
Derivati suini
Derivati bovini
135
DOSAGGIO IN UNITA’
A scopo terapeutico le dosi e le concentrazioni di insulina
sono espresse in Unità.
Un’unità è equivalente alla quantità di ormone richiesta per
ridurre a digiuno nel coniglio la concentrazione
plasmatica di glucosio a 45 mg/dl
Lo standard internazionale è una miscela di insuline di origine bovina
e suina contenente 24U/mg, oggi queste sono state sostituite dalle
forme umane ricombinanti per evitare la formazione di anticorpi
136
FABBISOGNO GIORNALIERO
La produzione di insulina in un soggetto normale è
compresa tra 18 e 40 Unità pari a circa 0.5-1 Unità /Kg
peso corporeo, dopo carico di glucosio orale può
arrivare a circa 6 U/Kg
137
SULFANILUREE
ANALOGHI DI PRIMA GENERAZIONE
• Tolbutamide
• Clorpropamide
• Tolazamide
• Acetoesamide
ANALOGHI DI SECONDA GENERAZIONE
• Gilburide
• Glipizide
• Glicazide
138
SULFANILUREE
Stimolano la secrezione di insulina dalle cellule β del
pancreas
Incremantano la concentrazione di insulina
riducendone la clearance epatica
La somministrazione cronica però riporta i livelli di
insulina pari a quelli prima del trattamento (per
desensibilizzazione dei recettori)
Stimolano anche il rilascio di somatostatina e possono
inibire lievemente la secrezione di glucagone
139
140
•Meglitinidi Repaglinide
Nateglinide
•Aumento rilascio di insulina da
cellule beta
• recettore canale K+
• sito distinto da SU
• Azione più rapida di SU
• Glucosio-dipendente
• Breve emivita (1.5 h)
• Mitiglinide: in sperimentazione
141
USI CLINICI
• Diabete II tipo in pazienti che non riescono a
tenere sottocontrollo la glicemia con la sola
dieta
• Associazione con insulina in alcuni pazienti con
diabete I tipo, sfruttando la capacità delle
sulfaniluree di aumentare la sensibilità
all’insulina
• Dose giornaliera abituale di tolbutamide è di
500 mg, mentre la dose massima efficace è di 3 g
142
BIGUANIDI
Metmorfina e fenformina
Sono anti-iperglicemizzanti, non inducono il rilascio di
insulina dal pancreas, ne provocano ipoglicemia
Non hanno effetti sulla produzione di cortisolo e
glucagone
Aumentano la sensibilità dei tessuti all’insulina.
Riducono la gluconeogenesi
143
•Biguanidi
Meccanismo d’azione
•Attivazione protein chinasi AMP dipendente (AMPK)
•Riduzione biosintesi/Aumento ossidazione acidi grassi
•Riduzione sintesi VLDL
•Riduzione gluconeogenesi epatica
•Aumento captazione glucosio/glicolisi
•Riduzione assorbimento intestinale del glucosio
•Disaccoppiamento fosforilazione ossidativa
•Non modificato il rilascio di insulina
•euglicemizzanti piuttosto che ipoglicemizzanti
•Riduzione glicemia a digiuno: 50-70 mg/dl
•Riduzione HbA1c: 1.5-2.0 %
144
AMPK: protein chinasi
AMP dipendente
ACC: Acetil CoA
Carbossilasi
SERPB-1: Sterol
Regulating Element
Binding Protein-1
145