Empoli, 17 Dicembre 2009
La sperimentazione clinica:
attori e risorse coinvolti
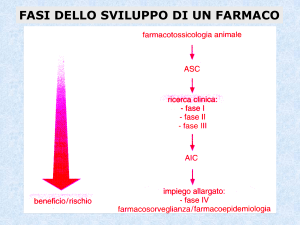
Fasi della sperimentazione farmacologica
preclinica
Dr.ssa Silvia Benemei
Dipartimento di Farmacologia Preclinica e Clinica
Università di Firenze
FASI NELLO SVILUPPO DI NUOVI FARMACI
Studi Preclinici
Ricercatori e Scopi
della Ricerca
Sintesi di Nuovi
Composti Chimici
Test in vitro e in
Animali. Scelta
del farmaco
Formulazione,
Sintesi in Larga
Scala, Sicurezza
negli Animali
Sottomissione
dei Dati alla
FDA
Studi Clinici
Il Farmaco È
Commercializzato
Esame della
FDA
NDA (New Drug
Application)
Fase III: Trial
Clinici su Molti
Pazienti
Fase II: Studi su
Pazienti
(Efficacia)
Fase I: Studi su
Soggetti Sani
(Tolleranza)
Lombardino and Lowe, 2004
OBIETTIVI DELLA RICERCA PRECLINICA:
• Individuazione di una molecola dotata di attività
farmacologica
• Valutazione delle caratteristiche (stabilità, durata
d’azione)
• Individuazione della formulazione per una o più
vie di somministrazione
• Valutazione della sicurezza
COME SI INIZIA ?
Individuazione di una molecola dotata di attività farmacologica
1. IL CASO
“SERENDIPITY” Scoprire una cosa non cercata, ed imprevista mentre se ne
sta cercando un’altra.
“La serendipity è cercare un ago in un pagliaio e trovarci la figlia del
contadino” Julius H. Comroe
Nel luglio del 1928 Alexander Fleming
studiò una coltura di staphilococcus aureus
scoprendo la Penicillina
FINALITA’ DELLO STUDIO PRECLINICO:
Accertare
• Efficacia
•Tollerabilità
•Effetti tossici
di un nuovo composto
INDAGINE PRECLINICA:
Indispensabile prima di procede alla sperimentazione
sull’uomo
Va eseguita attenendosi a norme speciali emanate dalle
istituzioni pubbliche
Prevede l’impiego degli animali per la sperimentazione dei
farmaci
SPERIMENTAZIONE PRECLINICA:
Durata media 2-3 anni
• Consente di isolare dalle migliaia di sostanze sottoposte al primo
screening di base farmacologico e biochimico, 20-30 composti
• Nel corso della sperimentazione preclinica vengono identificate le
strutture chimiche correlate ad una certa azione farmacologica:
IL NUMERO DELLE SOSTANZE ESAMINATE
DIMINUISCE ULTERIORMENTE
PROCESSO DI SCOPERTA E SVILUPPO
DI NUOVI FARMACI
ricerca di base
Sviluppo preclinico
MODELLI SPERIMENTALI PER DEFINIRE PROFILO
FARMACOLOGICO DI UN COMPOSTO
“IN VITRO” e “EX VIVO”
LIVELLO MOLECOLARE:
Legame recettoriale
Attività enzimatica
Biotrasformazione
“IN VIVO”
MODELLI ANIMALI:
Animali sani (topo, ratto,cane, gatto,
coniglio, cavia, maiale)
Animali che riproducono la malattia
LIVELLO CELLULARE:
Colture cellulari
Organi isolati (vasi cuore polmoni ileo utero etc.)
RUOLO DEI MODELLI CELLULARI
NELLO SVILUPPO PRECLINICO DI UN
FARMACO
STUDI “IN VITRO”
• Colture cellulari primarie derivanti da tessuti animali (Neuroni, epatociti,
linfociti, macrofagi, cardiomiociti, oociti, cellule renali)
• Cellule transfettate con proteine bersaglio dell’azione dei farmaci (HEK 293,
CHO transfettate con specifici recettori, canali ionici, trasportatori ionici, pompe
ioniche, enzimi)
• Cellule umane neoplastiche (linfomi, tumori del colon, polmone)
RUOLO DEI MODELLI ANIMALI
NELLO SVILUPPO PRECLINICO DI UN FARMACO
STUDI “IN VIVO”
• ANIMALI TRANSGENICI
• ANIMALI “KNOCKOUT”
• ANIMALI GENETICAMENTE SELEZIONATI PER UNA PATOLOGIA
• ANIMALI SOTTOPOSTI A TRATTAMENTI CHE RIPRODUCONO LA
MALATTIA
STUDI PRECLINICI
FASE I
STUDI DI FARMACODINAMICA
STUDI DI TOSSICITA’ ACUTA
STUDI DELLA STABILITA’ CHIMICA DI UNA MOLECOLA
FASE II
STUDI DI FARMACOCINETICA
STUDI DI TOSSICITA’ SUBACUTA E CRONICA
STUDI TOSSICOLOGICI SULLA RIPRODUZIONE,
CANCEROGENICITA’ e MUTAGENESI
FASE I
STUDI DI FARMACODINAMICA
Obiettivi:
Determinazione dell’effetto principale
Determinazione degli effetti collaterali
Determinazione della durata dell’effetto farmacologico
Studi “in vivo” e “in vitro” per ottenere dati
quantitativi (curve dose/effetto o tempo/effetto)
I risultati rappresentano il profilo di attività farmacologica della sostanza
anche su organi e sistemi non direttamente interessati all’azione primaria
ma potenzialmente bersaglio di effetti collaterali
PROVE FAMACOLOGICHE (1)
“In Vivo”
SNC (interferenze sulla t corporea, risposta a stimoli sensori)
ATTIVITA’ MOTORIA (attività locomotoria e coordinazione motoria)
APPARATO CARDIOVASCOLARE
Pressione arteriosa
Frequenza cardiaca
Risposte vasomotorie
Prove di tollerabilità cardiovascolare per varie vie di somministrazione
APPARATO RESPIRATORIO (frequenza,volume corrente, resistenze bronchiali,
gas ematici)
APPARATO GASTRO-INTESTINALE
(transito intestinale, potere ulcerogeno, secrezione gastrica, motilità gastrica)
SISTEMA IMMUNITARIO (effetti immunosoppressivi)
PROVE FAMACOLOGICHE (2)
“In Vitro” e “Ex Vivo”
SISTEMA CARDIOVASCOLARE (Cuore isolato Vasi isolati)
SANGUE (emolisi in vitro, coagulazione)
FUNZIONALITA’ (analisi delle urine)
SNA e MUSCOLATURA LISCIA (intestino, bronchi, utero
ileo isolato, vasi deferenti isolati, trachea isolata)
SISTEMA RIPRODUTTIVO (utero isolato, motilità uterina in situ)
STUDI DI TOSSICITA’ ACUTA
DEFINIZIONE:
“Effetti collaterali insorgenti dopo “breve” tempo dall’assunzione
di una dose singola di sostanza o di più dosi assunte nell’arco di 24 ore”
Somministrazione unica (acuta) del principio attivo su due o più specie di
mammiferi
Dosi somministrate: - Ci si riferisce a parametri già noti quando possibile
- Se si tratta di una sostanza non nota o complessa
si procede per tentativi
Vie di somministrazione: due diverse vie di somministrazione una delle quali
identica o simile a quella proposta nell’uomo, mentre l’altra deve garantire il
completo assorbimento sistemico del farmaco.
STUDI DI TOSSICITA’ ACUTA
Durata dello studio è circa 14 gg e comunque mai inferiore a 7 gg e può
proseguire per tutto il tempo in cui persistono gli effetti tossici
Il periodo di osservazione deve essere adeguato a mettere in luce i danni ai
tessuti e agli organi, oppure il ritorno alla norma delle condizioni dell’animale
Ottenere dati su relazione:
DOSE/EFFETTO e DOSE/MORTALITA’ per la valutazione quantitativa della
DOSE LETALE (DL50)
Dose letale media (DL50): quantità di farmaco, in unità di peso o volume
per unità di peso corporeo (es mg/Kg), che somministrata ad un gruppo
di animali per una determinata via ed in definite condizioni sperimentali,
produce la morte del 50% degli animali.
STUDI DI TOSSICITA’ ACUTA
BATTERIE DI TEST UTILIZZATI:
Tossicità orale
Tossicità dermica
Tossicità inalatoria
Tossicità oculare
DETERMINAZIONI:
Segni clinici di tossicità
Mortalità a determinati intervalli
Esame autoptico degli animali deceduti e di quelli sacrificati
Esame istopatologico degli organi
FASE II
STUDI DI FARMACOCINETICA
assorbimento
distribuzione (organotropismo)
metabolismo (biotrasformazione)
escrezione
Strumenti: Animali in toto vivi (es. sostanze marcate)
Finalità:
Delineare strategia terapeutica mirata:
esaltare l’azione farmacologica/ridurre la tossicità
STUDI DI TOSSICITA’ SUBACUTA E CRONICA
DEFINIZIONE:
“Effetti collaterali insorgenti dopo l’assunzione di almeno 3 dosi della
sostanza (SUBACUTA) o dopo somministrazioni ripetute (CRONICA)”
STUDI DI TOSSICITA’ SUBACUTA E CRONICA
Le prove di tossicità per somministrazioni ripetute (tossicità subacuta o a breve
termine e tossicità cronica o a lungo termine) devono mettere in evidenza le
soglie di tossicità, le alterazioni funzionali e/o anatomo-patologiche conseguenti
alla somministrazione ripetuta del farmaco o dell’associazione e stabilire le
condizioni della comparsa di tali alterazioni in funzione della posologia.
La valutazione degli effetti tossici viene effettuata in base al rilievo della mortalità,
all’esame del comportamento, dell’accrescimento della crasi ematica e di prove
funzionali a carico di diversi organi ( cuore, fegato, rene, milza etc.) nonché in base
a reperti autoptici con relativi esami istologici.
TOSSICITA’ SUBACUTA
Tossicità subacuta: durata compresa tra 30 e 90 gg. Non superiore al 10%
della durata media della vita dell’animale.
Le sperimentazioni vengono effettuate:
• Somministrando 3 dosi a gruppi diversi di animali
• Utilizzando due specie di mammifero
TOSSICITA’ SUBACUTA
I gruppi sperimentali saranno 3 (uno per ciascun livello di dose), cui va aggiunto il
gruppo di controllo.
La dose più elevata viene scelta in modo da far comparire effetti tossici d’organo
o mortalità in non più del 10% degli animali.
La dose minore permette di fissare il margine di tolleranza del prodotto
nell’animale e va scelta in base alla capacità di ottenere l’effetto farmacologico
La dose intermedia è la media fra la dose maggiore e la minore.
Si evitano dosi a cui corrisponde una mortalità superiore del 10%.
Le dosi vanno opportunamente distanziate in modo da avere una
gradualità negli effetti tossici
TOSSICITA’ SUBACUTA
VIE DI SOMMINISTRAZIONE:
Orale
Inalatoria
Dermica
DETERMINAZIONI:
Comportamento e stato di salute dell’animale (Peso
corporeo,Consumo di cibo)
Parametri ematologici, biochimici ed urinari
Peso degli organi e valutazioni istopatologici
TOSSICITA’ CRONICA
•
Durata dipendente dalle condizioni di applicazione clinica (da 3 a 12 mesi)
•
Le dosi vengono stabilite in modo che:
la dose maggiore dia segni di tossicità
la dose minore sia ben tollerata e se possibile, sia da 2 a 10 volte superiore a quella
giornaliera prevista per l’uso terapeutico in clinica umana
la dose intermedia sia la minima dose in grado di indurre il primo chiaro effetto
tossico
GLI STUDI DI TOSSICITA’ POSSONO CONTINUARE ANCHE
DURANTE DELLA SPERIMENTAZIONE CLINICA
ESAME DELLA FUNZIONE RIPRODUTTIVA
OBIETTIVI:
-
Mettere in rilievo le modifiche della fertilità o procreazione anomala
dovuta a danni dei gameti maschili e o femminili
-
Interferenze con le fasi di impianto del feto e del suo sviluppo
-
Effetti tossici sull’embrione
-
Effetti tossici sul feto
ESAME DELLA FUNZIONE RIPRODUTTIVA
OBIETTIVI:
-
Mettere in rilievo le modifiche della fisiologia materna con conseguenti effetti
tossici secondari sull’embrione o sul feto
-
Effetti sulla crescita oppure sullo sviluppo dell’utero o della placenta
-
Interferenze con il parto
-
Effetti sullo sviluppo postnatale
-
Effetti tardivi sulla discendenza
ESAME DELLA FUNZIONE RIPRODUTTIVA
ANIMALI UTILIZZATI: Due specie animali
MODALITA’ CON CUI VENGONO CONDOTTI GLI STUDI
Somministrazione del composto a maschi e femmine prima dell’accoppiamento
durante la gravidanza e l’allattamento
Viene seguito lo sviluppo dei nuovi nati fino al loro nuovo accoppiamento per
giungere ad una successiva generazione
STUDI DI CANCEROGENICITA’
SCELTA DELLE DOSI:
-
La dose massima deve esercitare almeno un effetto tossico oppure una
tossicità minima a livello di organo bersaglio
-
La dose minima deve essere pari al doppio o al triplo della dose terapeutica
massima per l’uomo o della dose che produce un effetto farmacologico
nell’animale
-
La dose intermedia è la media tra la massima e la minima
FINALITA’ DEGLI STUDI FARMACOLOGICI e
TOSSICOLOGICI
Definire la dose massima che non induce alcun effetto diretto ed
indiretto su organi e tessuti
Definire la dose che induce effetti tossici ed il tipo di alterazioni indotte
Definire la relazione tra dose terapeutica e dose tossica
Individuare il bersaglio dell’effetto tossico ( struttura cellulare, organo,
sistema) sia del composto originale che dei suoi metaboliti
Definire se gli effetti sono reversibili
LIMITI DELLE PROVE PRECLINICHE
TEMPI E COSTI
ANIMALI
DATI DI TOSSICITA’ NON COMPLETAMENTE ATTENDIBILI
EVENTI AVVERSI
DOCUMENTAZIONE
SCOPO DELLA RICERCA E CONDIZIONI SPERIMENTALI
RACCOLTA DI METODICHE STANDARD (SOP)
RISULTATI E DETTAGLI DEGLI ESPERIMENTI
FASI NELLO SVILUPPO DI NUOVI FARMACI
Studi Preclinici
Ricercatori e Scopi
della Ricerca
Sintesi di Nuovi
Composti Chimici
Test in vitro e in
Animali. Scelta
del farmaco
Formulazione,
Sintesi in Larga
Scala, Sicurezza
negli Animali
Sottomissione
dei Dati alla
FDA
Studi Clinici
Il Farmaco È
Commercializzato
Esame della
FDA
NDA (New Drug
Application)
Fase III: Trial
Clinici su Molti
Pazienti
Fase II: Studi su
Pazienti
(Efficacia)
Fase I: Studi su
Soggetti Sani
(Tolleranza)
Lombardino and Lowe, 2004
La sperimentazione clinica:
attori e risorse coinvolti
Fasi della sperimentazione farmacologica clinica
Dr.ssa Silvia Benemei
Dipartimento di Farmacologia Preclinica e Clinica
Università di Firenze
Le dimensioni dello sviluppo
Lo sviluppo di un farmaco
Tempi dello sviluppo clinico
Tempi dello sviluppo clinico
Nature Drug Reviews, 2004
Costi dello sviluppo
Nature Drug Reviews,
Reviews 2004
Costi dello sviluppo
Nature Drug Reviews,
Reviews 2004
Critical Path Initiative
(www.fda.gov)
(www.emea.europa.eu)
(www.agenziafarmaco.it)
Report Studi Clinici
Fase I
Fase II
Fase III
Fase IV