La via per accelerare i processi biologici
ENZIMI
Sono delle proteine altamente specializzare con attività catalitica, accelerano le
reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La loro struttura, come quella delle proteine, è molto complessa e caratterizzata da
una ben precisa configurazione tridimensionale con ripiegamenti, rientranze e
sporgenze.
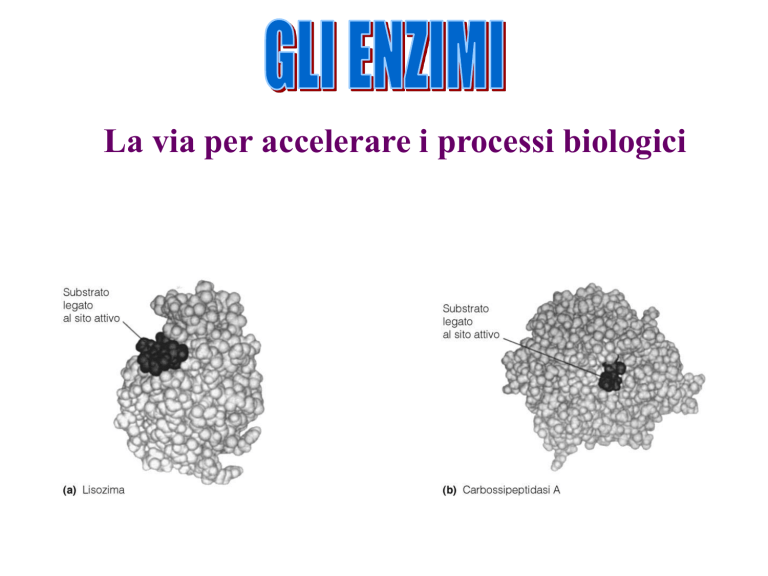
Il sito attivo dell’enzima è un regione (estremamente piccola della molecola) a
forma di fessura o di tasca che istaura legami con il substrato. E’ costituito da pochi
residui di amminoacidi con una configurazione spaziale ben definita,
complementare a quella del substrato con cui interagisce.
Per l’interazione enzima substrato è stato suggerito il modello chiave serratura:
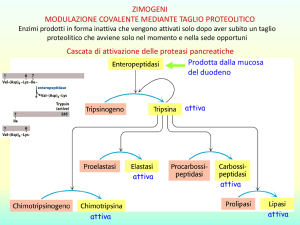
La maggior parte degli enzimi portano nella loro molecola una parte non proteica.
In questo caso l’enzima intero prende il nome di oloenzima,
la componente proteica di apoenzima,
la non proteica di gruppo prostetico
Se il gruppo prostetico è facilmente dissociabile dall’apoenzima esso prende il nome di
coenzima.
La nomenclatura e la classificazione degli enzimi si basa sul tipo di reazione catalizzata, si hanno
così 6 classi di enzimi:
All’interno delle classi gli enzimi vengono generalmente classificati in base al nome del
substrato specifico
DIFFERENZE TRA ENZIMI E CATALIZZATORI INORGANICI
Gli enzimi si distinguono dai comuni catalizzatori inorganici per le seguenti significative
caratteristiche:
Peso
molecolare
Specificità
Potere
catalitico
A differenza dei catalizzatori della chimica inorganica che sono composti
molto semplici spesso anche semplici atomi, gli enzimi sono molecole
proteiche e, pertanto, espressione dei geni. Sono caratterizzati da un peso
molecolare molto alto e da una configurazione tridimensionale piuttosto
complessa, articolata nelle quattro strutture proprie delle proteine.
Diversamente dai catalizzatori inorganici che molto spesso si
comportano da pas-partout e catalizzano numerose reazioni anche
molto diverse tra loro, gli enzimi sono altamente specifici sia verso
il substrato sul quale agiscono, sia verso il tipo di reazione che
catalizzano. La maggior parte di enzimi agisce su di un unico
substrato o su un numero molto limitato di composti.
Gli enzimi accelerano le reazioni almeno di un milione di volte.
ENERGIA DI ATTIVAZIONE
Perché una reazione chimica possa avvenire, si devono rompere i legami preesistenti e si
devono eventualmente formare nuovi legami.
Consideriamo una popolazione di molecole R-X che devono reagire per formare il prodotto R+
X-.
Affinché una reazione chimica avvenga è necessario:
• le molecole si urtino
• urto efficace, nel senso che le molecole che si urtano devono avere un contenuto energetico
tale da permettere loro di formare il complesso attivato (R+--- X -) ad alto contenuto
energetico e bassa stabilità.
Il livello energetico a cui è localizzato il complesso attivato si chiama stato di transizione.
La differenza di energia tra i reagenti e lo stato
di transizione viene detta energia di attivazione
(Ea).
Ea rappresenta quindi una barriera energetica che i
reagenti devono superare per trasformarsi nei
prodotti.
Il tutto può essere simpaticamente rappresentato come un sasso (reagente) che per arrivare a
valle (prodotto) deve superare la montagna (Ea)
Maggiore è il numero di molecole R-X capaci di
formare, nell’unità di tempo, il complesso attivato
maggiore sarà la velocità di reazione.
La velocità di reazione è definita come la quantità di sostanza
consumata o prodotta nell’unità di tempo:
v = dc/dT
Una reazione chimica può essere accelerata aumentando la temperatura. Infatti
aumentando la T aumenta l’energia cinetica delle particelle
aumenta il numero
degli urti efficaci tra le molecole
un maggior numero di particelle, nell’unità di tempo,
formerà il complesso attivato.
CATALISI ENZIMATICA
Un altro modo per accelerare una reazione è quello di aggiungere un enzima (E). E si lega
alle molecole R-X per formare il complesso attivato (E-R+---X-) il cui stato di transizione è
più basso rispetto a quello della reazione non catalizzata. Così alcune molecole di R-X che
prima non erano in grado di reagire, adesso legandosi a E entrano nello stato di transizione (più
basso) per formare i prodotti.
Gli Enzimi catalizzano tutte le reazioni che
avvengono nell’ambiente cellulare dove le
condizioni di temperatura e concentrazione
esistenti
comporterebbero
tempi
di
reazione molto lunghi.
Come si misura la velocità di una reazione catalizzata
La velocità di reazione è definita come la quantità di sostanza consumata o prodotta
nell’unità di tempo.
Un altro modo per esprimere la velocità di una reazione catalizzata è il
numero di turnover. Esso indica il numero di molecole di substrato che
reagiscono con una sola molecola di enzima nell’unità di tempo. La velocità
di reazione cambia da enzima ad enzima ed è caratteristica di ognuno di
essi.
Concentrazione
[P]
[S]
vo
Andamento nel tempo di una reazione
enzimatica misurata come comparsa del
prodotto (P) o scomparsa del substrato (S).
La linea tratteggiata tangente alla curva
rappresenta la velocità iniziale v0
Tempo
All’inizio quando è praticamente presente tutto il substrato la velocità segue un andamento rettilineo (v0), a mano a mano
che il substrato viene consumato la velocità rallenta fino a raggiungere un plateau quando tutto il substrato è stato
convertito in prodotto.
La velocità di una reazione catalizzata è influenzata dai
seguenti fattori
Concentrazione del substrato
Concentrazione dell’enzima
Temperatura
pH
Inibitori
CONCENTRAZIONE DEL SUBSTRATO
A parità di altre condizioni (temperatura,
concentrazione di enzima, pH, ecc.) riportando in
grafico la concentrazione di substrato in funzione
della v0 si ottiene una curva iperbolica.
Si osserva che, nel primo tratto della curva
(rettilineo) la v0 è direttamente proporzionale alla
concentrazione di substrato (aumentando la
concentrazione di S aumenta proporzionalmente il
numero di molecole che formano il complesso ES).
Una volta raggiunta una certa concentrazione di S la
v0 cresce più lentamente fino a raggiungere un
valore massimo quando tutto l’enzima è saturato dal
substrato e pur continuando ad aumentare la
concentrazione di S la v0 rimane costante (Vmax).
E’ possibile risalire alla velocità di una reazione enzimatica dall’equazione v0= Vmax
[S] / [S] + Km proposta dai due studiosi Michaelis e Menten. Nell’equazione, v è la
velocità di reazione, Vmax la velocità massima, [S] la concentrazione del substrato e
Km è la costante di Michaelis-Menten.
Km corrisponde alla concentrazione di S alla quale la velocità è = Vmax/2
Equazione di Michaelis-Menten
Vmax [S]
v0 =
Km + [S]
A basse concentrazioni di substrato, quando [S] è molto più piccola di Km e quindi trascurabile,
si ha
v0 = Vmax [S] / Km cioè, la velocità è direttamente proporzionale alla concentrazione del substrato.
Ad alte concentrazioni di substrato, quando [S] è molto più grande di Km, Km diventa
trascurabile e si ha
v0 = Vmax, cioè, la velocità è la massima, indipendentemente dalla
concentrazione del substrato.
I valori di Km variano moltissimo da enzima ad enzima ed esprimono l’affinità che l’enzima ha per il
substrato. Osservando la posizione di Km sul grafico velocità contro concentrazione di substrato, si
può notare che se Km è bassa, in ogni istante è necessaria una bassa concentrazione di substrato
per saturare metà delle molecole di enzima e questo è segno di alta affinità dell’enzima per il
substrato, mentre se Km è alta, occorre una più alta concentrazione di substrato per saturare metà
delle molecole di enzima in ogni istante e questo vuol dire che l’enzima presenta bassa affinità per
il substrato. Il valore di Km è indipendente dalla concentrazione dell'enzima e dalla concentrazione
del substrato.
Per un calcolo più accurato della Vmax e della Km è opportuno trasformare
matematicamente l’equazione di Michealis-Menten facendo il reciproco di
entrambi i lati dell’equazione
Vmax [S]
v0 =
Km + [S]
…………
1
v0
=
KM
1
Vmax
[S]
+
1
Vmax
Si ottiene il grafico dei doppi reciproci (o grafico di Lineweaver-Burk) mediante il
quale la curva iperbolica viene convertita in una retta
CONCENTRAZIONE DELL’ENZIMA
Km è indipendente dalla concentrazione
dell’enzima
v0
La velocità iniziale v0 di una reazione
enzimatica è direttamente proporzionale alla
concentrazione dell’enzima.
5
Unità enzimatica: quantità di enzima capace
di trasformare una mmole di S in 1 minuto a
25 °C nelle condizioni ottimali del saggio.
È quindi possibile misurare l’attività di un enzima
(cioè la sua concentrazione espressa come unità per
volume o per g di peso fresco o secco) mediante una
misura della Vo ed in particolare della Vmax. Tali
misure si effettuano utilizzando una concentrazione
saturante di substrato ( 5 volte la Km quando la
vo=Vmax) e monitorando la reazione nei primi
minuti, quando tutto il substrato è praticamente
disponibile.
TEMPERATURA
La velocità delle reazioni enzimatiche varia col
crescere della temperatura secondo il grafico a
campana riportato. Si può osservare che,
inizialmente, la velocità cresce al crescere della
temperatura,
raggiunge
un
massimo
in
corrispondenza di una certa temperatura definita
ottimale, si riduce, in seguito, per effetto della
denaturazione dell’enzima.
pH
Come la variazione della temperatura, in
modo un poco più complesso, anche la
variazione del pH influenza la velocità
delle reazioni enzimatiche. Anche in
questo caso, la curva presenta un
andamento a campana e l’attività
enzimatica manifesta un massimo in
corrispondenza di un valore definito pH
ottimale legato alla natura del substrato.
Inibitori
In molti casi, molecole specifiche o ioni possono competere con le molecole di substrato nel
legarsi con l’enzima ed inibire l’attività dell’enzima.
L’inibizione può essere irreversibile e reversibile.
IRREVERSIBILE
E’ irreversibile quando l’inibitore si va a legare al sito catalitico dell’enzima con un legame
molto forte, impedendo l’accesso del substrato.
I+E
Ki
EI inattivo
Un esempio di inibizione irreversibile è dato dall’azione dei gas nervini che bloccano
l’azione dell’enzima acetilcolinesterasi, un enzima che ha un ruolo importantissimo nella
trasmissione degli impulsi nervosi.
REVERSIBILE
L’inibizione reversibile può essere competitiva, quando gli inibitori sono, da un
punto di vista chimico, molto simili alle molecole di substrato e si legano agli
stessi siti attivi, e non competitiva, quando gli inibitori si legano a siti dell’enzima
diversi da quelli che legano il substrato e, pertanto, possono legarsi sia all’enzima
che al complesso ES.
COMPETITIVA
L’inibitore possiede una struttura molto simile a quella
del substrato la similitudine porta il substrato e
l’inibitore a competere per lo stesso sito attivo
dell’enzima. L’esito della competizione dipende dalla
concentrazione delle due molecole che si contendono il
sito attivo
Può essere completamente rimossa aumentando
notevolmente la concentrazione di substrato
NON COMPETITIVA
L’inibitore si lega all’enzima in una zona diversa da
quella del sito attivo dando luogo al complesso EI
inattivo. Il legame dell’inibitore deforma la
conformazione spaziale dell’enzima ed il suo sito
catalitico pur potendosi legare al substrato risulta
inattivo.
E’ possibile distinguere la inibizione competitiva da quella non
competitiva
1/Vmax
1/Vmax
In presenza di inibitore per ottenere la
stessa velocità di reazione che in sua
assenza, è necessario aumentare la
concentrazione di substrato. La Vmax
rimane invariata (infatti a concentrazione
elevata di substrato tutta l’inibizione
viene rimossa) mentre la Km aumenta 1/Km diminuisce.
A qualsiasi
concentrazione
di
substrato la velocità di reazione in
presenza di inibitore è sempre minore
che in sua assenza. Quindi la Vmax
diminuisce
1/Vmax aumenta,
mentre la Km rimane costante.
Biosensori
Dr. Giulia Volpe
Prof. Giuseppe Palleschi
Dipartimento Scienze e Tecnologie Chimiche
Università di Roma Tor Vergata
La chimica può essere divisa in 5 grandi aree
Chimica analitica
Chimica biologica
Chimica fisica
Chimica inorganica
Chimica organica
Chimica analitica:
Sviluppo di nuovi metodi di analisi
Un’area della chimica analitica è la sensoristica:
un suo specifico settore è lo sviluppo ed applicazione
di sensori chimici, biosensori ed immunosensori
per applicazioni nel settore clinico, alimentare ed ambientale.
Biosensore
Strumento analitico in cui è presente un elemento biologico
strettamente connesso o integrato con un trasduttore di segnale.
Il materiale biologico è rappresentato da uno o piu’ enzimi,
anticorpi, batteri, cellule, tessuti viventi animali o vegetali che
interagiscono con il substrato che si vuole determinare e sono
responsabili della specificità del sensore.
L’interazione del materiale biologico con l’analita da determinare
genera un segnale che può essere di tipo
elettrochimico
potenziometrici
amperometrici
luminoso (biosensori ottici)
calorico (biosensori termici)
variazione di massa (biosensori piezoelettrici)
Analyte
Biological
component
Transducer
Electronics
Biosensori elettrochimici
Offrono le migliori garanzie per le applicazioni analitiche in
termini di sensibilità, riproducibilità e selettività.
Sono relativamente facili da assemblare.
Possono essere inseriti in celle a flusso per effettuare
misure in continuo at-line, on-line o in-line.
I tempi di risposta sono dell’ordine di qualche minuto.
Possono
essere
miniaturizzati
e
costruiti
monouso a prezzi estremamente convenienti.
come
sistemi
Principio di funzionamento
di biosensori elettrochimici
Un biosensore elettrochimico è costituito da:
• trasduttore di segnale elettrochimico;
• sistema biologico di vario genere.
L’affidabilità di questi biosensori deriva da:
materiale biologico (enzima, anticorpo etc.)
specifico per la specie che si vuole misurare,
elettrodo selettivo per il prodotto elettroattivo.
Applicabilità in matrici “sporche” dove altri metodi di
analisi richiedono lunghi e complicati trattamenti del
campione.
Biosensori elettrochimici
• biosensori
potenziometrici
che
elettrodi a gas e ionoselettivi (ISE);
utilizzano
biosensori amperometrici basati su elettrodi di
platino, oro, grafite, carbone, etc.
SENSORI POTENZIOMETRICI ISE
Un ISE è costituito da 2 elettrodi di riferimento posti ai due lati di
un’opportuna membrana che separa la soluzione contenente lo ione da
analizzare da una soluzione interna di riferimento contenente lo stesso
ione a concentrazione costante. Ciascun lato della membrana interagisce
selettivamente con lo ione (lo scambio più massiccio avviene sul lato della
membrana rivolto verso la soluzione più concentrata) e si genera ai due
lati della membrana una differenza di potenziale misurata mediante i due
elettrodi di riferimento collegati ad un potenziometro.
Es.: Elettrodo a vetro per misura del pH
Elettrodi potenziometrici
In una misura potenziometrica, la relazione che intercorre tra il
potenziale misurato e la concentrazione dell’analita in esame è di
tipo logaritmico
eq. di Nerst
E = K + (RT/nF) Log ai
E =differenza di potenziale, K =costante di cella, R =costante dei gas
T =temperatura assoluta, n =numero di cariche, F =costante di Faraday
ai =attività dello ione
Esistono elettrodi ISE per K+, Ca2+, NH4+, NO3-, Na+, I- etc. che trovano ampia
applicazione nel settore ambientale
La misura analitica di questi sensori è compresa nell’intervallo di
concentrazione 10-5 – 10-1 mol/L
Alcuni elettrodi iono-selettivi (ISE) a membrana come l’elettrodo
per la misura del pH, possono essere accoppiati con enzimi
(biosensori potenziometrici) capaci di generare o consumare lo
ione a cui l’elettrodo è sensibile.
Sensori amperometrici
Una misura amperometrica consiste nel rilevare una corrente che passa tra
due elettrodi (uno di lavoro e l’altro di riferimento) ai quali è stata
applicata una differenza di potenziale costante; i due elettrodi immersi in
una soluzione costituiscono una cella elettrochimica. Se in soluzione è
presente una specie elettroattiva, si misurerà un passaggio di corrente
dovuto alla riduzione o ossidazione della specie stessa all’elettrodo di lavoro
opportunamente polarizzato
ad un prefissato valore di potenziale. La
variazione di corrente è linearmente correlata alla variazione di
concentrazione della specie da misurare.
I sensori amperometri di piu’ largo impiego sono:
elettrodo ad ossigeno,
elettrodo ad acqua ossigenata,
elettrodi basati su mediatori,
elettrodi a NADH.
Sono comunemente accoppiati ad enzimi capaci di generare o consumare le
specie elettroattive.
Elettrodo ad ossigeno
Un comune elettrodo ad ossigeno è l’elettrodo di Clark:
catodo (elettrodo di lavoro) di platino o d’oro,
anodo (elettrodo di riferimento) di Ag/AgCl,
separati da una resina epossidica isolata.
I due elettrodi sono fissati in un supporto di plastica contenente una
soluzione elettrolitica.
Il tutto è separato dalla soluzione esterna, in cui verrà addizionato il
campione da misurare, da una membrana gas permeabile (membrana di
teflon). L’elettrodo di lavoro è mantenuto ad un potenziale di circa -700
mV rispetto all’elettrodo d’argento ed è posto in intimo contatto con la
membrana a gas al fine di ottenere una risposta rapida. In queste
condizioni si registra una variazione di corrente dovuta alla riduzione
dell’ossigeno al catodo secondo la seguente reazione:
Pt= catodo
O2 + 4H++ 4e- 2 H2O
mentre all’anodo Ag/AgCl
4Ag + 4Cl- 4AgCl + 4e-
Elettrodo ad ossigeno
Il sensore ad O2 può essere accoppiato con un grande numero di enzimi
ossidasi immobilizzati su opportune membrane polimeriche che vengono
sovrapposte alla membrana di teflon. Come esempio riportiamo il classico
sensore sviluppato da Clark e Lyons nel 1962 con l’enzima glucosio ossidasi
che catalizza la seguente reazione in due passaggi:
Glucosio + Enzina-FAD + H2O acido gluconico + Enzima-FADH2
Enzima-FADH2 + O2 H2O2 + Enzima-FAD
La corrente dovuta alla riduzione dell’ossigeno al catodo diminuisce
all’aumentare della concetrazione di glucosio in soluzione. Se l’analita da
misurare non è substrato di un’ossidasi è possibile utilizzare, in alcuni casi,
una sequenza enzimatica che, partendo dall’analita, generi un composto che
è substrato di una ossidasi.
Rappresentazione schematica
di un biosensore ad O2
Sensore ad H2O2
La stessa reazione catalizzata dalla glucosio ossidasi può essere utilizzata
per la determinazione del glucosio monitorando la produzione di H2O2 con
un sensore specifico per quest’ultima specie. Questo sensore
amperometrico ha la stessa configurazione di quello ad ossigeno, in questo
caso però la polarità è invertita, + 650 mV, e l’elettrodo di lavoro di
platino funziona da anodo, mentre l’elettrodo di riferimento di Ag/AgCl
funziona da catodo. La reazione di ossidazione dell’acqua ossigenata
all’anodo è la seguente:
H2O2 O2 +2H+ +2eLa membrana gas permeabile dell’elettrodo ad O2 viene sostituita con una
membrana di acetato di cellulosa che impedisce il passaggio di composti con
peso molecolare superiore a 100-150 dalton che potrebbero essere
elettroattivi o potrebbero avvelenare gli elettrodi.
L’enzima è immobilizzato e tenuto il piu’ vicino possibile all’elettrodo di
lavoro, quindi l’H2O2 che si produce dalla reazione enzimatica diffonde
attraverso la barriera di acetato di cellulosa, raggiunge l’elettrodo di
lavoro e produce un aumento di corrente che è direttamente proporzionale
alla concentrazione dell’analita da analizzare.
BIOSENSORI ELETTROCHIMICI AMPEROMETRICI
O-ring
Membrana enzimatica
Elettrodo di
Supporto lavoro di Pt
Membrana di
policarbonato
Membrana di acetato
di cellulosa
Elettrodo di
riferimento (Ag/AgCl)
Sensori basati su mediatori
Sensori amperometrici indipendenti dall’O2 utilizzano composti a basso peso
molecolare detti mediatori che trasportano elettroni dal centro di ossidoriduzione degli enzimi alla superficie dell’elettrodo. Tornando alla reazione
catalizzata dalla glucosio ossidasi la riossidazione del FADH2 viene
effettuata dal mediatore secondo la reazione:
Enzima-FADH2 + Med ox Enzima-FAD + Med rid + 2 H+
il mediatore ridotto si riossida all’elettrodo di lavoro:
Med rid Med ox + 2eLa riossidazione del mediatore genera un segnale di corrente che viene
registrata da uno strumento connesso agli elettrodi. Nel caso del
ferrocene il potenziale al quale avviene l’ossidazione è <500 mV
(vs.Ag/AgCl); tale potenziale è sufficientemente piccolo da evitare
significative interferenze da parte di composti elettroattivi che possono
essere presenti nel campione. Il mediatore si sostituisce all’O2 in soluzione,
e questo, vista la scarsa solubilità dell’ossigeno in acqua, determina
un’espansione dell’intervallo di linearità della risposta.
Elettrodi a NAD(P)H
Un’altra classe di sensori amperometrici è rappresentata dagli
elettrodi a NAD(P)H. Tali molecole sono coinvolte in molte reazioni
che utilizzano enzimi deidrogenasi. Questi cofattori enzimatici in
presenza dell’enzima e del substrato passano dalla forma ossidata
NAD(P)+ alla forma ridotta NAD(P)H che viene riossidata:
direttamente alla superficie dell’elettrodo di lavoro;
interagisce con un mediatore secondo lo schema sottoriportato
Substrato
Enzima + NAD(P)+
Med.(red)
Prodotto
Enzima + NAD(P)H
Med.(ox)
e-
IMMOBILIZZAZIONE DEI
SISTEMI BIOLOGICI
L’immobilizzazione dei sistemi biologici, che ne permette
il riutilizzo, può essere di due tipi:
fisica, se la proteina è trattenuta fisicamente al
supporto;
chimica, se tra supporto e proteina si formano veri e
propri legami covalenti.
L’immobilizzazione fisica comprende le tecniche di
intrappolamento in gel (di natura polisaccaridica),
incapsulamento, adsorbimento su un supporto insolubile
con formazione di legami ionici, polari, legami idrogeno.
PROCEDURE DI ANALISI CON
SENSORI AMPEROMETRICI
Analisi in batch
Le analisi vengono effettuate ponendo il biosensore in
un’opportuna soluzione tampone posta in una cella,
eventualmente termostata, sotto agitazione magnetica
per consentire una diffusione costante ed omogenea del
substrato verso il biosensore. Il sensore è collegato
con un voltamperometro che applica una ddp ai due
elettrodi e la misura di corrente viene registrata con
un registratore. Quando la corrente di fondo raggiunge
un valore stabile aliquote di campione o di soluzioni
standard sono addizionate al tampone di misura dove
interagiscono con il sistema biologico generando
variazioni di corrente che sono correlate alla
concentrazione di analita.
Schema di sistema in batch
Registratore
Elettrodo
Amperometro
Becker
Ancoretta
Agitatore magnetico
Sistema in flusso
Il biosensore è inserito in una cella elettrochimica di
flusso costituita da due o tre elettrodi.
La cella elettrochimica è collegata ad una pompa
peristaltica che trasporta tampone ad un’opportuna
velocità di flusso.
La velocità di flusso influenza l’intensità del segnale, il
tempo di risposta ed il rumore di fondo dovuto a
variazioni di pressione nella cella.
Il flusso ottimale corrisponde
compromesso tra questi parametri.
a
condizioni
di
Quando la corrente di fondo raggiunge
un valore
stabile soluzioni standard di analita o di campione
preparate nello stesso tampone vengono trasferite alla
cella generando variazioni di corrente.
Schema di sistema in flusso
Schema di sistema FIA
In un sistema di analisi FIA (flow
injection analysis) una valvola (Rheodyne)
viene connessa in serie con un sistema a
flusso. Quando la corrente iniziale
raggiunge lo stato stazionario, si inietta
attraverso la valvola la soluzione di
standard o di campione e si registra la
variazione di corrente.
FLOW INJECTION ANALYSIS (FIA)
Pompa
Peristaltica
Tampone
di lavoro
Loop
Valvola
d’iniezione
Registratore
Scarico
Cella
Elettrochimica
Amperometro