Mechanisms of Disease
Cardiac Plasticity
Joseph A. Hill, M.D., Ph.D., and Eric N. Olson, Ph.D.
N Engl J Med 2008;358:1370-80.
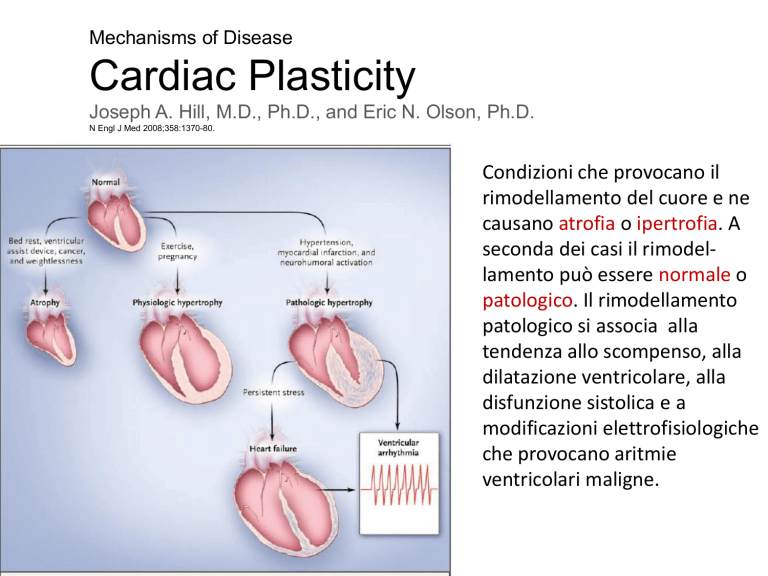
Condizioni che provocano il
rimodellamento del cuore e ne
causano atrofia o ipertrofia. A
seconda dei casi il rimodellamento può essere normale o
patologico. Il rimodellamento
patologico si associa alla
tendenza allo scompenso, alla
dilatazione ventricolare, alla
disfunzione sistolica e a
modificazioni elettrofisiologiche
che provocano aritmie
ventricolari maligne.
Limiti dell’atrofia e dell’ipertrofia
cardiaca: il cuore può andare
incontro ad aumento o riduzione
considerevole del volume, con un
ambito dinamico del 100%
L’ipertrofia di un organo è caratterizzata da un aumento delle dimensioni delle cellule.
Nell’accrescimento del cuore provocato dall’esercizio o dalla gravidanza, la struttura e
la funzione sono normali e non vi è associazione con l’insufficienza cardiaca.
Nell’ipertrofia che si verifica nell’ipertensione, nell’obesità, nelle malattie valvolari,
dopo un infarto o in seguito ad alterazioni geniche delle proteine contrattili, vi sono
alla base alterazioni metaboliche, strutturali e funzionali: il metabolismo vira verso la
glicolisi (normalmente prevale il consumo di acidi grassi), i sarcomeri si disorganizzano,
le correnti di calcio sono alterate, si riduce la contrattilità, si perdono miociti che
vengono sostituiti da fibroblasti, compare disfunzione sistolica e/o diastolica e un
“rimodellamento elettrico” (es. alterazioni dell’espressione e/o della funzione delle
pompe ioniche). Tutto ciò rappresenta una serie di condizioni derivanti dalla plasticità
miocardica.
L’accrescimento del cuore segue, classicamente, tre modelli morfologici:
Rimodellamento concentrico: aumento dello spessore (relativo) elle pareti senza
aumento della massa;
Ipertrofia concentrica: aumento dello spessore (relativo) e della massa con scarso
aumento di volume; aggiunta di sarcomeri in parallelo e accrescimento laterale delle
cellule: causa frequente l’ipertensione arteriosa e l’esercizio isometrico;
Ipertrofia eccentrica: aumento della massa e del volume delle camere; lo spessore
(relativo) può essere normale, aumentato o diminuito: cause esercizio isotonico,
sovraccarico di volume, perdita di tessuto funzionante per infarto; aggiunta di
sarcomeri in serie e allungamento dei miocardiociti.
Fra gli atleti, quelli che hanno il cuore più grande sono i rematori, i ciclisti e gli sciatori
di fondo; lo spessore di parete in genere non supera 1,3 cm (limite superiore per
sedentari 1,1 cm). Gli allenamenti stagionali provocano variazioni stagionali delle
dimensioni del cuore.
L’ipertrofia cardiaca da gravidanza
regredisce in alcuni mesi dopo il parto.
CURIOSITA’ INTERESSANTE: Nel Pitone
di Burma il consumo di un pasto
abbondante (vedi Piccolo Principe: il
pitone che ha mangiato un elefante) si
accompagna ad un aumento del
metabolismo di circa 7 volte ed uno
straordinario aumento del 40% della
massa cardiaca dopo sole 48 ore dal
pasto; tutto ritorna alla norma in 28
giorni.
Al contrario delle modificazioni fisiologiche del cuore, l’ipertrofia patologica è
stimolata da attivazione neuroumorale, da un sovraccarico emodinamico cronico o
altri fattori di stress per il cuore. Anche il rimodellamento patologico può essere
intenso e rapido: la sintesi di MHC (myosin heavy chain) aumenta del 35% poche ore
dopo l’esposizione ad un sovraccarico; l’iperespressione di un particolare gene (Akt1)
fa aumentare la massa cardiaca del 60% in sole 2 settimane.
Nell’ipertrofia cardiaca, le dimensioni dei miocardiociti aumentano e i sarcomeri sono
fortemente organizzati (grosse banda al microscopio ottico). L’ipertrofia da esercizio
tipicamente non comporta anche un aumento del collagene miocardico. Confrontando
l’ipertrofia da esercizio con quella indotta dall’ipertensione i recettori dell’ormone
tiroideo e le diverse isoforme della catena pesante della miosina sono regolati in
maniera opposta. Le isoforme della miosina sono diverse, e questo può contribuire a
ridurre la contrattilità nelle forme patologiche. In ratti sacrificati dopo un allenamento
fisico i markers dell’ipertrofia (geni che caratterizzano il fenotipo ipertrofico) sono
inibiti.
Gli stimoli di pressione e volume (aumentati) inducono un’espressione diversa di betamiosina, actina alfa scheletrica e ATPasi del Ca2+ del reticolo sarcoplasmico, anche con
simili livelli di ipertrofia. Si è inoltre dimostrato che quello che determina il fenotipo
ipertrofico è la natura dello stimolo, non il fatto che sia continuo o intermittente.
Visto che l’accrescimento del cuore ad un certo punto si arresta anche se gli stimoli
persistono e che regredisce quando gli stimoli vengono rimossi, vi devono essere
anche dei meccanismi che si oppongono all’aumento di volume delle cellule. È
improbabile che si tratti semplicemente della rimozione degli stimoli. Nel muscolo
scheletrico e cardiaco l’attivazione della cascata di segnali che attivano la crescita è
accompagnata dall’inibizione di vie che promuovono la proteolisi e il contrario accade
nelle condizioni che portano all’atrofia. La plasticità dei miocardiociti è spesso
accompagnata dalla reinduzione di un “programma genetico fetale”, nel quale
l’espressione genica assomiglia a quella che caratterizza lo sviluppo embrionale.
Quando il cuore si scompensa, le pareti ventricolari si assottigliano a causa di una
combinazione di proteolisi e morte cellulare. Si era pensato che l’irrorazione sanguigna
fosse insufficiente per il miocardio ipertrofico e quindi si sviluppassero condizioni di
ischemia, ma questa ipotesi non è stata confermata da tutti gli studi. Si pensa anche
all’alterazione delle proteine contrattili, rimodellamento della matrice extracellulare e
fibrosi e variazioni dell’attivazione dei recettori beta adrenergici. Più recentemente si è
parlato di autofagia, un fatto che riguarda il riciclo delle proteine e degli organelli
intracellulari, nella risposta dei miocardiociti allo stress e nella transizione verso
l’insufficienza.
Diminuzioni della massa cardiaca a livelli ben inferiori al normale si verificano in
condizioni di assenza di gravità, nell’allettamento prolungato ed in altre condizioni di
scarico ventricolare. In uno studio su soggetti sani allettati per 12 settimane la massa
del ventricolo sinistro diminuiva del 15%; in un altro studio, che probabilmente ha
raggiunto il limite minimo di atrofia cardiaca, si è documentata una riduzione del 25%
della massa in pazienti con lesioni spinali che non potevano muoversi
Lo stress meccanico induce segnali paracrini e autocrini regolando la sintesi e la
secrezioni di potenti fattori di crescita, fra cui il fattore insulino simile 1 (IGF 1),
angiotenina II ed endotelina 1, sia in colture cellulari, sia in pazienti con stenosi
aortica. Lo stress meccanico stimola direttamente i recettori per l’angiotensina II,
senza che vi sia un aumento della stessa.
Risposte cellulari alle alterazioni del carico.
Una complessa sequenza di risposte allo stress
neuroumorale e biochimico termina nella
regolazione di geni dell’ipertrofia e della
crescita cellulare
Segnali extracellulari che scatenano risposte intracellulari nel miocardiocita. Questi segnali
attivano e sbloccano la trascrizione di geni che presiedono alla crescita cellulare e al
rimodellamento. Nonostante la complessità, vi sono dei nodi comuni, sulla superficie
cellulare, nel citoplasma e nel nucleo, che potrebbero essere oggetto di interventi terapeutici
L’ipertensione è il più importante fattore di rischio di insufficienza cardiaca, a causa del
ruolo fondamentale dell’accrescimento miocardico ipertrofico nello sviluppo
dell’insufficienza cardiaca. Lo schema prevalente della malattia cardiaca ipertensiva
vede prima l’ipertrofia concentrica del ventricolo sinistro, seguita da dilatazione
ventricolare e insufficienza contrattile. Vi è una relazione fra l’aumento quantitativo
della massa cardiaca e il manifestarsi di situazioni cliniche negative. Oltre alla massa, è
importante il tipo di rimodellamento cardiaco: con il rimodellamento concentrico
compare una lieve disfunzione sistolica, mentre il malfunzionamento è più rilevante
nell’ipertrofia eccentrica.
L’ipertrofia dei miocardiociti è la risposta cellulare allo stress biomeccanico, sia esso intrinseco
come nell’ipertensione e nei vizi valvolari, o estrinseco come nella cardiomiopatia ipertrofica
familiare. L’ipertrofia cardiaca ha l’effetto di normalizzare l’aumento della tensione di parete
eliminando lo stimolo iniziale. Gli aspetti caratteristici sono un aumento delle dimensioni dei
miocardiociti, un aumento della sintesi proteica e una migliore organizzazione dei sarcomeri.
Queste modificazioni del fenotipo cellulare sono precedute e accompagnate dalla
reintroduzione del cosiddetto programma genetico fetale.
L’ipertrofia in risposta a segnali patologici è di tipo adattativo per mantenere la gettata cardiaca
a fronte delle condizioni alterate, ma alla lunga si associa ad un aumento significativo del rischio
di morte improvvisa e ad una progressione verso l’insufficienza cardiaca.
Il processo ipertrofico non è completamente benefico. Si solleva il problema se l’ipertrofia da
stress miocardico sia un bene oppure se sia di tipo adattativo soltanto in principio ma porti alla
perdita funzionale del cuore nel lungo periodo. Altrettanto importante è la differenza fra
ipertrofia fisiologica, quella che accompagna lo sviluppo post natale e quella indotta
dall’esercizio, e l’ipertrofia patologica. Interventi per favorire la prima ed inibire la seconda
potrebbero avere un ovvio valore terapeutico.
VIE MOLECOLARI DELL’IPERTROFIA MIOCARDICA
Il sistema calcineurina-NFAT. La calcineurina è una fosfatasi serina-treonina, espressa in
numerosi tessuti e composta da una subunità catalitica A e una regolatrice B. La calcineurina
defosforila fattori di trascrizione della famiglia dei NFAT (nuclear factor of activate T cells),
provocando la traslocazione del NFAT nei nuclei e l’attivazione dei geni della risposta
immunitaria. Sembra accertato che questa via stia alla base anche dell’ipertrofia cardiaca. Il
ruolo della calcineurina nell’ipertrofia dovuta alle cause più comuni sembra accertato. Inoltre,
questa via si intreccia con altri importanti segnali che provocano ipertrofia, come quelli
controllati dalla glicogeno sintetasi e dal MAPK.
Il fatto che la calcineurina sia coinvolta in molti, se non tutti, i processi ipertrofici patologici del
cuore ne fa un ovvio bersaglio terapeutico, ma non è chiaro se sia necessario un livello minimo
di calcineurina per evitare l’atrofia, dato che essa è implicata anche nell’ipertrofia fisiologica da
esercizio.
PI3K/Akt/GSK-3-Dependent Signaling. PI3Ks = fosfoinositide 3 chinasi. È una famiglia di
enzimi che attivano chinasi proteiche e lipidiche e sono importanti nell’accrescimento,
nella sopravvivenza e nella proliferazione delle cellule.
Il PI3K regola la risposta ipertrofica dei miociti piuttosto che la loro proliferazione. Non ha effetti
negativi sulla contrattilità. Numerosi studi basati su ratti transgenici che esprimono in eccesso o
in difetto questi enzimi. Uno dei bersagli principali di PI3K è la chinasi serina/treonina Akt, che è
attivata attraverso vari stadi di fosforilazione. L’ipertrofia regolata da questi fattori è mediata da
GSK-3 e dal “mammalian target of rapamycine (mTor). La rapamicina è un immunosoppressore e
quando si lega a mTor blocca la sintesi proteica. Nel’insieme, risulta che GSK-3 integra i segnali
di diverse vie ipertrofiche e dev’essere disattivata per la comparsa dell’ipertrofia.
Controllo trascrizionale dell’ipertrofia cardiaca mediante MEF2/HDAC. Molte molecole calcio
dipendenti, comprese calcineurina, protein chinasi calcio/calmodulina dipendente (CaMK), e
MAPKs bastano per produrre ipertrofia e riprogrammare l’espressione genica. Dato che vie
diverse evocano simili risposte molecolari, è probabile che le vie ipertrofiche convergano su
punti finali comuni. Un candidato probabile è MEF2 (myocyte enhancer factor-2), che rimane a
livelli basali di attività trascrizionale nel miocardio adulto ma viene attivato su stimolazione.
L’attività MEF2 è controllata dall’associazione diretta con un’istone deacetilasi (HDAC). Stimoli
ipertrofici (sovraccarico di pressione) e l’attivazione della calcineurina attivano HDAC, che regola
MEF2. Si può concludere che molti, se non tutti, gli stimoli ipertrofici convergono sul nucleo e
che le HDAC insieme a MEF2 e forse altri fattori di trascrizione che interagiscono con MEF2,
come GATA e NFAT, costituiscono gli integratori di questi segnali.
Segnali ipertrofici via G Protein–Coupled Receptors (GPCRs) giocano un ruolo importante nella
regolazione della funzione cardiaca e negli adattamenti ai carichi emodinamici. I più importanti
GPCRs sono i recettori adrenergici e muscarinici. Questi recettori a sette eliche si accoppiano a
tre classi principali di proteine eterotrimetriche che legano GTP, che trasducono il segnale
agonista o antagonista ad effettori intracellulari (enzimi e canali ionici). Le subunità dei recettori
GTP, una volta attivate, si dissociano e attivano segnali intracellulari indipendenti.
I recettori di AngII, ET1, alfa-adrenergici si accoppiano all’unità Gq/11 (che a sua volta attiva la
fosfolipasi C) e sono tutti sufficienti a provocare ipertrofia.
Il recettore adrenergico più abbondante nel cuore è il beta-1, accoppiato a Gs, che attiva
l’adenilciclasi, provocando i noti effetti sul cuore (cronotropo, inotropo, lusitropo). La PKA
(attivata dalla catena precedente) media le conseguenze negative dell’aumento cronico della
stimolazione beta adrenergica, mentre l’adenilciclasi di per se può avere altri effetti protettivi. È
stato recentemente dimostrato che il trattamento con beta bloccanti nell’insufficienza cardiaca
congestizia è accompagnato anche da un salvataggio del fenotipo dei miocardiociti, con
sottoregolazione dei geni dell’ipertrofia e sovraregolazione di geni che erano stati inibiti.
Piccole proteine G costituiscono un passaggio critico fra i recettori di membrana e diverse vie di
segnalazione. Vi sono molti membri, che regolano diverse funzioni cellulari, fra cui la crescita, la
divisione e la sopravvivenza, l’organizzazione del citoscheletro, i traffici transmembrana e la
motilità cellulare. Hanno una massa molecolare simile (21 kDa) e si attivano legando il GTP che
si idrolizza a GDP e viene disattivato.
La via MAPK. È un legame importante fra gli stimoli esterni e il nucleo mediante fosforilazione e
regolazione di molteplici fattori di trascrizione. Le MAPKs si dividono in 3 sottofamiglie
principali: extracellularly responsive kinases (ERKs), c-Jun N-terminal kinases (JNKs), and p38
MAPKs. Gli ultimi due gruppi sono anche chiamati MAPKs che rispondono agli stress perché
sono attivati non solo da stimoli anabolici e dagli agonisti delle GPCRs, ma anche da stress
patologici come l’ischemia e gli agenti citotossici.
PKC e ipertrofia cardiaca: è una chinasi serina/treonina ubiquitaria attivata da recettori
accoppiati a proteine G. Varie isoforme sono coinvolte nella patogenesi dell’ipertrofia. L’attività
PKC dipende dalla dislocazione spaziale e dall’associazione con proteine del citoscheletro (RACK
e AKAPs).
Gp130/STAT3 Signaling: è un recettore promiscuo per diverse citochine fra cui interleukin 6/11,
leukemia inhibitory factor (LIF), and cardiotrophin-1 (CT-1). CT-1 induce ipertrofia in vitro; ANG II
aumenta LIF, CT-1 e IL-6.
Metabolismo lipidico e ipertrofia cardiaca. La generazione di combustibile nel cuore adulto si
basa sull’ossidazione mitocondriale di acidi grassi a catena lunga per produrre ATP. L’ipertrofia
invece si associa alla soppressione dell’ossidazione degli acidi grassi e alla deviazione verso il
metabolismo glucidico, che caratterizza il cuore fetale. Questa deviazione si può interpretare
come un adattamento perché diminuisce il consumo di ossigeno per mole di ATP generata. Non
è però chiaro quali conseguenze metaboliche, come l’accumulo di acidi grassi nel cuore,
comporti la soppressione cronica del metabolismo lipidico cardiaco.
I geni dell’ossidazione degli acidi grassi sono in primo luogo regolati da una famiglia di fattori di
trascrizione chiamata peroxisome proliferator-activated receptors (PPARs). I meccanismi della
modulazione dipendente da PPAR dell’ipertrofia cardiaca non sono chiari; si indicano due
possibilità: a) le alterazioni del metabolismo lipidico nel cuore sono un epifenomeno secondario
alle cause della crescita del miocardio; b) le anomalie del metabolismo lipidico precedono e in
qualche modo causano l’ipertrofia. La seconda ipotesi è sostenuta dall’osservazione che molte
alterazioni ereditarie dell’ossidazione degli acidi grassi si accompagnano ad ipertrofia del
ventricolo sinistro.
ALTRE VIA DELL’IPERTROFIA CARDIACA
Il segnale MMP/TNF. Le MMPs sono enzimi della matrice extracellulare e aumentano
nell’ipertrofia post infarto; l’aumento della loro attività contribuisce alla dilatazione progressiva
del cuore scompensato, mentre l’inibizione farmacologica migliora l’ipertrofia sperimentale,
compresa la funzione contrattile.
CHAMP and Cardiomyocyte Hypertrophy. Si tratta di un’elicasi dell’RNA specifica per il cuore,
attivata da MEF2. Contribuisce all’ipertrofia.
Inibizione dello scambiatore Na/H (NHE). La sua attività aumenta in numerosi modelli di
ipertrofia cardiaca e comporta un aumento della concentrazione intracellulare del sodio e, di
conseguenza, del calcio perché rallenta lo scambiatorie Na/Ca. L’aumento del calcio
intracellulare stimola molte cascate che producono ipertrofia come calcineurin-, CaMK-, PKCand MAPK-dependent pathways. Quindi l’inibizione di NHE può migliorare molte forme di
ipertrofia.
CARDIAC HYPERTROPHY: COMPENSATORY RESPONSE VERSUS MALADAPTATION
Is Cardiac Hypertrophy Good, Bad, or Ugly?
Si ritiene in genere che l’ipertrofia cardiaca possa essere adattativa in alcune situazioni, in
particolare negli atleti. È però meno chiaro se la risposta ipertrofica a situazioni patologiche
croniche, come l’ipertensione o l’infarto, inizi come risposta compensatoria (che diventa
maladattativa solo in seguito) o se questo tipo di accrescimento del miocardio sia dannoso fin
dall’inizio. In questo caso le vie molecolari alla base dei due tipi di ipertrofia dovrebbero essere
diverse e in effetti ci sono differenze sia morfologiche sia a livello molecolare: l’ipertrofia da
esercizio non è accompagnata da accumulo di collagene nel miocardio e in genere l’aumento
dello spessore della parete ventricolare sinistra è di grado modesto. Nel confronto fra ratti
spontaneamente ipertesi e ratti sottoposti ad esercizio, sono diversi alcuni geni ipertrofici come
BNP e ET-1 e l’espressione delle MHCs. In conclusione, l’ipertrofia buona (esercizio) cattiva
(patologica) e pessima (scompensata) sono diverse a livello molecolare ma non è escluso che
alcune vie ipertrofiche partecipino a tutti i tipi di ipertrofia.
INIBIZIONE DELL’IPERTROFIA. Sono stati descritti diversi fattori genetici o esogeni che inibiscono
l’ipertrofia: l’inizio e l’inibizione dell’ipertrofia cardiaca coinvolgono segnali multipli formando
una specie di rete che si integra e modula una quantità di stimoli. Alcuni modelli di topi
transgenici attenuano la risposta ipertrofica al sovraccarico di pressione mantenendo una
funzione sistolica normale, mentre modelli diversi sono ugualmente protetti dall’ipertrofia ma
hanno una funzione sistolica depressa e un aumento della mortalità. Quindi la risposta
ipertrofica può essere dissociata dalla regolazione della contrattilità
Molti lavori sostengono che l’inibizione dell’ipertrofia cardiaca patologica possa avere effetti
benefici anche se lo stimolo originale (aumento dello stress di parete) persiste, ma si tratta di
osservazioni a breve termine, mentre è probabile che alla lunga l’inibizione dell’ipertrofia sfoci
ugualmente nello scompenso. Qualunque sia l’efficacia di un intervento antiipertrofico, esso
deve essere sostenuto nel tempo e non deve compromettere la contrattilità. Bisognerà anche
associare strategie complementari, modulando il ciclo del calcio per sostenere la funzione
contrattile e inibire le risposte neuroumorali, al fine di trattare con successo e prevenire lo
scompenso cardiaco.
Antiremodeling Effect of Long-Term Exercise Training in Patients With Stable
Chronic Heart Failure
Results of the Exercise in Left Ventricular Dysfunction and Chronic Heart
Failure (ELVD-CHF) Trial
Pantaleo Giannuzzi, MD; Pier Luigi Temporelli, MD; Ugo Corrà, MD; Luigi Tavazzi, MD;
for the ELVD-CHF Study Group
(Circulation. 2003;108:554-559.)
I volumi telesistolico e telediastolico erano aumentati del 6% e del 7% rispettivamente nel
gruppo di controllo, mentre erano diminuiti del 5% e del 9% nel gruppo allenato, nel quale
anche la frazione di eiezione era aumentata del 16%. Il tempo di esercizio aumentava nel gruppo
allenato di 2,1 min (29%), la capacità di lavoro di 18 W (24%) e il consumo d’ossigeno alla soglia
ventilatoria di 2 ml/kg/min (17%). Frequenza cardiaca, pressione sistolica e il prodotto pressione
frequenza non cambiavano nei soggetti di controllo ma diminuivano significativamente negli
allenati.
L’esercizio moderato a lungo termine in pazienti CHF con disfunzione diastolica grave ha un
effetto antirimodellamento documentato da una riduzione modesta ma significativa dei volumi
del ventricolo sinistro e da un miglioramento della frazione di eiezione.
Meccanismi: riduzione della frequenza e della pressione a riposo e a parità di esercizio
sottomassimale. Ridotta produzione di ROS nel muscolo scheletrico.
Aumento del flusso coronarico nel cuore sano e intorno all’infarto; controllo dell’infiammazione
Molecular remodeling of cardiac contractile function
JEANNE JAMES AND JEFFREY ROBBINS
Am. J. Physiol. 273 (Heart Circ. Physiol. 42): H2105–H2118, 1997
Le proteine dell’apparato contrattile determinano e rispecchino diverse esigenze fisiologiche per
ogni tipo di muscolo. Tutti i muscoli striati hanno un insieme di proteine comuni che sono molto
conservate, ma diverse fibre si caratterizzano per particolari e spesso uniche isoforme proteiche
complementari. L’esempio più tipico è la catena pesante della miosina (MHC), che appunto
esiste in diverse isoforme, caratteristiche di vari fibre muscolari. Esistono isoforme anche della
catena leggera della miosina (MLC), dell’actina, del complesso delle troponine, della proteina C
che lega la miosina, della titina, della nebulina e della tropomiosina.
Nel cuore di mammifero, le diverse isoforme delle proteine contrattili possono essere espresse
in risposta a stimoli esterni ed interni e si ritiene che siano responsabili di diversi aspetti
funzionali. Per esempio vi sono due isoforme di actina alfa (scheletrica e cardiaca), prodotte da
geni simili in cromosomi diversi e presenti entrambe nel cuore. La forma scheletrica è
abbondante nel feto ma è sottoregolata nella vita adulta, quando viene sopraregolata l’actina
cardiaca. Un forma di topo geneticamente modificato iperesprime l’actina scheletrica nel cuore
da adulto e ha un cuore ipercontrattile.
La più evidente correlazione fra le proprietà contrattili e le proteine riguarda le MHC: ve ne sono
tre isoforme cardiache (V1, V2, V3), in cui cambia la velocità dell’ATPasi e della contrazione.
Sono stati studiati diversi tipi di topo transgenico per individuare la correlazione fra
caratteristiche funzionali e profilo isomiosinico.
Il resto dell’articolo riguarda le diverse tecniche dell’ingegneria genetica, più che i risultati
ottenuti. Si va dall’ablazione di geni specifici alla trasfettazione di porzioni di DNA anche diversi
(es Drosofila) e si ottengono topi (tutte le ricerche di questo genere sono state effettuate su
topi, per ragioni pratiche anche se sarebbero teoricamente estensibili ad altri animali) che
esprimono in quantità aumentata le proteine di cui si vogliono studiare gli effetti. I pezzetti di
DNA sono caricati su virus con i quali si infettano le cellule, che poi vengono iniettate su topi
genitori, la cui prole sarà portatrice della mutazione.
Particolarmente interessante la possibilità di produrre dei topi transgenici nei quali la proteina
da studiare viene attivata in un momento voluto, per es tramite tetraciclina e può anche essere
disattivata.
Per molti anni i cardiologi hanno sostenuto la necessità del riposo prolungato per i pazienti con
malattia cardiaca ischemica. Negli ultimi trent’anni,invece, c’è stata una vera rivoluzione e oggi
esercizio leggero o moderato è prescritto non solo per la prevenzione ma anche come
trattamento fondamentale della malattia.
In questa rassegna ci interessiamo del rimodellamento cellulare e molecolare che ha luogo nel
cuore in seguito ad allenamento di endurance. Ci riferiamo in particolare alle crescenti
dimostrazioni del potenziale rigenerativo del cuore adulto, costituito da una riserva endogena di
cellule staminali o progenitrici cardiache.
L’accrescimento del cuore (ipertrofia) è in genere definito come fisiologico (normale) o
patologico (cattivo). L’ipertrofia cardiaca da esercizio è il prototipo dell’accrescimento fisiologico
e si può grossolanamente distinguere in concentrico o eccentrico; la struttura cardiaca è
normale e la funzione è normale o migliorata. L’ipertrofia patologica invece si associa alla
perdita di miocardiociti (apoptosi e necrosi), sostituzione fibrosa, disfunzione cardiaca e
aumento del rischio di insufficienza cardiaca e morte improvvisa.
La struttura miocardica è riformata dall’esercizio attraverso un aumento bilanciato della massa
miocardica, che comprende l’ipertrofia e la neo angiogenesi (cuore d’atleta). Per esempio, 2 ore
al giorno di esercizio su treadmill ad alta intensità (85-90% VO2max) per 5 giorni alla settimana
per 8 settimane aumenta del 20-32% e del 17-23% la massa dei miocardiociti in topi maschi e
femmine.
In genere, gli atleti di endurance (corridori, nuotatori) hanno un aumento di spessore e una
notevole dilatazione del ventricolo sinistro (ipertrofia eccentrica), quelli di resistenza (pesisti,
lottatori) un aumento notevole dello spessore e una modesta dilatazione (ipertrofia
concentrica), mentre quelli “combinati”, che fanno allenamento di resistenza e di endurance
(ciclisti, canoisti, rematori) hanno la maggiore ipertrofia.
Nonostante i comprovati effetti dell’allenamento nella riduzione del rischio cardiovascolare, in
seguito ad episodi di esercizio intenso è stato documentato un aumento della troponina
cardiaca, che indica danni miocardici, anche in soggetti sani. Un allenamento di endurance
prolungato di alto livello può aumentare il rischio di aritmie e arresto cardiaco.
Per molto tempo si è considerato il cuore un organo post mitotico, privo di capacità rigenerativa,
per cui i miocardiociti hanno la stessa età del loro proprietario. Questo non vale per il cuore dei
neonati e dei bambini prepuberi: questi cuori giovani hanno una robusta capacità di crescere e
di rigenerarsi attraverso la moltiplicazione delle cellule, l’ipertrofia cellulare e dei vasi. Si può
raddoppiare la massa ventricolare nel neonato in circa una settimana aumentando il postcarico.
Ancora più interessante è il fatto che infarti massivi in soggetti giovani, come quelli che capitano
quando una coronaria ha l’origine sbagliata nell’arteria polmonare, dopo correzione chirurgica,
rigenerano un miocardio normale con segni minimi o assenti di cicatrice.
Negli ultimi dieci anni, fortunatamente, è sorta una nuova era della biologia miocardica e si è
fatto spazio il concetto di un cuore di rimpiazzo nell’adulto. Il cuore adulto contiene una riserva
di cellule staminali e progenitrici cardiache endogene (eCSC). Queste cellule si riconoscono in
base ad uno specifico marcatore (c-kit) e si distinguono da quelle di origine emopoietica
(identificate da CD45); hanno le proprietà delle cellule staminali (clonogeniche, auto rinnovanti
e multipotenti) sia in vitro sia in vivo. Nell’uomo queste cellule sono attivate e indirizzate verso
la linea miocardiocitica in risposta ad aumenti del carico. Utilizzando carbonio radioattivo, un
gruppo di ricerca ha dimostrato che almeno metà dei miocardiociti si rigenerano nel corso della
vita.
Nel ratto, abbiamo riscontrato un aumento della proliferazione, del numero e della
differenziazione cardiogenica di eCSC con carichi fisiologici come nuoto o corsa.
Allenamento di endurance provoca anche adattamenti del letto coronarico, con aumento della
distribuzione di ossigeno, dell’estrazione, del flusso coronarico, del diametro e del numero delle
arterie e miglioramento della funzione endoteliale. I segnali che inducono questi adattamenti
sono l’ischemia, fattori di crescita (VEGF e FGF-2) e forze fisiche ed emodinamiche. Inoltre,
l’allenamento modifica il numero e le caratteristiche di cellule progenitrici dell’endotelio di
origine midollare che contribuiscono alla neo vascolarizzazione. Infine, l’allenamento prolungato
migliora la contrattilità dei miocardiociti influendo sul ciclo del calcio.
Si ritiene comunemente che stimoli e segnali che conducono all’ipertrofia patologica siano
specifici: c’è la riattivazione o sopraregolazione del programma genico di tipo fetale dei
cardiomiociti, che comprende aumento di ANP, BNP, actina scheletrica, MLC-1 atriale e b-MHC e
diminuzione di geni normalmente espressi nell’adulto, come a-MHC e sarcoplasmic reticulum
Ca2+ ATPase (SERCA2a). Tutto questo non avviene in modelli di ipertrofia fisiologica, nella quale
agisce una complessa rete di fattori di attivazione, compresi GATA4, GATA6, Csx/Nkx2.5, MEF2, cjun, c-fos, c-myc, nuclear factor k B and NFAT. La via IGF-1-fosfoinositide 3-chinasi (PI3K) è quella
più accreditata per la crescita fisiologica del cuore, mentre recettori accoppiati a proteine G
stanno alla base dell’ipertrofia patologica.
Con iniezioni intracoronariche di IGF-1 e HGF si è riusciti ad attivare le eCSC e a rigenerare
miociti e vasi in una zona infartuata nel maiale, la cui morfologia cardiaca è particolarmente
simile a quella dell’uomo. La rigenerazione ha migliorato la sopravvivenza delle cellule, ha
ridotto la fibrosi e ha migliorato i parametri funzionali.
I miocardiociti sono le cellule principali del cuore e anche se sono solo il 20% della popolazione
totale di cellule cardiache, costituiscono più del 90% della massa del cuore. Pertanto, la maggior
parte delle modificazioni indotte nel cuore dall’allenamento (aerobico) deriva da adattamenti
dei miocardiociti e questa plasticità del sistema è alla base di effetti dipendenti dall’intensità
(dell’esercizio).
I miocardiociti rispondono all’esercizio in molti modi, cioè regolando le proprie dimensioni e la
contrattilità e la risposta dipende dall’intensità: maggiore intensità, maggiore adattamento.
La crescita adattativa delle cellule in risposta all’esercizio, chiamata ipertrofia fisiologica, si
esprime con un aumento proporzionale della sezione e della lunghezza delle cellule, e porta ad
un aumento del peso e delle dimensioni dei ventricoli.
Con allenamento ad alta intensità (80-90% VO2max) abbiamo ottenuto una risposta ipertrofica
proporzionale, già dopo poche settimane di esercizio, che raggiunge un limite dopo due mesi.
Sono coinvolti fattori sia trascrizionali sia traslazionali. Queste vie possono avere diversi
andamenti temporali e una diversa importanza biologica.
L’attivazione della via phosphoinositide-3-kinase (PI3K)/protein kinase B (Akt)/mammalian target
of rapamycin (mTOR) è cruciale per l’induzione dell’ipertrofia fisiologica. Tutto questo aumenta
la biogenesi e l’attività dei ribosomi e porta ad un aumento di mRNA e di sintesi proteica. È
dimostrato che l’attivazione di questa via fa la differenza fra l’ipertrofia fisiologica e quella
patologica.
Allenamento aerobico di alta intensità (90% VO2max) per periodi prolungati aumenta la
contrattilità di miocardiociti scarichi, con un aumento della frazione di accorciamento del 4050% e della velocità di contrazione/rilasciamento del 20-40%. La potenza aumenta fino al 60%.
L’effetto dipende dall’intensità dell’esercizio. Questi miglioramenti sono indipendenti
dall’ipertrofia perché la risposta contrattile dipende da meccanismi subcellulari, come l’idrolisi
dell’ATP e la formazione di ponti laterali stimolata dal calcio. La curva tensione/lunghezza
diventa più ripida.
Dato che la gestione del calcio intracellulare controlla la contrazione, non meraviglia che
l’allenamento modifichi soprattutto questa funzione. In effetti, il parallelismo fra le più rapidi fasi
di salita e di discesa del transiente di calcio e le fasi della contrazione e del rilasciamento
suggerisce che vi sia un legame causale. Oltre ad accelerare il ciclo del calcio, l’esercizio
diminuisce la concentrazione intracellulare di calcio in diastole, riducendo il rischio di aritmie e
la pressione di riempimento. Gli effetti smettono di aumentare dopo circa due mesi di
allenamento (o per saturazione o perché bisognerebbe aumentare l’intensità) e si invertono in
2-4 settimane dopo che l’allenamento è terminato.
Molti studi dimostrano che l’allenamento aumenta l’mRNA e l’espressione proteica di SERCA2,
ma non di fosfolambano (PLB). Quindi aumenta il rapporto SERCA2/PLB lasciando più attiva la
pompa sarcoplasmica del calcio. Aumenta anche lo stato di fosforilazione e quindi l’attivazione
cronica di CaMKII, che mantiene lo stato di fosforilazione di PLB, che non inibisce più SERCA2.
Quindi il calcio sarcoplasmatico viene rimosso più rapidamente e questo spiega la variazione
delle cinetiche descritta prima.
L’esercizio aumenta anche il ciclo intracellulare del
calcio, che attiva CaMKII (Ca 2+ /calmodulindependent kinase II), che contribuisce a mantenere
l’attivazione della sintesi proteica dell’ipertrofia.
Molte passaggi dell’accoppiamento eccitazionecontrazione possono essere influenzati
dall’esercizio, sia in condizioni normali che
patologiche.
Al contrario, non c’è una chiara spiegazione
dell’aumento della velocità di salita del calcio
sarcoplasmatico durante l’attivazione. È possibile
che l’allenamento porti ad un prolungamento
cronico del potenziale d’azione e quindi dello stato
di eccitamento, almeno in alcune parti del cuore
oppure che aumenti la sensibilità dei recettori alla
rianodina alla corrente di calcio attraverso i canali L,
attivati dal potenziale d’azione. In ogni caso, più che
la quantità di calcio durante l’attivazione, cambia la
forma della curva della concentrazione, che diventa
più stretta. Si suppone che questo indirizzi più
efficacemente il calcio verso la troponina,
aumentando la sincronizzazione dell’attivazione dei
sarcomeri. E questa è una spiegazione più credibile
dell’aumento di contrattilità. Vi è anche un miglior
controllo del pH intracellulare e una trasformazione
verso isoforme delle proteine contrattili più efficienti
Il modello animale più usato per studiare l’ipertrofia patologica è il ratto post infarto. Viene
chiusa permanentemente una coronaria e a questo segue un infarto di dimensioni ripetibili, con
conseguente perdita della funzione di pompa, ipertrofia e dilatazione.
I miocardiociti del ratto infartuato hanno le caratteristiche opposte a quelle dell’ipertrofia da
esercizio. Minore velocità di accorciamento e rilasciamento, minore forza contrattile, alterata
gestione del calcio intracellulare e aumento del calcio libero in diastole. Tutte queste alterazioni
sono suscettibili di miglioramento in seguito all’allenamento.
Innanzitutto, è invertita la disfunzione arteriosa grazie al ripristino della produzione di NO da
parte dell’endotelio, una modificazione facilitata da alterazioni adattative dell’eNOS, attivato da
Akt e da una riduzione delle specie reattive dell’ossigeno, generate dalla NADPH ossidasi.
Questo avviene nelle arterie, ma riduce il carico sul cuore e ne migliora la funzione. Ma ancora
più importante è l’attenuazione della disfunzione cardiaca intrinseca. Nell’insieme, questi effetti
riducono l’ipertrofia patologica. Giocano un effetto positivo tutti i meccanismi visti per
l’ipertrofia fisiologica, dall’aumento della contrattilità e della fase di rilasciamento alla migliore
gestione del calcio intracellulare. Infine, l’esercizio corregge i diversi difetti metabolici del cuore
dilatato
Sono stati escogitati diversi modelli animali per
simulare disfunzioni miocardiche non dipendenti
dal post infarto. In particolare, un tipo di diabete
e la sindrome metabolica. L’allenamento modula
positivamente le funzioni contrattili intrinseche,
riconducendole a livelli quasi normali. Il
principale meccanismo è una normalizzazione
del ciclo del calcio.
Tutti gli studi descritti indicano che la capacità di rispondere all’allenamento è mantenuta anche
durante lo sviluppo di miopatie cardiache e insufficienza dovute all’infarto, al diabete o alla
sindrome metabolica e che i meccanismi coinvolti restano simili a quelli del cuore normale. È
importante notare che l’esercizio corregge i difetti di inotropismo e lusitropismo direttamente
nei miocardiociti e che questo non dipende da fattori esterni alle cellule.
In realtà, le alterazioni geniche indotte da diversi tipi di malattia che portano all’ipertrofia
patologica sono molteplici e diverse da quelle che stanno alla base della risposta fisiologica.
Probabilmente è proprio per questo che tale risposta è conservata anche in condizioni
patologiche.
IMPLICAZIONI CLINICHE
Recentemente è stato dimostrato che programmi d’esercizio ad alta intensità (90% VO2 max)
possono essere adeguati per pazienti con ipertrofia post infarto, malattia coronarica o
aumentato rischio cardiovascolare. Tutti questi programmi si basavano su una frequenza
cardiaca pari al 95% del massimo teorico e hanno ottenuto effetti molto superiori a quelli di
esercizi moderati, che aumentano la capacità d’esercizio ma fanno poco sul cuore.