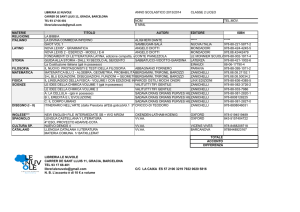
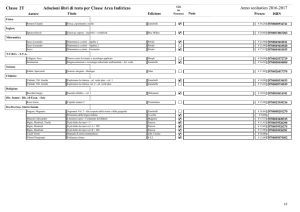
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
1
Valitutti, Tifi, Gentile
Esploriamo la
chimica
Seconda edizione di Chimica: molecole in
movimento
Capitolo 15 La termodinamica e la
cinetica
1.Le reazioni producono energia
2.Il primo principio della
termodinamica
3.La combustione produce calore
4.Il calore di reazione e l’entalpia
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
3
Capitolo 15 La termodinamica e la
cinetica
5. L’entropia: l’indicatore del
«disordine» di un sistema
6. L’energia libera: il «motore» delle
reazioni chimiche
7. La velocità di reazione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
4
Capitolo 15 La termodinamica e la
cinetica
8. Gli altri fattori che influiscono sulla
velocità di reazione
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
5
1. Le equazioni di reazione
Con il termine sistema s’intende l’oggetto di indagine.
Tutto ciò che circonda il sistema costituisce l’ambiente.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
6
1. Le equazioni di reazione
I sistemi aperti scambiano
energia e materia con
l’ambiente.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
7
1. Le equazioni di reazione
I sistemi chiusi scambiano
con l’ambiente soltanto
energia ma non materia.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
8
1. Le equazioni di reazione
I sistemi isolati non
scambiano con l’ambiente
né energia né materia.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
9
1. Le equazioni di reazione
La termodinamica è la scienza che si occupa di tutti i
possibili trasferimenti di energia che interessano la
materia.
La termochimica è un ramo della termodinamica che si
occupa degli scambi di calore durante una
trasformazione chimica.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
10
1. Le equazioni di reazione
Le reazioni che avvengono con produzione di calore, cioè
trasferiscono energia dal sistema all’ambiente, si dicono
esotermiche.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
11
1. Le equazioni di reazione
Le reazioni che avvengono con assorbimento di calore
dall’ambiente si dicono endotermiche.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
12
1. Le equazioni di reazione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
13
1. Le equazioni di reazione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
14
2. Il primo principio della
termodinamica
Il primo principio della termodinamica afferma che
l’energia può essere convertita da una forma all’altra, ma
non può essere né creata né distrutta.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
15
2. Il primo principio della
termodinamica
L’energia interna (U) di un sistema è una grandezza
estensiva che corrisponde alla somma dell’energia
cinetica e dell’energia potenziale di tutte le particelle
che lo compongono.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
16
2. Il primo principio della
termodinamica
In base al primo principio della termodinamica, la
variazione di energia interna ΔU di un sistema può
essere scritta come:
ΔU = q + w
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
17
2. Il primo principio della
termodinamica
Per convenzione, lavoro e
calore sono negativi se
determinano una riduzione
dell’energia interna del
sistema. Sono positivi se
aumentano l’energia interna
del sistema.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
18
3. La combustione produce calore
La combustione è una reazione fra un combustibile
(spesso contenente carbonio e/o idrogeno) e un
comburente (contenente atomi ad alta elettronegatività)
in cui si libera un’elevata quantità di energia.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
19
3. La combustione produce calore
La quantità di calore (kJ) emesso o assorbito da una
reazione, si determina misurando la variazione di
temperatura dell’ambiente esterno.
Q = c m ΔT
Q = calore
c = calore specifico
m = massa di acqua nel calorimetro
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
20
3. La combustione produce calore
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
21
3. La combustione produce calore
Il potere calorifico esprime la quantità di calore liberato,
a pressione costante, della combustione di 1 kg di
combustibile.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
22
3. La combustione produce calore
Il metabolismo energetico è la serie di reazioni
consecutive attraverso le quali avviene la lenta
combustione degli alimenti nell’organismo.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
23
4. Il calore di reazione e l’entalpia
La variazione di energia interna di un sistema dipende
dal numero di legami spezzati e da quello di legami
formati, e dalla forza dei legami di reagenti e prodotti.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
24
4. Il calore di reazione e l’entalpia
In un sistema chimico, la variazione di entalpia ΔH è
uguale al calore Qp scambiato a pressione costante
Q = ΔH = Hprodotti – Hreagenti
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
25
4. Il calore di reazione e l’entalpia
ΔH = –Q
reazioni esotermiche
ΔH = +Q
reazioni endotermiche
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
26
4. Il calore di reazione e l’entalpia
L’entalpia di reazione dipende dalla temperatura e dalla
pressione.
I valori generalmente riportati nelle tabelle si riferiscono
alla temperatura di 25 °C e alla pressione di 1 atm.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
27
4. Il calore di reazione e l’entalpia
L’entalpia standard di formazione di un composto è
la variazione di entalpia che accompagna la
formazione di una mole di un composto a partire dagli
elementi che lo costituiscono, ciascuno nel proprio
stato standard.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
28
4. Il calore di reazione e l’entalpia
Per convenzione, l’entalpia standard di formazione di un
elemento a 25 °C e 1 bar, è uguale a zero.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
29
5. L’entropia: l’indicatore del
«disordine» di un sistema
Le reazioni spontanee possono essere sia esotermiche
che endotermiche.
Le reazioni spontanee procedono sempre verso
l’aumento del disordine, ovvero verso la dispersione di
energia e di materia.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
30
5. L’entropia: l’indicatore del
«disordine» di un sistema
Il livello di dispersione dell’energia, cioè il disordine del
sistema, può essere espresso per mezzo di una
grandezza chiamata entropia, che indichiamo con S e
misuriamo in J/K.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
31
5. L’entropia: l’indicatore del
«disordine» di un sistema
La variazione di entropia ΔS° corrisponde alla
differenza tra l’entropia dei prodotti e quella dei
reagenti.
ΔS° = S°prodotti – S°reagenti
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
32
5. L’entropia: l’indicatore del
«disordine» di un sistema
In generale, una qualsiasi trasformazione chimica o
fisica spontanea è caratterizzata da
ΔSuniverso > 0
Quando nell’universo si ha un evento spontaneo, è
sempre accompagnato da un aumento di entropia.
L’entropia dell’universo è in costante aumento.
Questo è il secondo principio della termodinamica.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
33
6. L’energia libera: il «motore»
delle reazioni chimiche
L’energia libera G è una grandezza termodinamica
che dipende dall’entalpia, dalla temperatura assoluta e
dall’entropia del sistema
G = H – TS
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
34
6. L’energia libera: il «motore»
delle reazioni chimiche
Durante una reazione a temperatura e pressione
costanti si ha una variazione dell’energia libera
espressa dalla relazione:
ΔG = ΔH – TΔS
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
35
7. La velocità di reazione
La velocità di reazione è la variazione della
concentrazione dei reagenti Δ[R], o dei prodotti [ΔP],
nell’intervallo di tempo Δt.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
36
7. La velocità di reazione
La velocità di reazione è una grandezza intensiva e
quindi non dipende dalla massa del sistema.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
37
7. La velocità di reazione
Sperimentalmente si è potuto stabilire che la velocità
della maggior parte delle reazioni chimiche dipende dalla
concentrazione dei reagenti.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
38
8. Gli altri fattori che influiscono
sulla velocità di reazione
La velocità di una reazione dipende da
• la natura dei reagenti;
• la temperatura;
• la superficie di contatto fra i reagenti;
• la presenza di catalizzatori.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
39
8. Gli altri fattori che influiscono
sulla velocità di reazione
La natura dei reagenti influisce sulla velocità di
reazione nella misura in cui ogni sostanza ha una
peculiare attitudine a trasformarsi in virtù delle proprietà
chimiche e fisiche.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
40
8. Gli altri fattori che influiscono
sulla velocità di reazione
Un aumento di temperatura aumenta la velocità di una
trasformazione chimica.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
41
8. Gli altri fattori che influiscono
sulla velocità di reazione
Quando i reagenti non sono nello stesso stato di
aggregazione reagiscono tanto più velocemente
quanto più è estesa la loro superficie di contatto.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
42
8. Gli altri fattori che influiscono
sulla velocità di reazione
I catalizzatori sono sostanze che accelerano una
reazione chimica senza entrarne a far parte e quindi
senza consumarsi durante la reazione.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
43
8. Gli altri fattori che influiscono
sulla velocità di reazione
I catalizzatori sono sostanze altamente specifiche che
accelerano soltanto un tipo di reazione.
I catalizzatori biologici sono gli enzimi, sostanze di
natura proteica che rappresentano la classe a massima
specificità.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
44
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
La modalità principale per cui avvengono le
trasformazioni chimiche viene spiegata attraverso la
teoria degli urti.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
45
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Le molecole dei reagenti possono scambiarsi gli atomi e
dare luogo ai prodotti solo se, urtandosi, vengono in
reciproco contatto.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
46
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
La teoria degli urti spiega quindi l’effetto della
concentrazione sulla velocità di reazione: maggiore è la
concentrazione, più possibilità hanno le molecole di
urtarsi e quindi maggiori sono le probabilità che la
reazione avvenga.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
47
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Gli urti efficaci hanno:
• un’orientazione appropriata;
• energia sufficiente per dare luogo alla trasformazione.
Gli urti efficaci rappresentano una piccola quantità rispetto
agli urti totali.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
48
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
49
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Una reazione chimica può avvenire se il numero di urti è
abbastanza elevato, se questi avvengono con
l’orientamento corretto e se l’energia è sufficiente a portare
gli atomi alla distanza di legame.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
50
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Le molecole possono reagire in seguito a uno specifico
aumento della loro energia potenziale che prende il nome
di energia di attivazione.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
51
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
L’energia di attivazione è l’energia minima che occorre ai
reagenti per rompere alcuni dei loro legami e per iniziare
una reazione.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
52
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Lo stato di transizione è la fase della reazione in cui si
stanno rompendo i legami dei reagenti e sono in via di
formazione i legami tra le molecole dei prodotti, con la
formazione di un composto intermedio detto complesso
attivato.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
53
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
54
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Il dislivello energetico tra i reagenti e i prodotti
corrisponde alla variazione di entalpia ΔH.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
55
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
All’aumentare della temperatura, aumenta il contenuto
energetico delle molecole, ovvero aumenta il numero degli
urti efficaci rendendo più veloce la trasformazione.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
56
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
57
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Sono più frequenti le reazioni monomolecolari e
dimolecolari rispetto alle trimolecolari, che risultano rare
per la scarsa probabilità che tre molecole si urtino
contemporaneamente e in modo efficace.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
58
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Un catalizzatore accelera una reazione perché ne abbassa
il contenuto di energia di attivazione rispetto al percorso
non catalizzato.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
59
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
I catalizzatori possono essere:
• omogenei se nella stessa fase dei reagenti e dei
prodotti;
• eterogenei se in una fase diversa dei reagenti e dei
prodotti.
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
60
9. L’energia di attivazione: la teoria
degli urti e la teoria dello stato di
transizione
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
61