1. Concetti Fondamentali della Termodinamica....................................................... 3
1.1 Introduzione ....................................................................................................... 3
1.2 Grandezze fisiche e Unità di Misura.................................................................. 3
1.2.1 Grandezze fondamentali nel Sistema Internazionale ..................................... 4
1.3 Definizioni ......................................................................................................... 5
1.4 Stato del sistema ................................................................................................ 6
1.5 Trasformazioni Termodinamiche ...................................................................... 7
1.6 Temperatura ....................................................................................................... 8
1.6.1 Principio zero della termodinamica ............................................................. 8
1.6.2 Scale Termometriche ................................................................................... 9
2 Le Proprietà delle sostanze pure............................................................................ 10
2.1 Fasi di una sostanza pura ................................................................................. 10
2.2 Cambiamenti di fase ........................................................................................ 11
2.3 Diagrammi Termodinamici.............................................................................. 12
ÇENGEL, Termodinamica e Trasmissione del Calore McGraw-Hill, New
York,1998.
COMINI, Lezioni di Termodinamica Applicata , S.G.E. Ed., Padova.
COMINI, CORTELLA Fondamenti di Trasmissione del Calore S.G.E. Ed.,
Padova.
GUGLEMINI,PISONI, Elementi di Trasmissione del Calore , Veschi, Milano.
INCROPERA,DEWITT Fundamentals of Heat and Mass Transfer, Wiley, New
York.
KREITH, Principi di Trasmissione del Calore, Liguori, Napoli, 1974.
SPIGA, Esercizi di Fisica Tecnica , Progetto Leonardo, Bologna.
CORTICELLI, Esercizi di Fisica Tecnica 2, Termocinetica, Mutina Libri,
Modena.
GREGORIO, Fisica Tecnica. Esercizi svolti, Levrotto e Bella, Torino.
http://www.ing.unimore.it/facolta/insegnamento.asp?IdAA=489
1.2.1 Grandezze fondamentali nel Sistema Internazionale
(Decreto Presidente della Repubblica 12/8/1982, n. 802)
1.
Concetti Fondamentali della Termodinamica
1.1
Introduzione
Termodinamica: scienza che studia l’energia (meccanica, termica, …..) e i suoi
cambiamenti
Conservazione dell’energia: durante un’interazione
l’energia può trasformarsi da una forma ad un'altra,
rimanendo nel suo complesso costante.
Grandezza
Unità di misura
Lunghezza
metro (m)
Massa
kilogrammo (kg)
Tempo
secondo (s)
Temperatura
grado kelvin (K)
Intensità di corrente
ampere (A)
Intensità luminosa
candela (cd)
Quantità di materia
mole (mol)
Unità di misura campione
Grandezze derivate [A]=[L2]
Prefissi dei Multipli e sottomultipli
tera, T
1012
L’energia ha qualità oltre che quantità:
es. raffreddamento di un corpo = degradazione
dell’energia in una forma meno utilizzabile
Termodinamica classica = studio macroscopico della materia
1.2
Grandezze fisiche e Unità di Misura
Misura:Numero + Simbolo (Unità di Misura) (+ Incertezza)
Numero infinito di Grandezze:
(lunghezza, area, volume, tempo, velocità, potenza
volume specifico, viscosità dinamica, calore specifico, ecc..)
Numero elevato di unità di misura
(lunghezza: metro, centimetro, piede, pollice, spanna, pertica, ecc. )
Numero elevato di campioni per grandezza e unità di misura
(lunghezza su muro di ogni Comune Medioevale)
109
giga, G
10
6
10
3
kilo, k
10-2
centi, c
10-3
milli, m
-6
10-9
micro, µ
nano, n
10-12
pico, p
10
mega, M
Esempi corretti: kN, km, °C, K, newton, metri, s
Esempi NON corretti: chilo , KM, C, °K, newtons, m. , sec
Il peso si misura in Newton (N)
la massa si misura in chilogrammi (kg)
Le bilance indicano la massa
1.3
Definizioni
1.4
Sistema, Ambiente, Contorno o confine
Stato del sistema
Proprietà del sistema (T, V, m, ρ, p, ecc.)
Proprietà estensive (m, V, E, ecc.)
Proprietà specifiche (v=V/m, e=E/m, ecc.)
Proprietà intensive (T, p, ecc.)
Stato del sistema (in equilibrio termodinamico)
Equilibrio termodinamico
Equilibrio Meccanico
aperti
Sistemi: chiusi
Sistema isolato (meccanicamente e/o termicamente)
Sistema isolato termicamente = adiabatico
Energia di un sistema
Equilibrio Termico ⇒
Equilibrio di fase
Equilibrio Chimico
Equilibrio Elettrico
Proprietà Indipendenti (per definire lo stato)
Esempio p e T per bifase NON indipendenti
Regola delle fasi nPI=ncomponenti+ 2-nfasi
Energia totale = ener. cinetica + ener. potenziale + ener. Interna
2
mw
+ mgz + U [J ]
2
J
w2
e = ec + e p + u =
+ gz + u
2
kg
E = Ec + E p + U =
Valore assoluto e Variazione
Calore o lavoro: quantità di energia scambiata fra sistemi e ambiente
Un sistema monofase omogeneo (sistema semplice comprimibile) trascurando
effetti gravitazionali, magnetici, ecc., viene completamente determinato da due
proprietà intensive e indipendenti
1.5
Trasformazioni Termodinamiche
Trasformazioni Isoterme, Isobare, Isocore
Trasformazione: cambiamento del sistema da uno stato di equilibrio ad un altro
Trasformazione ciclica
Trasformazione quasi statica o di quasi equilibrio
Diagrammi Termodinamici
1.6
Temperatura
Due corpi a contatto raggiungono l’equilibrio termico
1.6.1 Principio zero della termodinamica
Due corpi, anche se non in contatto fra loro, sono in equilibrio termico se sono
entrambi in equilibrio termico con un terzo corpo
Tale terzo corpo può essere un termometro
1.6.2 Scale Termometriche
2 Le Proprietà delle sostanze pure
Definizione di sostanza pura
2.1
Fasi di una sostanza pura
solido
liquido
aeriforme (vapore+gas)
T ( K ) = T ( ° C ) + 273 . 15
∆ T ( K ) = ∆ T ( °C )
(azoto, acqua, aria)
2.2
Cambiamenti di fase
2.3
Diagrammi Termodinamici
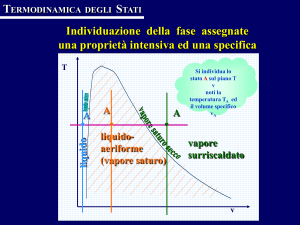
Diagramma T-v
Liquido sottoraffreddato
Liquido saturo (punto 2)
Miscela satura di liquido e vapore
Vapore saturo (pumto 4)
Vapore surriscaldato
Temperatura di saturazione e Pressione di saturazione
Diagramma p v
Diagramma p T
Superficie p v T per l’acqua
Estensione alla fase solida
solidificandosi
diminuisce
di Volume
solidificandosi
aumenta
di Volume
Acqua
2.4
Entalpia
H = U + pV ( J )
h = u + pv ( J / kg )
2.4
Tabelle delle proprietà
2.3.1 vapori e liquidi saturi
l = liquido saturo
v = vapore saturo
lv= differenza fra i due valori
s=saturazione
2.3.2 miscela satura liquido-vapore
Titolo della miscela satura
x=
mv
mv
=
mt
ml + m v
0<x<1
Proprietà della miscela satura
V = Vl + V v
mt v = ml v l + m v v v
mt v = ( mt − mv )v l + mv v v
v = ( 1 − x )v l + xv v
v = v l + xvlv
( m 3 / kg )
u = u l + xu lv
h = hl + xhlv
v lv = v v − v l
2.3.3 liquido sottoraffreddati
Errori modesti se si valuta la proprietà come liquido saturo alla stessa T
Correzione per h
hlv: Entalpia di vaporizzazione o calore latente di vaporizzazione (r).
2.3.4 vapori surriscaldati
h ≈ hl @ T + v l @ T ( p − p s @ T )
2.4 Gas Ideali
2.4.1 scostamento da gas ideale
Z=
pv = RT
R=
Ru
M
Ru = 8314
J
kmol K
Aria secca
Azoto
Ossigeno
Idrogeno
Elio
Argon
Anidride Carbonica
V
→
m
m = MN →
R
R= u →
M
V = Nv →
v=
pV = mRT
pV = MNRT
pV = NRu T
pv = R u T
pv
⇒ pv = ZRT
RT
Legge degli stati corrispondenti:
A parità di pressione ridotta
pr =
p
T
T =
p c e di temperatura ridotta r Tc tutti i gas
hanno lo stesso valore del fattore di compressibilità Z (e quindi del volume specifico)
Equazione di stato di Van de Waals
a
p + 2 (v − b ) = RT
v
a termine legato alle forze di attrazione
b covolume o volume occupato dalle molecole del Gas