S.I.C.S.I. VIII Ciclo
Università degli Studi di Napoli “Federico II”
Chimica degli elementi nell’ambiente
Professore: Salvatore Andini
Lezione destinata agli alunni di un Istituto Tecnico
Industriale ad Indirizzo Chimico (II anno)
Prerequisiti
• Principi base di chimica generale;
• Cenni di chimica organica.
Obiettivi
La comprensione dei problemi legati alla dispersione del
piombo dell’ambiente.
Gli elementi del gruppo 14 hanno una chimica prevalentemente caratterizzata da composti covalenti.
Stagno e Piombo formano anche composti ionici poco stabili nello stato +4, più stabili nello stato +2.
Proprietà chimico-fisiche
Gruppo IVA
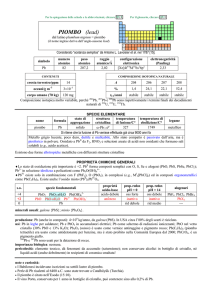
Stati di ossidazione: +2, +4.
Temperatura di fusione: 327°C.
Densità: 11.34 g/cm3 (leggermente
inferiore a quella del mercurio: sul
mercurio galleggia).
Dal latino plumbum che presumibilmente proviene dal greco πελιος, (blunerastro).
Metallo tenero (si lascia tagliare col coltello), duttile (si può facilmente
ridurre in fili sottili) e malleabile (si può facilmente ridurre in fogli
sottili).
Assume maggiore durezza in lega con altri metalli (Sb, As, Cu).
Proprietà chimico-fisiche
Appena tagliato è lucente ma all’aria
diventa rapidamente opaco per la
formazione di ossido (PbO).
Facilmente attaccato dagli agenti
chimici e atmosferici, si ricopre di
uno strato protettivo.
A contatto con H2SO4 si forma un velo di PbSO4.
L’acqua non lo scioglie: piccole percentuali di CO2 in
essa presenti formano uno strato di PbCO3.
All’aria umida si forma uno strato di ossido che si
carbonata per azione della CO2.
Potenziali di riduzione del piombo
Pb2+ + 2e- = Pb(s)
0.126V
E°= -
PbO2 + 4H+ + 2e- = Pb2+ +2H2O
E°= 1.46V
In soluzione acida PbO2 è un energico ossidante.
Alcune reazioni del piombo
3Pb + 8HNO3 = 3Pb(NO3)2 +2NO + 4H2O
Pb è attaccato facilmente da HNO3.
2Pb + O2 + 4H+ = 2Pb2+ + 2H2O
Ossidazione di Pb in ambiente acido
in presenza di O2.
Alcuni termini di uso comune…
Piombare: (ad es. un dente) otturare un dente con piombo o con
lega metallica.
Piombatura: deposizione di un sottile strato di piombo su metalli
(ad es. ferro) per proteggerli dall’azione aggressiva di agenti
chimici (acido solforico, ecc.).
Piombino: pezzetto di piombo che si fissa alla lenza affinché in
acqua non sia trascinata dalle correnti.
Plumbeo: che ha il colore del piombo (cielo plumbeo).
Aplomb: il mantenersi diritto
Comportamento imperturbabile.
(come
il
filo
a
piombo).
Composti del piombo in natura
PbS solfuro di piombo o galena
PbCO3 carbonato di piombo o cerussite
PbSO4 solfato di piombo o anglesite
Preparazione del piombo dalla galena
Si effettua un parziale arrostimento del minerale che produce
una miscela di ossido e solfato.
A temperatura più elevata tali composti reagiscono con l’eccesso
di solfuro dando il metallo.
3PbS + 5O2 = 2PbO + PbSO4 + 2SO2
PbS + 2PbO = 3Pb + SO2
PbS + PbSO4 = 2Pb + SO2
Il metallo così ottenuto è impuro: si purifica mantenendolo fuso
all’aria e lasciando separare le scorie di ossidi insolubili.
Usi
Il piombo e i suoi composti hanno molteplici usi, che recentemente
si cerca di limitare a causa della consapevolezza della sua tossicità
e del danno indotto dalla sua dispersione non controllata
nell'ambiente.
• Tubazioni
• Recipienti e rivestimenti
• Munizioni
• Vernici
• Come antidetonante nelle benzine (Pb(CH2CH3)4)
• Accumulatori a piombo
• Schermi per i raggi X
Tossicità
A volte capita
che gli operai
che lo maneggiano
sono nei guai:
esso si accumula
nell’organismo
dove dà origine
al saturnismo…
Saturnismo: nome medico
dell'avvelenamento da piombo.
Nelle pratiche alchemiche il
piombo era collegato con il
pianeta Saturno.
Tossicità
Assorbito essenzialmente attraverso la respirazione e la
nutrizione, il piombo non viene metabolizzato, ma per larga parte
escreto, mentre il resto (circa 20%) si distribuisce nei tessuti e
in particolare:
•nel sangue, ove circola quasi esclusivamente negli eritrociti;
•nei tessuti minerali (ossa e denti), ove si accumula;
•nei tessuti molli (reni, midollo osseo, fegato e cervello).
La tossicità del Pb deriva in larga misura dalla sua capacità
di 'imitare' il calcio, ovvero di sostituirsi ad esso.
Neurotossicità
Il piombo supera agevolmente
barriera emato-encefalica.
la
Sintomi
Anemia e sintomi a livello del sistema nervoso
centrale, della circolazione periferica (con incarnato
terreo), dell’apparato osteomuscolare (con dolori
articolari), del tubo digerente, dei reni. Lo stadio
finale è la cachessia.
Cure
Si fa uso di farmaci che esercitano
un'azione 'chelante' sul metallo, ovvero
molecole in grado di legare il piombo
formando un complesso stabile che viene
escreto. Uno dei farmaci più utilizzati per
questa terapia è il calcio-EDTA.
Avvelenamento da piombo
Gli antichi Romani lo usavano per le condotte
idriche e per i recipienti adibiti alla cottura dei
cibi.
L’uso dei recipienti di piombo migliorava il sapore
dolce dei cibi.
In realtà gli acidi contenuti nei cibi estraevano il
piombo dal vasellame.
L’acetato di piombo è anche noto come zucchero
di piombo.
Acquedotto
Le fistulae aquariae erano le tubazioni in
piombo utilizzate negli acquedotti romani.
Fistulae aquariae
Avvelenamento da piombo
Alcuni storici attribuiscono al
piombo la causa della demenza
che
afflisse
molti
degli
imperatori romani.
Essi bevevano in coppe di peltro
con base di piombo.
La demenza di Giorgio III, re
d’Inghilterra durante la Rivoluzione americana potrebbe aver
avuto origine in un avvelenamento da piombo.
Purtroppo i suoi
cuochipreparavano
il cibo in pentole di
piombo.
Caligola
Nerone
Composti del piombo nell’ambiente
Per millenni i sali di Pb sono
stati impiegati come pigmenti
in quanto possiedono colori
solidi e brillanti. In tempi
abbastanza recenti sono stati
usati per produrre i colori
delle riviste su carta patinata
e sugli involucri per alimenti.
Sono stati usati come agenti
coloranti in vari alimenti.
I pallini di piombo sono munizioni usate dai
cacciatori di uccelli acquatici.
Molte anatre e oche che sopravvivono alle
ferite subiscono danni o muoiono a causa
dell’ingestione di pallini di piombo che si
sciolgono nel loro organismo.
PbCrO4: è il pigmento
giallo usato per le strisce
del manto stradale.
Pb3O4: è un ossido misto
(2PbO PbO2) indicato con
il nome di minio o piombo
rosso. E’ impiegato nelle
vernici
resistenti
alla
corrosione.
Anche uccelli da preda che si nutrono delle
anatre o di altri volatili che, “impallinati” dai
cacciatori, non vengono poi raccolti subiscono
avvelenamento da piombo.
Composti del piombo nell’ambiente
PbO
PbCO3 · 2Pb(OH)2
Solido giallo usato nell’Antico
Egitto per invetriare la ceramica.
Il materiale viene fuso come una
sottile pellicola sulla superficie
della ceramica per renderla
impermeabile
e
donarle
lucentezza.
La dissoluzione
segue:
avviene
come
PbO(s) + 2H+ = Pb2+ + H2O
Il vasellame invetriato è ancora
oggi principale fonte di Pb
assunto con gli alimenti.
Il piombo bianco detto anche biacca è stato
abbondantemente usato fino alla metà del
secolo scorso come componente della vernice
bianca per interni.
Quando la vernice si stacca dalla parete, esiste
però il pericolo che i bambini possano ingerire
questo materiale, anche perché il Pb2+ ha un
sapore dolce.
Attualmente la biacca è stata sostituita da
TiO2.
I pigmenti di Pb continuano ad essere usati
nelle pitture per esterni, cosicché si può
facilmente verificare un inquinamento da Pb nel
suolo che circonda le abitazioni.
Accumulatori al piombo
PbO2(s) + 4H+(aq) + SO42-(aq) + 2e- = PbSO4(s) +2H2O
Pb(s) + SO42- = PbSO4(s) + 2e-
Acc. carico Acc. in carica
E°=+1.69V
E°=-0.36V
Accumulatore al piombo
Accumulatori al piombo
La reazione complessiva è:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(aq)
Si tratta di una reazione reversibile. I reagenti vengono
ripristinati durante il processo di ricarica che avviene
dopo la partenza del motore.
La maggior parte degli accumulatori ormai in disuso
sono riciclati per il loro contenuto di Pb. Durante questa
operazione il metallo può essere disperso nell’ambiente.