Interazione ospite-parassita:
PATOGENESI BATTERICA
ESPOSIZIONE
Principali fasi del
processo patogenetico
ADESIONE
INVASIONE
COLONIZZAZIONE
CRESCITA
TOSSICITA’
INVASIVITA’
DANNO AI TESSUTI
Proteine batteriche extracellulari che possono essere considerate
INVASINE
TABLE 3. SOME EXTRACELLULAR BACTERIAL PROTEINS THAT ARE
CONSIDERED INVASINS
Invasin
Bacteria Involved
Activity
Hyaluronidase
Streptococci,
staphylococci and
clostridia
Degrades hyaluronic of connective tissue
Collagenase
Clostridium species
Dissolves collagen framework of muscles
Neuraminidase
Vibrio cholerae and
Shigella dysenteriae
Degrades neuraminic acid of intestinal mucosa
Coagulase
Staphylococcus aureus
Converts fibrinogen to fibrin which causes clotting
Kinases
Staphylococci and
streptococci
Converts plasminogen to plasmin which digests fibrin
Leukocidin
Staphylococcus aureus
Disrupts neutrophil membranes and causes discharge
of lysosomal granules
Streptolysin
Streptococcus pyogenes
Repels phagocytes and disrupts phagocyte membrane
and causes discharge of lysosomal granules
Hemolysins
Streptococci,
staphylococci and
clostridia
Phospholipases or lecithinases that destroy red blood
cells (and other cells) by lysis
Lecithinases
Clostridium perfringens
Destroy lecithin in cell membranes
Phospholipases Clostridium perfringens
Destroy phospholipids in cell membrane
Anthrax toxin
Bacillus anthracis
One component (EF) is an adenylate cyclase which
causes increased levels of intracellular cyclic AMP
Pertussis toxin
Bordetella pertussis
One toxin component is an adenylate cyclase that acts
locally producing an increase in intracellular cyclic
AMP
L’ADESIONE DEI BATTERI ALLE SUPERFICI
E’ LA PRIMA TAPPA PER LA
COLONIZZAZIONE DELL’OSPITE
Quindi è la prima tappa del
processo infettivo
LA COLONIZZAZIONE BATTERICA
La colonizzazione (capacità di invadere e moltiplicarsi) è
la risultante dei meccanismi di virulenza che permettono
al batterio di:
1. Aderire alle cellule dell’ospite;
2. Invadere i tessuti dell’ospite;
3. Resistere all’immunità innata;
4. Evadere l’immunità adattiva;
5. Competere per i nutrienti.
Un microrganismo è patogeno se è in grado di
invadere e moltiplicarsi con conseguente
danneggiamento dell’organismo ospite
La PATOGENICITA’ dipende da:
fattori di virulenza
carica batterica (numero iniziale di batteri che infettano)
stato di salute, in particolare immunitario, dell’ospite
COS’E’ UN PATOGENO ?
MICRORGANISMO IN GRADO DI ADERIRE ED INVADERE I
TESSUTI
DELL’OSPITE
E
DI
MOLTIPLICARVISI,
DANNEGGIANDONE
IL
NORMALE
FUNZIONAMENTO
(MALATTIA)
A. Patogeni Veri
Inducono sempre una malattia in ospiti “normali”
Non richiedono alcun fattore predisponente (Chlamydia, gonococco,
influenza)
B. Patogeni Opportunisti (o Occasionali)
Inducono malattia solo in ospiti debilitati
Alterazione dei meccanismi di difesa dell’ospite (Pseudomonas,
enterococchi)
•Esposizione al patogeno (aria,
acqua, cibo, contatto diretto,
vettore)
•Adesione alla pelle o alle mucose
•Invasione attraverso l’epitelio.
•Colonizzazione e crescita (e/o
completamento del ciclo biologico)
•Evasione delle difese immunitarie
dell’ospite
•Capacità di danneggiare l’ospite
(tossicità).
•Ritorno al serbatoio/diffusione
LE MALATTIE INFETTIVE AD ECCEZIONE DI
QUELLE CAUSATE DALLA DIRETTA
PENETRAZIONE DEI MICRORGANISMI
ALL’INTERNO DEI TESSUTI O NEL
TORRENTE CIRCOLATORIO, HANNO SEMPRE
INIZIO CON LA COLONIZZAZIONE DEL
BATTERIO PATOGENO, CIOE’ CON IL SUO
INSEDIAMENTO SULLA CUTE O SULLE
MUCOSE.
• COLONIZZAZIONE TRANSIENTE quando il
microrganismo viene eliminato senza interferire
con l’ospite
• COLONIZZAZIONE PERMANENTE
se
invece i microrganismi proliferano ed invadono
la superficie dell’organismo
Colonizzazione delle mucose
Adesione
FATTORI DI ADESIONE BATTERICA (adesine)
Fimbrie o Pili
Strutture filamentose utili ai batteri nell’attacco ad altri
microrganismi oppure a superfici solide
Glicocalice o
capsula
Strato di fibre esopolisaccaridiche con un margine esterno
distinto che circonda molte cellule; inibisce la fagocitosi e
agevola l’adesione
Strato S
Strato più esterno, a struttura regolare, dei rivestimenti
cellulari di determinati batteri che possono promuovere
l’adesione alle superfici
Mucillagine
extracellulare
Pellicola batterica meno compatta di una capsula e facilmente
asportabile
Acidi teicoici o
lipoteicoici
Componenti della parete cellulare dei batteri Gram-positivi che
agevolano l’adesione
Esempi di
meccanismi di
adesione
batterica
PILI o FIMBRIE
E. coli with fimbriae
strutture proteiche (pilina), lineari, a
centinaia intorno al batterio che
favoriscono l’adesivita’ (nomi alternativi:
lectine, evasine, aggressine)
Funzione dei pili: adesione
Come fattore di adesivita’ le punte delle
fimbrie contengono delle proteine (lectine) che
legano specifici zuccheri (e.g., mannosio)
Adesività di E. coli alle cellule
della mucosa urinaria
Adesività medianta da fimbrie
Proteine della superficie batterica
Adesine
che riconoscono recettori specifici
presenti sulla superficie della
cellula ospite
Capsula e
glicocalice
strato lasso, viscoso polisaccaridico
o proteico che circonda i batteri
gram+ e gram– Nel caso sia poco
aderente e poco uniforme per
densita’ e spessore, questo
materiale e’ definto glicocalice
Capsula
All’esterno della parete cellulare
Ben definita: capsula
Non definita: glicocalice
generalmente polisaccaridica
Spesso assente in vitro
Presente in vivo e protettiva
Funzione capsula: adesione aspecifica
In Streptococcus mutans permette di aderire e colonizzare
lo smalto dentale ed innescare il processo cariogeno
BIOFILM
Comunità di cellule batteriche racchiuse
in una matrice polimerica prodotta dalle
stesse cellule e aderente ad una
superficie inerte o vitale
MICRORGANISMI-GLICOCALICE-SUPERFICIE
INFEZIONI BATTERICHE sostenute da VERI PATOGENI
Vibrio cholerae, Yersinia pestis, Salmonella typhi,Shigella
dysentereriae, Streptococcus pyogenes etc.
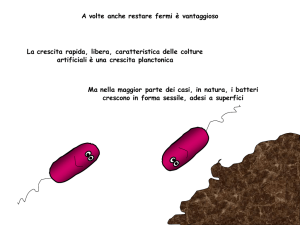
Presenti in forma PLANCTONICA:
Possono essere eradicate dagli antibiotici e prevenute dai vaccini
INFEZIONI BATTERICHE sostenute da batteri della
POPOLAZIONE MICROBICA NORMALE
Organizzati nei tessuti in forma SESSILE sotto forma di BIOFILM
Spesso non sono eradicate dagli antibiotici
Microrganismi produttori di Biofilm
>50% delle infezioni sono sostenute da specie
batteriche che sono nostri commensali o
comuni microrganismi dell’ambiente quali:
S. epidermidis e P. aeruginosa
S. epidermidis e P. aeruginosa causano
infezioni croniche nel paziente compromesso
molto spesso a causa del biofilm
Staphylococcus epidermidis
sulla superficie di un catetere
INFEZIONI NATURALI
PRODOTTE DA BIOFILM
Carie dentale
Peridontiti
Colecistiti
Osteomieliti
Prostatite batterica
Endocarditi
Sostenute da:
POPOLAZIONE MICROBICA
SAPROFITICA
Organizzati nei tessuti in forma:
SESSILE
sotto forma di:
BIOFILM
Otite media
Sinusite
Esacerbazioni acute di bronchite
Dove si forma il Biofilm?
Si sviluppa preferenzialmente su superfici
inerti (protesi, cateteri) o tessuti morti,
ma può formarsi anche su tessuti vivi
(endocardite)
Si sviluppa lentamente e le infezioni
correlate impiegano parecchio tempo a
dare sintomi importanti
Composizione del Biofilm
Esopolisaccaridi di
natura batterica e
principalmente H2O
Matrice di natura
anionica che cattura
minerali e nutrienti
dall’ambiente
Microrganismi
appartenenti ad
un’unica specie
batterica o da più
specie inclusi miceti.
Formazione del Biofilm
Ogni cellula batterica adesa
al biofilm forma una
microcolonia che risulta
tenacemente avvolta in una
abbondante matrice adesiva
extracellulare solitamente
non prodotta in altre
condizioni.
Attacco della cellula planctonica
Adesione reversibile ad una superficie biologica
Adesione irreversibile via ligandi specifici
Replicazione batterica
Secrezione di una matrice organica complessa
Interazione della matrice con i fluidi ambientali
Maturazione del biofilm
Processo di adesione batterica
Superficie inerte: interazioni non specifiche ad es.
idrofobiche, elettrostatiche
Tessuti: meccanismi molecolari, ligandi, lectine, adesine
Le forme planctoniche aderiscono in aggregati e
l’adesione di una specie promuove l’adesione di altri
batteri
Il passaggio dalla forma planctonicaa quella sessile
potrebbe essere regolato geneticamente
le cellule si staccano dal biofilm in modo programmato
Processo di maturazione
Aumento complessità
oltre ai batteri troviamo molecole organiche
ed inorganiche dell’ambiente, proteine della
risposta infiammatoria, proteine del
complemento, fibrinogeno, fibronectina e
glicosaminoglicani
Aumento della massa fino ad un punto di
equilibrio dinamico con generazione di forme
planctoniche e batteri morti nello strato più
profondo del biofilm per mancanza di
nutrienti, diminuito pH, pO2 e accumulo di
metaboliti tossici
Fisiologia Del Biofilm
Le cellule sessili hanno accesso limitato a fonti
energetiche e difficoltà ad eliminare le scorie cataboliche
Nello spessore del biofilm in formazione si determinano
condizioni di: PH, perfusione di ossigeno, osmolarità non
omogenee
Raggiunta una massa critica viene stabilito un equilibrio
dinamico:
Dalla superficie si generano ondate planctoniche che
migrano e colonizzano altre zone
Le cellule degli strati interni divengono QUIESCENTI
Il processo è regolato dal quorum sensing
(Costerton, Nature, 2002)
Il processo è regolato dal
Quorum Sensing
Quando la popolazione
batterica raggiunge una
concentrazione critica,
una molecola dà il
segnale per lo sviluppo
del biofilm
Nel biofilm i batteri
continuano a comunicare
tra loro per controllare
l’equilibrio del biofilm e
la produzione di fattori
di virulenza
Quorum Sensing
I batteri hanno evoluto dei sistemi per “contarsi” ed
esprimere determinati geni solo quando la loro
popolazione raggiunge una determinata dimensione,
ovvero un “quorum”.
Questo fenomeno consente a tutte le cellule di una
popolazione microbica di regolare, in modo coordinato,
l’espressione di una serie di geni in funzione della
densità della popolazione stessa.
Si attua mediante la produzione, secrezione
percezione di molecole segnale specifiche.
e
Biofilm e Immunità
Le cellule sessili rilasciano Antigeni che stimolano la
produzione di Anticorpi, ma gli Ac non riescono ad
uccidere i batteri all’interno del biofilm Ciò può
determinare danno da immunocomplessi nel tessuto
circostante
Anche nel paziente con eccellente risposta
immunitaria cellulare e umorale le infezioni da
biofilm sono raramente risolte dai soli meccanismi
di difesa dell’ospite
Resistenza alla fagocitosi
Inibizione dell’attività del complemento
Biofilm e Terapia antibiotica
La terapia antibiotica riduce i sintomi
causati dalle forme planctoniche rilasciate dal
biofilm, ma non riesce ad uccidere le forme
sessili
Le infezioni da biofilm tipicamente danno
recidive dopo trattamento antibiotico finchè
la popolazione sessile non è rimossa
chirurgicamente
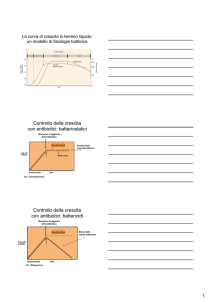
Biofilm: resistenza agli antibiotici
1-inattivazione dell’antibiotico
I batteri all’interno del biofilm possono
continuare a produrre enzimi inattivanti
2-impermeabilità
L’antibiotico non riesce a superare la
barriera del biofilm
3- condizioni fisiologiche alterate
La ridotta velocità di replicazione
determina resistenza a -lattamici e
fluorochinoloni
La bassa tensione di O2 e l’accumulo
di cationi riducono l’attività degli
aminoglicosidi