PROPRIETA’ PERIODICHE DEGLI ELEMENTI
RAGGIO ATOMICO
+
XX
+
e-X
Xee--+ +
X
X
+
1/2(EI+AE)
ENERGIA DI IONIZZAZIONE (IE)
AFFINITA’ ELETTRONICA (EA)
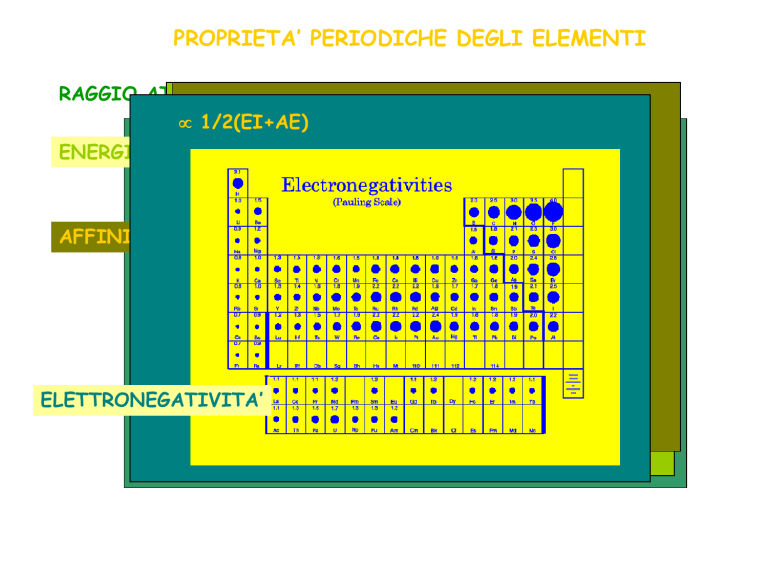
ELETTRONEGATIVITA’
Gruppo IA- metalli alcalini: litio, sodio, potassio, rubidio, cesio e francio
L'idrogeno, pur facendo parte del gruppo IA, non è un metallo alcalino.
-elevata reattività: in natura essi non si trovino mai allo stato elementare ma sotto
forma di composti.
-caratteristiche spiccatamente metalliche: possono essere tagliati con qualsiasi
lama e piegati o schiacciati con le dita.
-reagiscono con l'acqua per formare gli idrossidi generando soluzioni altamente
alcaline e idrogeno
Gruppo IIA-metalli alcalino terrosi: berilio, magnesio, calcio, stronzio,
bario, radio.
-elevata reattività: non esistono in natura allo stato elementare ma solo sotto
forma di composti.
-Formano facilmente cationi bivalenti Me2+ e come tali si ritrovano nei composti. Hanno comportamento metallico tanto più spiccato quanto maggiore è il valore
del numero atomico.
Gruppo IIIA-metalli terrosi: boro, alluminio, gallio, indio, tallio
-reattivi e pertanto non si trovano in natura allo stato elementare.
-l'alluminio che è il metallo più diffuso in natura e costituisce circa il 7,5%
della crosta terrestre.
-La struttura elettronica esterna dei metalli terrosi è s2p. Tali elementi
riescono però facilmente a promuovere un elettrone dell’orbitale s in un
orbitale p con formazione di ibridizzazione sp2
-A causa dei bassi valori dell'elettronegatività, gli elementi del terzo gruppo,
come d'altronde quelli del primo gruppo e del secondo gruppo non
presentano numeri di ossidazione negativi
Metalli di transizione (blocco d):
-caratteristiche metalliche: sono duri, buoni conduttori di elettricità e di
calore, hanno elevati punti di fusione e di ebollizione.
-Formano facilmente composti di coordinazione a causa della presenza di
orbitali di tipo d parzialmente riempiti.
I semimetalli: boro, silicio, germanio, arsenico, antimonio, tellurio e
polonio.
-presentano caratteristiche chimiche tipiche dei metalli o dei non metalli a
seconda che si combinino con non metalli o metalli rispettivamente.
-sono eccellenti semiconduttori, vengono utilizzati nella fabbricazione di
transistor e circuiti integrati
I non metalli: idrogeno, carbonio, azoto, ossigeno, fluoro, fosforo, zolfo,
cloro, selenio, bromo, iodio, astato e i gas nobili.
-aspetto opaco e sono cattivi conduttori di elettricità e di calore
-elevata tendenza che hanno di formare ioni
- danno luogo ossidi acidi quando reagiscono con ossigeno che a loro volta
formano acidi ternari reagendo con acqua
Gruppo VIIA-alogeni:
-hanno configurazione elettronica esterna s2p5 e il loro comportamento è in
massima parte dettato dal fatto che essi tendono a formare l'ottetto s2p6
-hanno un'elevata elettronegatività, anche se la tendenza ad acquistare un
elettrone diminuisce con l'aumentare del numero atomico.
-Il fluoro è l'elemento più elettronegativo della tavola periodica e nei suoi
composti ha numero di ossidazione -1; gli altri alogeni, invece, hanno anche
numeri di ossidazione positivi
Gruppo VIIIA- gas nobili: elio, neon, argo, cripto, xeno, rado
-sono tutti gas monoatomici
-talvolta essi si trovano insieme ad altri gas
-l'elio dopo l'idrogeno è l'elemento più diffuso nell'universo (circa 23%).
-presentano tutti l'ultimo livello di energia completo (ottetto elettronico) tranne
l’elio.
- chimicamente sono quindi inerti
IL LEGAME CHIMICO
IL LEGAME CHIMICO
Perché formare legami con altri atomi?
Regola dell’ottetto
Gli atomi degli elementi dei gruppi rappresentativi (sottogruppi A)
acquistano, perdono o condividono elettroni per raggiungere una
configurazione stabile come quella dei gas nobili con otto elettroni nel
guscio di valenza
Valenza
E’ la capacità di combinazione di un elemento, corrispondente al numero di
elettroni che il suo atomo mette in gioco nella formazione di legami chimici
Legame ionico
Legame covalente
LEGAMI FORTI
Legame metallico
LEGAME IONICO
Avviene tra elementi con elevata differenza di elettronegatività
E’ caratterizzato da un vero e proprio scambio di elettroni
Na → Na+ + 1e- (ossidazione)
Cl + 1e- → Cl- (riduzione)
per entrambi c’e il raggiungimento della configurazione del gas nobile
Gli ioni sodio e cloruro interagiscono elettrostaticamente formando un
solido cristallino di tipo ionico (sale) in cui ciascun ione è circondato da sei
ioni con segno opposto
LEGAME IONICO
Proprietà:
Solidi a temperatura ambiente
Elevata temperatura di fusione ed ebollizione
Scarsa conducibilità allo stato solido
Solubili in solventi polari
Elevata conducibilità allo stato fuso
Duri
Fragili
ALTA ENERGIA di LEGAME
LEGAME IONICO
Influenzato da:
Bassa energia di ionizzazione
Elevata affinità elettronica
Differenza di elettronegatività ≥ 2
E’ un processo esotermico → la formazione del legame avviene perché il composto
E’ PIU’ STABILE (ha minore energia)
La stabilità dell’impacchettamento è espressa dall’energia reticolare
L’energia reticolare aumenta con l’aumentare della carica
In alcuni casi è semplice prevedere la carica che si instaurerà sullo ione (Gr.IA,
IIA, IIIA, VIA e VIIA)
Metalli del Gr. IB (Cu, Ag, Au) danno ioni 1+ ; gr.IIB (Zn, Cd e Hg) danno ioni 2+
La maggior parte dei metalli di transizione perdono prima gli elettroni di valenza s
e poi quelli d: manifestano più di uno “stato di carica” (Cr2+; Cr3+, Fe2+, Fe3+)
LEGAME METALLICO
E’ responsabile dell’attrazione tra atomi di elementi metallici con la
conseguente formazione di aggregati cristallini
I metalli possiedono bassi valori di elettronegatività e di energia di prima
ionizzazione PERCIO’?
I cationi formatisi occupano posizioni fisse e ordinate nei cristalli metallici mentre gli
elettroni ceduti vengono messi in comune e costituiscono una nuvola elettronica molto
mobile responsabile delle proprietà macroscopiche di questi elementi.
Solo la presenza di elettroni liberi di muoversi riesce a spiegare l'elevata conducibilità
elettrica dei solidi metallici.
LEGAME METALLICO
Caratteristiche del legame
Proprietà del materiale
Punti di ebollizione e fusione
molto alti
Legami forti
Alta densità
Non solubilità
Duttile
Legami non direzionati
malleabile
Elettroni delocalizzati
Buoni conduttori di calore ed
elettricità
Opacità e lucentezza
LEGAME COVALENTE
Gli elettroni non vengono ceduti e acquisiti, ma condivisi da entrambi gli atomi
.
H + H → H2
Distanza del legame
La densità elettronica (carica negativa)
concentrata tra i nuclei dei due atomi (carica
positiva) fa da collante (interazione
elettrostatica) per la molecola.
RAPPRESENTATI DALLE
STRUTTURE DI LEWIS
LEGAME COVALENTE
Nel modello di Lewis la valenza di un elemento è associata al numero delle
coppie di elettroni condivise al fine di ottenere l’ottetto esterno
identità tra elettroni di valenza e il numero di gruppo di appartenenza
F (VII A)
O (VI A)
N (V A)
C (IV A)
Permette di prevedere quanti legami tenderebbe ad instaurare
l’elemento per completare l’ottetto
LEGAME COVALENTE
ORDINE di LEGAME
LEGAMI MULTIPLI
Per indicarediil numero
legami di
cheelettroni
uniscono→
duelegame
atomi si
usa parlare di ordine di
La condivisione
un’unicadicoppia
semplice
legame: esso rappresenta il numero totale di coppie di elettroni che partecipano al
legame tra due atomi
IN MOLTE MOLECOLE GLI ATOMI CONSEGUONO LA
L’ordine di legame
di un legame singolo
1, quello
di un legame
doppio è 2, ecc.
CONFIGURAZIONE
ELETTRONICA
DEIèGAS
MOBILI
CONDIVIDENDO
PIU’ L’ordine
DI UNAdiCOPPIA
ELETTRONI
legame (eDI
di conseguenza
l’uso di espressioni come legame singolo,
doppio o triplo) trova riscontro sperimentale nella sequenza delle lunghezze e delle
energie di legame: la lunghezza di legame diminuisce all’aumentare dell’ordine di
legame, mentre l’energia di legame aumenta.
Molecola
Ordine di legame Lunghezza (pm)
F2 Condivisione di 1
due coppie di elettroni
O2
2
DOPPIO LEGAME
N2 ( ossigeno)
3
Energia (kJ/mol)
Condivisione
di
142
159
tre coppie di elettroni
121
498
TRIPLO LEGAME
110(azoto)
945
La distanza tra due atomi legati diminuisce all’aumentare del numero di coppie
di elettroni condivise
Una struttura di Lewis
non rappresenta
un ritratto della vera
LEGAME
COVALENTE
struttura geometrica della molecola: è una mappa della
Rappresentazione delle
strutture di
distribuzione
deiLewis:
legami
La formulazione delle strutture di Lewis per la maggior parte dei composti e
degli ioni formati dagli elementi non metallici non presenta grosse difficoltà:
1. Sommare gli elettroni di valenza (ATTENZIONE se la specie è neutra, uno ione
positivo o ione negativo)
2. Scrivere i simboli degli atomi interessati in modo da mettere in evidenza i
collegamenti reciproci
3. Una volta definita la disposizione degli atomi, tracciare un legame semplice fra
quelli che si ritengono siano legati direttamente; riportare gli elettroni rimanenti sui
singoli atomi come coppie non condivise tentando di costruire un ottetto intorno a
ciascun atomo (escluso l’idrogeno)
a) Se ogni atomo ha un ottetto la struttura di Lewis è completa
b) Se le coppie di elettroni non sono sufficienti, allora una o più coppie non
condivise devono essere usate per creare legami doppi o tripli
c) Se le coppie son in numero superiore allora nel composto la regola
dell’otteto non vale
Modalità per scrivere le strutture di Lewis di: HF, N2, NH3, CH4, CF4, NO+
Esempi di formule di risonanza
nitrato (NO3-) ha 24- elettroni di valenza. Per soddisfare la
di formuleLo
diione
risonanza
Lo ione nitrato
(NO ) ha 24 elettroni di valenza (5 + 18 +1).
3
regola dell’ottetto,Per
si può
scrivere
la regola
struttura
a lato
soddisfare la
dell’ottetto:
Questa
l’esistenza
di due tipi di legame N-O: uno più
roni di valenza.
Perprevede
soddisfare
la
la strutturacorto
a lato(quello doppio) e due più lunghi (legami singoli)
Sperimentalmente
un unico tipo di legame N-O, di
tipi di legame
N-O: uno
più si osserva
FORME
RISONANTI
nghi (legamilunghezza
singoli) intermedia fra quella di un legame singolo e doppio:
questa struttura,
pur rispettando
la Formule
regola
dell’ottetto,
non la
Succede
talvolta che
per alcune
disostanze
risonanza
nico tipo di legame N-O,
di
rappresentadisposizione
correttamenteatomica
il legamenon
esistente
in NO3è
adeguatamente
Sperimentalmente
osserva
un unicositipo
legamepiù
N-O,
di lunghezza
i un legame singolo
eIndoppio:
alcuni casisiper
una molecola
puòdiscrivere
di una
struttura in cui la sola
descritta
da
una
sola
struttura
di
Lewis.
intermedia
fra quella di un
e doppio
a regola dell’ottetto, non
differenza
è la localizzazione
deilegame
legamisingolo
multipli
o delle coppie solitarie
La
vera
struttura
è
rappresentata
dalla
media
delle
3 strutture
me esistente in NO
3
esentata dalla media delle 3 strutture
Û
ozono
In questi casi la struttura della molecola è interpretata come un ibrido di
risonanza: la risonanza distribuisce il carattere di legame multiplo sugli
atomi che partecipano al legame
La struttura elettronica è data delle due formule e la risonanza è indicata
Il completamento
dell’ottetto
è sempre
appropriato
punto
di vista
energetico
completamento
dell’ottetto
nonnon
è sempre
appropriato
daldal
punto
di vista
energetico
esempio
in BF
elettroni
di valenza):
dAd
esempio
in BF
concon
24 24
elettroni
di valenza):
3 (molecola
3 (molecola
in questo
caso
laEccezioni
struttura
6regola
elettroni
intorno
a più
bassa
energia.
alla
dell’ottetto
questo
caso
la struttura
concon
6 elettroni
intorno
al BalèBaèpiù
bassa
energia.
La
struttura
elettroni
intorno
al boro
prevede
la cessione
di un
elettrone
struttura
concon
ottootto
elettroni
intorno
al boro
prevede
la cessione
di un
elettrone
daldal
1.
Un
gruppo
piuttosto
piccolo
costituito
da molecole
dotateladila
un
fluoro
al boro.
Una
carica
positiva
sull’atomo
elettronegativo
destabilizza
oro
al boro.
Una
carica
positiva
sull’atomo
piùèpiù
elettronegativo
destabilizza
Il
completamento
dell’ottetto
non
è
sempre
appropriato
dal
numero dispari di elettroni (ClO2, NO e NO2)
struttura.
uttura.
punto di vista energetico Ad esempio in BF3 (molecola con 24
elettroni di valenza):
in questo caso la struttura con 6 elettroni intorno al B è a
più2.bassa
energia.
Quando
attorno ad un atomo ci sono meno di otto elettroni (BF3)
(formazione di un legame dativo)
3. Presenza di più di otto elettroni nello stato di valenza di un
atomo (PCl5)
LEGAME COVALENTE
Quando il legame chimico si viene a formare tra due
atomi che hanno la stessa elettronegatività si parla di
legame covalente puro.
O + O O2
Quando i due atomi hanno una diversa propensione di
attrarre elettroni (diversa elettronegatività) il legame
è di tipo covalente polare con la conseguente
formazione di un dipolo elettrico (momento di dipolo
del legame).
+
H Cl
LEGAME COVALENTE
Regole:
numero di1. Ilossidazione:
caricadiformale
di un atomo
ottenuta
gli
numero di ossidazione
qualunque sostanza
allo stato
elementareassegnando
è ZERO
elettroni (Cl
dei
legami
covalenti polari all’atomo più elettronegativo che forma il
2, N
2)
legame. E’
la elementi
carica più
che
l’atomo avrebbe
il legame
fossenegativo,
ionico.eEs. H2O,
2. Gli
elettronegativi
assumono se
numero
di ossidazione
H2O2
la grandezza del numero di ossidazione corrisponde + o – alla valenza o al
numero dei legami a coppia di elettroni.
3. La somma dei numeri di ossidazione degli elementi presenti in una qualunque
molecola o ione deve uguagliare sempre la carica complessiva della specie. (OF2,
casoAlO
in2 )cui gli atomi coinvolti nel legame sono dello stesso elemento
Nel
(stessa elettronegatività)
gli gr.
elettroni
equamente
i due
4. Metalli (gr I A: n.o. 1+;
II A: n.o. vengono
2+;gr. III A:
Al: n.o. 3+; divisi
F: n.o. tra
O quasi sempre
n.o. -2
tranne neipuro
perossidi
dove èha0.n.o.
atomi che1;formano
il legame
covalente
e il n.o.
Es.-1)
O2
5. L’ H ha sempre n.o. +1, tranne negli idruri dei metalli dove ha n.o. -1
Geometria molecolare
La teoria VSEPR (Valence Shell Electron Pair Repulsion) è una semplice
teoria che ci permette di predire la geometria delle molecole in base ad
alcuni semplici principi.
Il principio base di tale legge dice:
Le coppie elettroniche di valenza si dispongono attorno ai nuclei il
più distante possibile tra loro in modo da diminuire la repulsione tra
le nuvole elettroniche.
Le coppie elettroniche di valenza comprendono le coppie di non
legame e le coppie di legame (dove un legame multiplo conta come una
singola coppia elettronica).
Le coppie di non legame occupano più spazio delle coppie di legame.
La geometria della molecola dipende dalla disposizione nello spazio delle coppie di
legame.
Geometria molecolare
(CO2)
(BF3,, O3)
(CH4, NH3, H2O, HF)
(PCl5)
(SF6, IF5)
Geometria molecolare
La geometria delle molecole determina proprietà chimico-fisiche diverse dei
composti:
molecole che possiedono un momento di dipolo non nullo (molecole polari) sono meno
volatili (passano allo stato vapore con più difficoltà) di molecole che hanno un momento
di dipolo nullo (molecole apolari).
Momento di dipolo non nullo
Molecola polare
+
OMomenti di dipolo
di legame
H +
H
FORMAZIONE di legami dipolo-dipolo
Momento di dipolo nullo
Molecola apolare
-
O
+
C
-
O
TEORIA DEL LEGAME DI VALENZA
La teoria VSEPR non dà indicazione sul tipo di legame che viene a formarsi:
I LEGAMI SINGOLO, DOPPIO O TRIPLO VENGONO comunque
CONSIDERATI COME una singola coppia di legame
La teoria del legame di valenza, descrive il legame
covalente mediante l’uso degli orbitali atomici dei singoli
atomi che formano il legame chimico e permette di ottenere
utili indicazioni sul tipo e sull’ordine di legame.
Il legame chimico tra due atomi si instaura se:
1) E’ presente almeno un orbitale semioccupato in entrambi gli atomi che formano il
legame.
2) Gli orbitali atomici semioccupati possiedono la giusta orientazione per sovrapporsi.
3) Questi orbitali che si sovrappongono hanno un’energia paragonabile
ORBITALI IBRIDI
Gli orbitali ibridi sono orbitali atomici ottenuti dal mescolamento (combinazione lineare)
degli orbitali atomici fondamentali.
Il mescolamento di N orbitali atomici fondamentali produce N orbitali atomici ibridi
degeneri (stessa energia).
ORBITALI IBRIDI
Tetraedrica
ORBITALI IBRIDI
Bipiramide trigonale
ORBITALI IBRIDI
ottaedrica
2 tipi di legami covalenti con orbitali ibridi:
● LEGAME σ: si tratta di un legame covalente normale fra due
atomi che coinvolge almeno un orbitale ibrido. La
sovrapposizione degli orbitali è in questo caso frontale e
circolare, l'asse del legame è simmetrico.
● LEGAME π: può formarsi unicamente in presenza di un
legame σ, si tratta di un legame che è decisamente diverso, gli
elettroni condivisi si pongono in un orbitale non ibrido e posti in
senso perpendicolare rispetto al legame precedentemente
descritto, si tratta di una sovrapposizione laterale di orbitali,
con asse centrale ma di forma chiaramente allungata.
LEGAME COVALENTE
Caratteristiche del
legame
covalete
Proprietà del materiale
Punti di ebollizione e
fusione molto alti
Legami forti
Elevate durezze
Non solubilità
Deformabili con difficoltà
Legami direzionati
Fragilità
Elettroni localizzati
Cattivi conduttori di
calore ed eletricità
Geometria molecolare
Un ulteriore esempio di relazione struttura-proprietà è dato dalle forme allotropiche
del carbonio
Le proprietà quali durezza,
conducibilità elettrica,
colore, etc. sono
completamente diverse tra
loro in queste tre forme
allotropiche del carbonio e
dipendono dal modo con cui
i vari atomi di carbonio si
legano tra loro.
IL LEGAME CHIMICO:legami deboli
Sono interazioni di natura elettrostatica. Ogni carica
elettrica (ione o dipolo elettrico associato ad una
molecola) genera un campo elettrico che può:
i) indurre orientazione di eventuali dipoli presenti;
ii) indurre polarizzazione in molecole polari;
iii) causare la formazione di dipoli indotti in molecole
apolari.
Le forze dipolo-dipolo manifestano un aspetto macroscopico misurabile
punto di ebollizione
AUMENTO DELLE TEMPERATURE DI EBOLLIZIONE E DI FUSIONE
STRUTTURA DEL GHIACCIO
IMPORTANZA BIOLOGICA DEI LEGAMI IDROGENO
La molecola di
DNA è costituita
da due catene.
Ciascuna catena è
tenuta unita da
legami covalenti
forti, ma milioni di
legami a idrogeno
legano una catena
all’altra per
formare la doppia
elica.
.
L’energia totale dei
legami a idrogeno
mantiene unite le
catene durante molti
processi. Tuttavia,
ciascun legame a
idrogeno è molto
debole. Dalla rottura
di un piccolo numero
i legami a idrogeno
per volta, le catene
possono separarsi
durante i processi
cruciali della sintesi
proteica e della
riproduzione
cellulare












