Mechanisms of Disease
Cardiac Plasticity
Joseph A. Hill, M.D., Ph.D., and Eric N. Olson, Ph.D.
N Engl J Med 2008;358:1370-80.
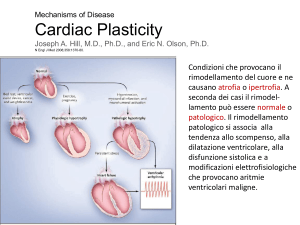
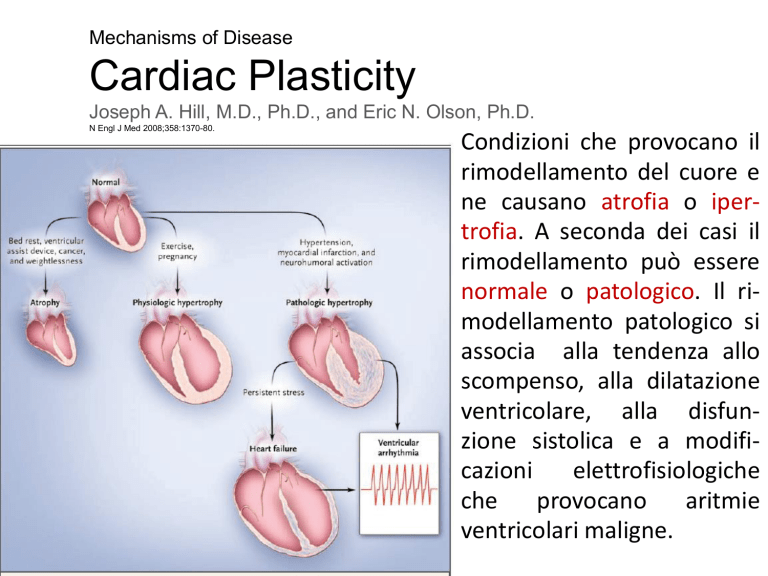
Condizioni che provocano il
rimodellamento del cuore e
ne causano atrofia o ipertrofia. A seconda dei casi il
rimodellamento può essere
normale o patologico. Il rimodellamento patologico si
associa alla tendenza allo
scompenso, alla dilatazione
ventricolare, alla disfunzione sistolica e a modificazioni
elettrofisiologiche
che
provocano
aritmie
ventricolari maligne.
Limiti dell’atrofia e della
ipertrofia cardiaca: il cuore
può andare incontro ad aumento o riduzione considerevole del volume, con un
ambito dinamico del 100%
L’ipertrofia di un organo è caratterizzata da un aumento delle
dimensioni delle cellule. Nell’accrescimento del cuore provocato
dall’esercizio o dalla gravidanza, la struttura e la funzione sono normali e
non vi è associazione con l’insufficienza cardiaca.
Nell’ipertrofia che si verifica nell’ipertensione, nell’obesità, nelle
malattie valvolari, dopo un infarto o in seguito ad alterazioni geniche
delle proteine contrattili, vi sono alla base alterazioni metaboliche,
strutturali e funzionali: il metabolismo vira verso la glicolisi (normalmente prevale il consumo di acidi grassi), i sarcomeri si disorganizzano, le correnti di calcio sono alterate, si riduce la contrattilità, si
perdono miociti che vengono sostituiti da fibroblasti, compare
disfunzione sistolica e/o diastolica e un “rimodellamento elettrico” (es.
alterazioni dell’espressione e/o della funzione delle pompe ioniche).
Tutto ciò rappresenta una serie di condizioni derivanti dalla plasticità
miocardica.
L’accrescimento del cuore segue, classicamente, tre modelli morfologici:
Rimodellamento concentrico: aumento dello spessore (relativo) delle
pareti senza aumento della massa;
Ipertrofia concentrica: aumento dello spessore (relativo) e della massa
con scarso aumento di volume; aggiunta di sarcomeri in parallelo e
accrescimento laterale delle cellule: causa frequente l’ipertensione
arteriosa e l’esercizio isometrico;
Ipertrofia eccentrica: aumento della massa e del volume delle camere;
lo spessore (relativo) può essere normale, aumentato o diminuito:
cause esercizio isotonico, sovraccarico di volume, perdita di tessuto
funzionante per infarto; aggiunta di sarcomeri in serie e allungamento
dei miocardiociti.
Fra gli atleti, quelli che hanno il cuore più grande sono i rematori, i
ciclisti e gli sciatori di fondo; lo spessore di parete in genere non supera
1,3 cm (limite superiore per sedentari 1,1 cm). Gli allenamenti stagionali
provocano variazioni stagionali delle dimensioni del cuore.
L’ipertrofia cardiaca da gravidanza regredisce in alcuni mesi
dopo il parto.
CURIOSITA’ INTERESSANTE: Nel
Pitone di Burma il consumo di
un pasto abbondante (vedi
Piccolo Principe: il pitone che ha
mangiato un elefante) si
accompagna ad un aumento del
metabolismo di circa 7 volte ed
uno straordinario aumento del
40% della massa cardiaca dopo
sole 48 ore dal pasto; tutto
ritorna alla norma in 28 giorni.
Al contrario delle modificazioni fisiologiche del cuore, l’ipertrofia
patologica è stimolata da attivazione neuroumorale, da un sovraccarico
emodinamico cronico o altri fattori di stress per il cuore. Anche il
rimodellamento patologico può essere intenso e rapido: la sintesi di
MHC (myosin heavy chain) aumenta del 35% poche ore dopo
l’esposizione ad un sovraccarico; l’iperespressione di un particolare gene
(Akt1) fa aumentare la massa cardiaca del 60% in sole 2 settimane.
Nell’ipertrofia cardiaca, le dimensioni dei miocardiociti aumentano e i
sarcomeri sono fortemente organizzati (grosse banda al microscopio
ottico). L’ipertrofia da esercizio tipicamente non comporta anche un
aumento del collagene miocardico. Confrontando l’ipertrofia da
esercizio con quella indotta dall’ipertensione i recettori dell’ormone
tiroideo e le diverse isoforme della catena pesante della miosina sono
regolati in maniera opposta. Le isoforme della miosina sono diverse, e
questo può contribuire a ridurre la contrattilità nelle forme patologiche.
In ratti sacrificati dopo un allenamento fisico i markers dell’ipertrofia
(geni che caratterizzano il fenotipo ipertrofico) sono inibiti.
Gli stimoli di pressione e volume (aumentati) inducono un’espressione
diversa di beta-miosina, actina alfa scheletrica e ATPasi del Ca2+ del
reticolo sarcoplasmico, anche con simili livelli di ipertrofia. Si è inoltre
dimostrato che quello che determina il fenotipo ipertrofico è la natura
dello stimolo, non il fatto che sia continuo o intermittente.
Visto che l’accrescimento del cuore ad un certo punto si arresta anche
se gli stimoli persistono e che regredisce quando gli stimoli vengono
rimossi, vi devono essere anche dei meccanismi che si oppongono
all’aumento di volume delle cellule. È improbabile che si tratti
semplicemente della rimozione degli stimoli. Nel muscolo scheletrico e
cardiaco l’attivazione della cascata di segnali che attivano la crescita è
accompagnata dall’inibizione di vie che promuovono la proteolisi e il
contrario accade nelle condizioni che portano all’atrofia. La plasticità dei
miocardiociti è spesso accompagnata dalla reinduzione di un
“programma genetico fetale”, nel quale l’espressione genica assomiglia a
quella che caratterizza lo sviluppo embrionale.
Quando il cuore si scompensa, le pareti ventricolari si assottigliano a
causa di una combinazione di proteolisi e morte cellulare. Si era pensato
che l’irrorazione sanguigna fosse insufficiente per il miocardio ipertrofico e quindi si sviluppassero condizioni di ischemia, ma questa ipotesi non è stata confermata da tutti gli studi. Si pensa anche alla
alterazione delle proteine contrattili, rimodellamento della matrice
extracellulare e fibrosi e variazioni dell’attivazione dei recettori beta
adrenergici. Più recentemente si è parlato di autofagia, un fatto che
riguarda il riciclo delle proteine e degli organelli intracellulari, nella
risposta dei miocardiociti allo stress e nella transizione verso
l’insufficienza.
Diminuzioni della massa cardiaca a livelli ben inferiori al normale si
verificano in condizioni di assenza di gravità, nell’allettamento
prolungato ed in altre condizioni di scarico ventricolare. In uno studio su
soggetti sani allettati per 12 settimane la massa del ventricolo sinistro
diminuiva del 15%; in un altro studio, che probabilmente ha raggiunto il
limite minimo di atrofia cardiaca, si è documentata una riduzione del
25% della massa in pazienti con lesioni spinali che non potevano
muoversi
Lo stress meccanico induce segnali paracrini e autocrini regolando la
sintesi e la secrezioni di potenti fattori di crescita, fra cui il fattore
insulino simile 1 (IGF 1), angiotensina II ed endotelina 1, sia in colture
cellulari, sia in pazienti con stenosi aortica. Lo stress meccanico stimola
direttamente i recettori per l’angiotensina II, senza che vi sia un
aumento della stessa.
Risposte cellulari alle alterazioni del
carico.
Una complessa sequenza di risposte
allo stress neuroumorale e biochimico
termina nella regolazione di geni
dell’ipertrofia e della crescita cellulare
Segnali extracellulari che scatenano risposte intracellulari nel miocardiocita. Questi segnali
attivano e sbloccano la trascrizione di geni che presiedono alla crescita cellulare e al
rimodellamento. Nonostante la complessità, vi sono dei nodi comuni, sulla superficie cellulare,
nel citoplasma e nel nucleo, che potrebbero essere oggetto di interventi terapeutici
L’ipertensione è il più importante fattore di rischio di insufficienza
cardiaca, a causa del ruolo fondamentale dell’accrescimento miocardico
ipertrofico nello sviluppo dell’insufficienza cardiaca. Lo schema
prevalente della malattia cardiaca ipertensiva vede prima l’ipertrofia
concentrica del ventricolo sinistro, seguita da dilatazione ventricolare e
insufficienza contrattile. Vi è una relazione fra l’aumento quantitativo
della massa cardiaca e il manifestarsi di situazioni cliniche negative.
Oltre alla massa, è importante il tipo di rimodellamento cardiaco: con il
rimodellamento concentrico compare una lieve disfunzione sistolica,
mentre il malfunzionamento è più rilevante nell’ipertrofia eccentrica.
L’ipertrofia dei miocardiociti è la risposta cellulare allo stress biomeccanico, sia esso intrinseco come nell’ipertensione e nei vizi valvolari,
o estrinseco come nella cardiomiopatia ipertrofica familiare. L’ipertrofia
cardiaca ha l’effetto di normalizzare l’aumento della tensione di parete
eliminando lo stimolo iniziale. Gli aspetti caratteristici sono un aumento
delle dimensioni dei miocardiociti, un aumento della sintesi proteica e
una migliore organizzazione dei sarcomeri. Queste modificazioni del
fenotipo cellulare sono precedute e accompagnate dalla reintroduzione
del cosiddetto programma genetico fetale.
L’ipertrofia in risposta a segnali patologici è di tipo adattativo per
mantenere la gettata cardiaca a fronte delle condizioni alterate, ma alla
lunga si associa ad un aumento significativo del rischio di morte
improvvisa e ad una progressione verso l’insufficienza cardiaca.
Il processo ipertrofico non è completamente benefico. Si solleva il
problema se l’ipertrofia da stress miocardico sia un bene oppure se sia
di tipo adattativo soltanto in principio ma porti alla perdita funzionale
del cuore nel lungo periodo. Altrettanto importante è la differenza fra
ipertrofia fisiologica, quella che accompagna lo sviluppo post natale e
quella indotta dall’esercizio, e l’ipertrofia patologica. Interventi per
favorire la prima ed inibire la seconda potrebbero avere un ovvio valore
terapeutico.
VIE MOLECOLARI DELL’IPERTROFIA MIOCARDICA
Il sistema calcineurina-NFAT. La calcineurina è una fosfatasi serinatreonina, espressa in numerosi tessuti e composta da una subunità
catalitica A e una regolatrice B. La calcineurina defosforila fattori di
trascrizione della famiglia dei NFAT (nuclear factor of activated T cells),
provocando la traslocazione del NFAT nei nuclei e l’attivazione dei geni
della risposta immunitaria. Sembra accertato che questa via stia alla
base anche dell’ipertrofia cardiaca. Il ruolo della calcineurina
nell’ipertrofia dovuta alle cause più comuni sembra accertato. Inoltre,
questa via si intreccia con altri importanti segnali che provocano
ipertrofia, come quelli controllati dalla glicogeno sintetasi e dal MAPK.
Il fatto che la calcineurina sia coinvolta in molti, se non tutti, i processi
ipertrofici patologici del cuore ne fa un ovvio bersaglio terapeutico, ma
non è chiaro se sia necessario un livello minimo di calcineurina per
evitare l’atrofia, dato che essa è implicata anche nell’ipertrofia
fisiologica da esercizio.
PI3K/Akt/GSK-3-Dependent Signaling. PI3Ks = fosfoinositide 3 chinasi. È
una famiglia di enzimi che attivano chinasi proteiche e lipidiche e sono
importanti nell’accrescimento, nella sopravvivenza e nella proliferazione
delle cellule.
Il PI3K regola la risposta ipertrofica dei miociti piuttosto che la loro
proliferazione. Non ha effetti negativi sulla contrattilità. Numerosi studi
basati su ratti transgenici che esprimono in eccesso o in difetto questi
enzimi. Uno dei bersagli principali di PI3K è la chinasi serina/treonina
Akt, che è attivata attraverso vari stadi di fosforilazione. L’ipertrofia
regolata da questi fattori è mediata da GSK-3 e dal “mammalian target
of rapamycine (mTor). La rapamicina è un immunosoppressore e quando
si lega a mTor blocca la sintesi proteica. Nell’insieme, risulta che GSK-3
integra i segnali di diverse vie ipertrofiche e dev’essere disattivata per la
comparsa dell’ipertrofia.
Controllo trascrizionale dell’ipertrofia cardiaca mediante MEF2/HDAC.
Molte molecole calcio dipendenti, comprese calcineurina, protein
chinasi calcio/calmodulina dipendente (CaMK), e MAPKs bastano per
produrre ipertrofia e riprogrammare l’espressione genica. Dato che vie
diverse evocano simili risposte molecolari, è probabile che le vie
ipertrofiche convergano su punti finali comuni. Un candidato probabile è
MEF2 (myocyte enhancer factor-2), che rimane a livelli basali di attività
trascrizionale nel miocardio adulto ma viene attivato su stimolazione.
L’attività MEF2 è controllata dall’associazione diretta con un’istone
deacetilasi (HDAC). Stimoli ipertrofici (sovraccarico di pressione) e
l’attivazione della calcineurina attivano HDAC, che regola MEF2. Si può
concludere che molti, se non tutti, gli stimoli ipertrofici convergono sul
nucleo e che le HDAC insieme a MEF2 e forse altri fattori di trascrizione
che interagiscono con MEF2, come GATA e NFAT, costituiscono gli
integratori di questi segnali.
Segnali ipertrofici via G Protein–Coupled Receptors (GPCRs) giocano un
ruolo importante nella regolazione della funzione cardiaca e negli
adattamenti ai carichi emodinamici. I più importanti GPCRs sono i
recettori adrenergici e muscarinici. Questi recettori a sette eliche si
accoppiano a tre classi principali di proteine eterotrimetriche che legano
GTP, che trasducono il segnale agonista o antagonista ad effettori
intracellulari (enzimi e canali ionici). Le subunità dei recettori GTP, una
volta attivate, si dissociano e attivano segnali intracellulari indipendenti.
I recettori di AngII, ET1, alfa-adrenergici si accoppiano all’unità Gq/11 (che
a sua volta attiva la fosfolipasi C) e sono tutti sufficienti a provocare
ipertrofia.
Il recettore adrenergico più abbondante nel cuore è il beta-1, accoppiato
a Gs, che attiva l’adenilciclasi, provocando i noti effetti sul cuore
(cronotropo, inotropo, lusitropo). La PKA (attivata dalla catena
precedente) media le conseguenze negative dell’aumento cronico della
stimolazione beta adrenergica, mentre l’adenilciclasi di per se può avere
altri effetti protettivi. È stato recentemente dimostrato che il trattamento con beta bloccanti nell’insufficienza cardiaca congestizia è
accompagnato anche da un salvataggio del fenotipo dei miocardiociti,
con sottoregolazione dei geni dell’ipertrofia e sovraregolazione di geni
che erano stati inibiti.
Piccole proteine G costituiscono un passaggio critico fra i recettori di
membrana e diverse vie di segnalazione. Vi sono molti membri, che
regolano diverse funzioni cellulari, fra cui la crescita, la divisione e la
sopravvivenza, l’organizzazione del citoscheletro, i traffici trans-membrana e la motilità cellulare. Hanno una massa molecolare simile (21
kDa) e si attivano legando il GTP che si idrolizza a GDP e viene
disattivato.
La via MAPK. È un legame importante fra gli stimoli esterni e il nucleo
mediante fosforilazione e regolazione di molteplici fattori di trascrizione.
Le MAPKs si dividono in 3 sottofamiglie principali: extracellularly
responsive kinases (ERKs), c-Jun N-terminal kinases (JNKs), e p38
MAPKs. Gli ultimi due gruppi sono anche chiamati MAPKs che
rispondono agli stress perché sono attivati non solo da stimoli anabolici
e dagli agonisti delle GPCRs, ma anche da stress patologici come
l’ischemia e gli agenti citotossici.
PKC e ipertrofia cardiaca: è una chinasi serina/treonina ubiquitaria
attivata da recettori accoppiati a proteine G. Varie isoforme sono
coinvolte nella patogenesi dell’ipertrofia. L’attività PKC dipende dalla
dislocazione spaziale e dall’associazione con proteine del citoscheletro
(RACK e AKAPs).
Gp130/STAT3 Signaling: è un recettore promiscuo per diverse citochine
fra cui interleukin 6/11, leukemia inhibitory factor (LIF), e cardiotrophin1 (CT-1). CT-1 induce ipertrofia in vitro; ANG II aumenta LIF, CT-1 e IL-6.
Metabolismo lipidico e ipertrofia cardiaca. La generazione di
combustibile nel cuore adulto si basa sull’ossidazione mitocondriale di
acidi grassi a catena lunga per produrre ATP. L’ipertrofia invece si associa
alla soppressione dell’ossidazione degli acidi grassi e alla deviazione
verso il metabolismo glucidico, che caratterizza il cuore fetale. Questa
deviazione si può interpretare come un adattamento perché diminuisce
il consumo di ossigeno per mole di ATP generata. Non è però chiaro
quali conseguenze metaboliche, come l’accumulo di acidi grassi nel
cuore, comporti la soppressione cronica del metabolismo lipidico
cardiaco.
I geni dell’ossidazione degli acidi grassi sono in primo luogo regolati da
una famiglia di fattori di trascrizione chiamata peroxisome proliferatoractivated receptors (PPARs). I meccanismi della modulazione dipendente
da PPAR dell’ipertrofia cardiaca non sono chiari; si indicano due
possibilità: a) le alterazioni del metabolismo lipidico nel cuore sono un
epifenomeno secondario alle cause della crescita del miocardio; b) le
anomalie del metabolismo lipidico precedono e in qualche modo
causano l’ipertrofia. La seconda ipotesi è sostenuta dall’osservazione
che molte alterazioni ereditarie dell’ossidazione degli acidi grassi si
accompagnano ad ipertrofia del ventricolo sinistro.
ALTRE VIA DELL’IPERTROFIA CARDIACA
Il segnale MMP/TNF. Le MMPs sono enzimi della matrice extracellulare e
aumentano nell’ipertrofia post infarto; l’aumento della loro attività
contribuisce alla dilatazione progressiva del cuore scompensato, mentre
l’inibizione farmacologica migliora l’ipertrofia sperimentale, compresa la
funzione contrattile.
CHAMP and Cardiomyocyte Hypertrophy. Si tratta di un’elicasi dell’RNA
specifica per il cuore, attivata da MEF2. Contribuisce all’ipertrofia.
Inibizione dello scambiatore Na+/H+ (NHE). La sua attività aumenta in
numerosi modelli di ipertrofia cardiaca e comporta un aumento della
concentrazione intracellulare del sodio e, di conseguenza, del calcio
perché rallenta lo scambiatorie Na+/Ca+. L’aumento del calcio
intracellulare stimola molte cascate che producono ipertrofia come
calcineurin-, CaMK-, PKC- and MAPK-dependent pathways. Quindi
l’inibizione di NHE può migliorare molte forme di ipertrofia.
CARDIAC HYPERTROPHY: COMPENSATORY
MALADAPTATION
Is Cardiac Hypertrophy Good, Bad, or Ugly?
RESPONSE
VERSUS
Si ritiene in genere che l’ipertrofia cardiaca possa essere adattativa in
alcune situazioni, in particolare negli atleti. È però meno chiaro se la
risposta ipertrofica a situazioni patologiche croniche, come l’ipertensione o l’infarto, inizi come risposta compensatoria (che diventa
maladattativa solo in seguito) o se questo tipo di accrescimento del
miocardio sia dannoso fin dall’inizio. In questo caso le vie molecolari alla
base dei due tipi di ipertrofia dovrebbero essere diverse e in effetti ci
sono differenze sia morfologiche sia a livello molecolare: l’ipertrofia da
esercizio non è accompagnata da accumulo di collagene nel miocardio e
in genere l’aumento dello spessore della parete ventricolare sinistra è di
grado modesto. Nel confronto fra ratti spontaneamente ipertesi e ratti
sottoposti ad esercizio, sono diversi alcuni geni ipertrofici come BNP e
ET-1 e l’espressione delle MHCs.
In conclusione, l’ipertrofia buona (esercizio) cattiva (patologica) e
pessima (scompensata) sono diverse a livello molecolare ma non
è escluso che alcune vie ipertrofiche partecipino a tutti i tipi di
ipertrofia.
INIBIZIONE DELL’IPERTROFIA. Sono stati descritti diversi fattori
genetici o esogeni che inibiscono l’ipertrofia: l’inizio e l’inibizione
dell’ipertrofia cardiaca coinvolgono segnali multipli formando una
specie di rete che si integra e modula una quantità di stimoli.
Alcuni modelli di topi transgenici attenuano la risposta ipertrofica
al sovraccarico di pressione mantenendo una funzione sistolica
normale, mentre modelli diversi sono ugualmente protetti
dall’ipertrofia ma hanno una funzione sistolica depressa e un
aumento della mortalità. Quindi la risposta ipertrofica può essere
dissociata dalla regolazione della contrattilità
Molti lavori sostengono che l’inibizione dell’ipertrofia cardiaca
patologica possa avere effetti benefici anche se lo stimolo originale
(aumento dello stress di parete) persiste, ma si tratta di osservazioni a
breve termine, mentre è probabile che alla lunga l’inibizione
dell’ipertrofia sfoci ugualmente nello scompenso.
Qualunque sia l’efficacia di un intervento antiipertrofico, esso deve
essere sostenuto nel tempo e non deve compromettere la contrattilità.
Bisognerà anche associare strategie complementari, modulando il ciclo
del calcio per sostenere la funzione contrattile e inibire le risposte
neuroumorali, al fine di trattare con successo e prevenire lo scompenso
cardiaco.
Antiremodeling Effect of Long-Term Exercise Training in Patients With Stable
Chronic Heart Failure
Results of the Exercise in Left Ventricular Dysfunction and Chronic Heart
Failure (ELVD-CHF) Trial
Pantaleo Giannuzzi, MD; Pier Luigi Temporelli, MD; Ugo Corrà, MD; Luigi Tavazzi, MD;
for the ELVD-CHF Study Group
(Circulation. 2003;108:554-559.)
I volumi telesistolico e telediastolico erano aumentati del 6% e del 7%
rispettivamente nel gruppo di controllo, mentre erano diminuiti del 5%
e del 9% nel gruppo allenato, nel quale anche la frazione di eiezione era
aumentata del 16%. Il tempo di esercizio aumentava nel gruppo allenato
di 2,1 min (29%), la capacità di lavoro di 18 W (24%) e il consumo
d’ossigeno alla soglia ventilatoria di 2 ml/kg/min (17%). Frequenza
cardiaca, pressione sistolica e il prodotto pressione frequenza non
cambiavano nei soggetti di controllo ma diminuivano significativamente
negli allenati.
L’esercizio moderato a lungo termine in pazienti CHF con disfunzione
diastolica grave ha un effetto antirimodellamento documentato da una
riduzione modesta ma significativa dei volumi del ventricolo sinistro e
da un miglioramento della frazione di eiezione.
Meccanismi: riduzione della frequenza e della pressione a riposo e a
parità di esercizio sottomassimale. Ridotta produzione di ROS nel
muscolo scheletrico. Aumento del flusso coronarico nel cuore sano e
intorno all’infarto; controllo dell’infiammazione
Molecular remodeling of cardiac contractile function
JEANNE JAMES AND JEFFREY ROBBINS
Am. J. Physiol. 273 (Heart Circ. Physiol. 42): H2105–H2118, 1997
Le proteine dell’apparato contrattile determinano e rispecchiano diverse
esigenze fisiologiche per ogni tipo di muscolo. Tutti i muscoli striati
hanno un insieme di proteine comuni che sono molto conservate, ma
diverse fibre si caratterizzano per particolari e spesso uniche isoforme
proteiche complementari. L’esempio più tipico è la catena pesante della
miosina (MHC), che appunto esiste in diverse isoforme, caratteristiche di
varie fibre muscolari. Esistono isoforme anche della catena leggera della
miosina (MLC), dell’actina, del complesso delle troponine, della proteina
C che lega la miosina, della titina, della nebulina e della tropomiosina.
Nel cuore di mammifero, le diverse isoforme delle proteine contrattili
possono essere espresse in risposta a stimoli esterni ed interni e si
ritiene che siano responsabili di diversi aspetti funzionali. Per esempio vi
sono due isoforme di actina alfa (scheletrica e cardiaca), prodotte da
geni simili in cromosomi diversi e presenti entrambe nel cuore. La forma
scheletrica è abbondante nel feto ma è sottoregolata nella vita adulta,
quando viene sopraregolata l’actina cardiaca. Una forma di topo
geneticamente modificato iperesprime l’actina scheletrica nel cuore da
adulto e ha un cuore ipercontrattile.
La più evidente correlazione fra le proprietà contrattili e le proteine
riguarda le MHC: ve ne sono tre isoforme cardiache (V1, V2, V3), in cui
cambia la velocità dell’ATPasi e della contrazione.
Sono stati studiati diversi tipi di topo transgenico per individuare la
correlazione fra caratteristiche funzionali e profilo isomiosinico.
Il resto dell’articolo riguarda le diverse tecniche dell’ingegneria genetica,
più che i risultati ottenuti. Si va dall’ablazione di geni specifici alla
trasfettazione di porzioni di DNA anche diversi (es Drosofila) e si
ottengono topi (tutte le ricerche di questo genere sono state effettuate
su topi, per ragioni pratiche anche se sarebbero teoricamente estensibili
ad altri animali) che esprimono in quantità aumentata le proteine di cui
si vogliono studiare gli effetti. I pezzetti di DNA sono caricati su virus con
i quali si infettano le cellule, che poi vengono iniettate su topi genitori, la
cui prole sarà portatrice della mutazione.
Particolarmente interessante la possibilità di produrre dei topi
transgenici nei quali la proteina da studiare viene attivata in un
momento voluto, per es tramite tetraciclina e può anche essere
disattivata.
Per molti anni i cardiologi hanno sostenuto la necessità del riposo
prolungato per i pazienti con malattia cardiaca ischemica. Negli ultimi
trent’anni, invece, c’è stata una vera rivoluzione e oggi esercizio leggero
o moderato è prescritto non solo per la prevenzione ma anche come
trattamento fondamentale della malattia.
In questa rassegna ci interessiamo del rimodellamento cellulare e
molecolare che ha luogo nel cuore in seguito ad allenamento di
endurance. Ci riferiamo in particolare alle crescenti dimostrazioni del
potenziale rigenerativo del cuore adulto, costituito da una riserva
endogena di cellule staminali o progenitrici cardiache.
L’accrescimento del cuore (ipertrofia) è in genere definito come
fisiologico (normale) o patologico (cattivo). L’ipertrofia cardiaca da esercizio è il prototipo dell’accrescimento fisiologico e si può grossolanamente distinguere in concentrico o eccentrico; la struttura cardiaca è
normale e la funzione è normale o migliorata. L’ipertrofia patologica
invece si associa alla perdita di miocardiociti (apoptosi e necrosi),
sostituzione fibrosa, disfunzione cardiaca e aumento del rischio di
insufficienza cardiaca e morte improvvisa.
La struttura miocardica è riformata dall’esercizio attraverso un aumento
bilanciato della massa miocardica, che comprende l’ipertrofia e la neo
angiogenesi (cuore d’atleta). Per esempio, 2 ore al giorno di esercizio su
treadmill ad alta intensità (85-90% VO2max) per 5 giorni alla settimana
per 8 settimane aumenta del 20-32% e del 17-23% la massa dei
miocardiociti. rispettivamente in topi maschi e femmine.
In genere, gli atleti di endurance (corridori, nuotatori) hanno un
aumento di spessore e una notevole dilatazione del ventricolo sinistro
(ipertrofia eccentrica), quelli di resistenza (pesisti, lottatori) un aumento
notevole dello spessore e una modesta dilatazione (ipertrofia
concentrica), mentre quelli “combinati”, che fanno allenamento di
resistenza e di endurance (ciclisti, canoisti, rematori) hanno la maggiore
ipertrofia.
Nonostante i comprovati effetti dell’allenamento nella riduzione del
rischio cardiovascolare, in seguito ad episodi di esercizio intenso è stato
documentato un aumento della troponina cardiaca, che indica danni
miocardici, anche in soggetti sani. Un allenamento di endurance
prolungato di alto livello può aumentare il rischio di aritmie e arresto
cardiaco.
Per molto tempo si è considerato il cuore un organo post mitotico, privo
di capacità rigenerativa, per cui i miocardiociti hanno la stessa età del
loro proprietario. Questo non vale per il cuore dei neonati e dei bambini
prepuberi: questi cuori giovani hanno una robusta capacità di crescere e
di rigenerarsi attraverso la moltiplicazione delle cellule, l’ipertrofia
cellulare e dei vasi. Si può raddoppiare la massa ventricolare nel
neonato in circa una settimana aumentando il postcarico.
Ancora più interessante è il fatto che infarti massivi in soggetti giovani,
come quelli che capitano quando una coronaria ha l’origine sbagliata
nell’arteria polmonare, dopo correzione chirurgica, rigenerano un
miocardio normale con segni minimi o assenti di cicatrice.
Negli ultimi dieci anni, fortunatamente, è sorta una nuova era della
biologia miocardica e si è fatto spazio il concetto di un cuore di
rimpiazzo nell’adulto. Il cuore adulto contiene una riserva di cellule
staminali e progenitrici cardiache endogene (eCSC). Queste cellule si
riconoscono in base ad uno specifico marcatore (c-kit) e si distinguono
da quelle di origine emopoietica (identificate da CD45); hanno le
proprietà delle cellule staminali (clonogeniche, auto rinnovanti e
multipotenti) sia in vitro sia in vivo. Nell’uomo queste cellule sono
attivate e indirizzate verso la linea miocardiocitica in risposta ad aumenti
del carico. Utilizzando carbonio radioattivo, un gruppo di ricerca ha
dimostrato che almeno metà dei miocardiociti si rigenerano nel corso
della vita.
Nel ratto, abbiamo riscontrato un aumento della proliferazione, del
numero e della differenziazione cardiogenica di eCSC con carichi
fisiologici come nuoto o corsa.
Cellule staminali cardiache endogene e formazione di nuovi miocardiociti. (A) cellule staminali cardiache isolate
da cuore di ratto adulto.
(B) un piccolo miocardiocita neoformato (verde, freccia; in rosso actina sarcomerica; nucleo
in blu). Aumento del numero di cellule staminali
cardaiche in animali allenati al nuoto
Allenamento di endurance provoca anche adattamenti del letto
coronarico, con aumento della distribuzione di ossigeno, dell’estrazione,
del flusso coronarico, del diametro e del numero delle arterie e
miglioramento della funzione endoteliale. I segnali che inducono questi
adattamenti sono l’ischemia, fattori di crescita (VEGF e FGF-2) e forze
fisiche ed emodinamiche. Inoltre, l’allenamento modifica il numero e le
caratteristiche di cellule progenitrici dell’endotelio di origine midollare
che contribuiscono alla neo vascolarizzazione. Infine, l’allenamento
prolungato migliora la contrattilità dei miocardiociti influendo sul ciclo
del calcio.
Si ritiene comunemente che stimoli e segnali che conducono alla
ipertrofia patologica siano specifici: c’è la riattivazione o sopraregolazione del programma genico di tipo fetale dei cardiomiociti, che
comprende aumento di ANP, BNP, actina scheletrica, MLC-1 atriale e bMHC e diminuzione di geni normalmente espressi nell’adulto, come aMHC e sarcoplasmic reticulum Ca2+ ATPase (SERCA2a).
Tutto questo non avviene in modelli di ipertrofia fisiologica, nella quale
agisce una complessa rete di fattori di attivazione, compresi GATA4,
GATA6, Csx/Nkx2.5, MEF2, c-jun, c-fos, c-myc, nuclear factor k B and
NFAT. La via IGF-1-fosfoinositide 3-chinasi (PI3K) è quella più accreditata
per la crescita fisiologica del cuore, mentre recettori accoppiati a
proteine G stanno alla base dell’ipertrofia patologica.
Con iniezioni intracoronariche di IGF-1 e HGF si è riusciti ad attivare le
eCSC e a rigenerare miociti e vasi in una zona infartuata nel maiale, la
cui morfologia cardiaca è particolarmente simile a quella dell’uomo. La
rigenerazione ha migliorato la sopravvivenza delle cellule, ha ridotto la
fibrosi e ha migliorato i parametri funzionali.
The name Akt stands for Ak strain transforming. The origins of the Akt
name date back to 1928, where J. Furth performed experimental studies
on mice that developed spontaneous thymic lymphomas. The serinethreonine protein kinase AKT1 is catalytically inactive in serum-starved
primary and immortalized fibroblasts. AKT1 and the related AKT2 are
activated by platelet-derived growth factor. The activation is rapid and
specific,
and
it
is
abrogated
by
mutations
in
the pleckstrin homology domain of AKT1. It was shown that the
activation occurs through phosphatidylinositol 3-kinase. In the
developing nervous system AKT is a critical mediator of growth factorinduced neuronal survival. Survival factors can suppress apoptosis in a
transcription-independent manner by activating the serine/threonine
kinase AKT1, which then phosphorylates and inactivates components of
the apoptotic machinery. Mice lacking Akt1 display a 25% reduction in
body mass, indicating that Akt1 is critical for transmitting growth
promoting signals, most likely via the igf-1 receptor. Mice lacking Akt1
are also resistant to cancer:
I miocardiociti sono le cellule principali del cuore e anche se sono solo il
20% della popolazione totale di cellule cardiache, costituiscono più del
90% della massa del cuore. Pertanto, la maggior parte delle
modificazioni indotte nel cuore dall’allenamento (aerobico) deriva da
adattamenti dei miocardiociti e questa plasticità del sistema è alla base
di effetti dipendenti dall’intensità (dell’esercizio).
I miocardiociti rispondono all’esercizio in molti modi, cioè regolando le
proprie dimensioni e la contrattilità e la risposta dipende dall’intensità:
maggiore intensità, maggiore adattamento.
La crescita adattativa delle cellule in risposta all’esercizio, chiamata
ipertrofia fisiologica, si esprime con un aumento proporzionale della
sezione e della lunghezza delle cellule, e porta ad un aumento del peso
e delle dimensioni dei ventricoli.
Con allenamento ad alta intensità (80-90% VO2max) abbiamo ottenuto
una risposta ipertrofica proporzionale, già dopo poche settimane di
esercizio, che raggiunge un limite dopo due mesi. Sono coinvolti fattori
sia trascrizionali sia traslazionali. Queste vie possono avere diversi
andamenti temporali e una diversa importanza biologica.
L’attivazione della via phosphoinositide-3-kinase (PI3K)/protein kinase B
(Akt)/mammalian target of rapamycin (mTOR) è cruciale per l’induzione
dell’ipertrofia fisiologica. Tutto questo aumenta la biogenesi e l’attività
dei ribosomi e porta ad un aumento di mRNA e di sintesi proteica. È
dimostrato che l’attivazione di questa via fa la differenza fra l’ipertrofia
fisiologica e quella patologica.
Allenamento aerobico di alta intensità (90% VO2max) per periodi
prolungati aumenta la contrattilità di miocardiociti scarichi, con un
aumento della frazione di accorciamento del 40-50% e della velocità di
contrazione/rilasciamento del 20-40%. La potenza aumenta fino al 60%.
L’effetto dipende dall’intensità dell’esercizio. Questi miglioramenti sono
indipendenti dall’ipertrofia perché la risposta contrattile dipende da
meccanismi subcellulari, come l’idrolisi dell’ATP e la formazione di ponti
laterali stimolata dal calcio. La curva tensione/lunghezza diventa più
ripida.
Dato che la gestione del calcio intracellulare controlla la contrazione,
non meraviglia che l’allenamento modifichi soprattutto questa funzione.
In effetti, il parallelismo fra le più rapide fasi di salita e di discesa del
transiente di calcio e le fasi della contrazione e del rilasciamento
suggerisce che vi sia un legame causale. Oltre ad accelerare il ciclo del
calcio, l’esercizio diminuisce la concentrazione intracellulare di calcio in
diastole, riducendo il rischio di aritmie e la pressione di riempimento. Gli
effetti smettono di aumentare dopo circa due mesi di allenamento (o
per saturazione o perché bisognerebbe aumentare l’intensità) e si
invertono in 2-4 settimane dopo che l’allenamento è terminato.
Molti studi dimostrano che l’allenamento aumenta l’mRNA e
l’espressione proteica di SERCA2, ma non di fosfolambano (PLB). Quindi
aumenta il rapporto SERCA2/PLB lasciando più attiva la pompa
sarcoplasmica del calcio. Aumenta anche lo stato di fosforilazione e
quindi l’attivazione cronica di CaMKII, che mantiene lo stato di
fosforilazione di PLB, che non inibisce più SERCA2. Quindi il calcio
sarcoplasmatico viene rimosso più rapidamente e questo spiega la
variazione delle cinetiche descritta prima.
RICHIAMO DELLA FISIOLOGIA:
SERCA2 - è la pompa che trasporta il calcio dal sarcoplasma al reticolo
sarcoplasmatico: responsabile della circolazione di calcio: cisterne
terminali > sarcoplasma > (troponina C) > tubuli longitudinali del reticolo
SP > cisterne terminali. La circolazione inizia quando vengono attivati i
recettori alla rianodina dalla corrente di calcio che attraversa la
membrana (canali calcio L) durante il potenziale d’azione e termina
quando la cellula si ripolarizza. I SERCA sono particolarmente importanti
per la velocità del rilasciamento (effetto lusitropo)
(fosfo)lambano (PLB) – è una proteina che blocca i SERCA quando è
defosforilata e li libera quando è fosforilata. Per esempio la stimolazione
del simpatico aumenta la fosforilazione del PLB
L’esercizio aumenta anche il ciclo
intracellulare del calcio, che attiva
CaMKII (Ca2+/calmodulin-dependent
kinase II), che contribuisce a mantenere l’attivazione della sintesi proteica
e dell’ipertrofia.
Molti passaggi dell’accoppiamento eccitazione-contrazione possono essere
influenzati dall’esercizio, sia in condizioni normali che patologiche.
Al contrario, non c’è una chiara spiegazione
dell’aumento della velocità di salita del calcio
sarcoplasmatico durante l’attivazione. È possibile che l’allenamento porti ad un prolungamento cronico del potenziale d’azione e quindi
dello stato di eccitamento, almeno in alcune
parti del cuore oppure che aumenti la sensibilità dei recettori alla rianodina alla corrente
di calcio attraverso i canali L, attivati dal
potenziale di azione. In ogni caso, più che la
quantità di calcio durante l’attivazione, cambia
la forma della curva della concentrazione, che
diventa più stretta. Si suppone che questo
indirizzi più efficacemente il calcio verso la
troponina, aumentando la sincronizzazione
dell’attivazione dei sarcomeri. E questa è una
spiegazione più credibile dell’aumento di
contrattilità. Vi è anche un miglior controllo del
pH intracellulare e una trasformazione verso
isoforme delle proteine contrattili più efficienti
Il modello animale più usato per studiare l’ipertrofia patologica è il ratto
post infarto. Viene chiusa permanentemente una coronaria e a questo
segue un infarto di dimensioni ripetibili, con conseguente perdita della
funzione di pompa, ipertrofia e dilatazione.
I miocardiociti del ratto infartuato hanno le caratteristiche opposte a
quelle dell’ipertrofia da esercizio. Minore velocità di accorciamento e
rilasciamento, minore forza contrattile, alterata gestione del calcio
intracellulare e aumento del calcio libero in diastole. Tutte queste
alterazioni sono suscettibili di miglioramento in seguito all’allenamento.
Innanzitutto, è invertita la disfunzione arteriosa grazie al ripristino della
produzione di NO da parte dell’endotelio, una modificazione facilitata da
alterazioni adattative dell’eNOS, attivato da Akt e da una riduzione delle
specie reattive dell’ossigeno, generate dalla NADPH ossidasi. Questo
avviene nelle arterie, ma riduce il carico sul cuore e ne migliora la
funzione. Ma ancora più importante è l’attenuazione della disfunzione
cardiaca intrinseca. Nell’insieme, questi effetti riducono l’ipertrofia
patologica. Giocano un effetto positivo tutti i meccanismi visti per
l’ipertrofia fisiologica, dall’aumento della contrattilità e della fase di
rilasciamento alla migliore gestione del calcio intracellulare. Infine,
l’esercizio corregge i diversi difetti metabolici del cuore dilatato
Sono stati escogitati diversi modelli
animali per simulare disfunzioni
miocardiche non dipendenti dal post
infarto. In particolare, un tipo di
diabete e la sindrome metabolica.
L’allenamento modula positivamente le funzioni contrattili intrinseche,
riconducendole a livelli quasi normali. Il principale meccanismo è una
normalizzazione del ciclo del calcio.
Tutti gli studi descritti indicano che la capacità di rispondere
all’allenamento è mantenuta anche durante lo sviluppo di miopatie
cardiache e insufficienza dovute all’infarto, al diabete o alla sindrome
metabolica e che i meccanismi coinvolti restano simili a quelli del cuore
normale. È importante notare che l’esercizio corregge i difetti di
inotropismo e lusitropismo direttamente nei miocardiociti e che questo
non dipende da fattori esterni alle cellule.
In realtà, le alterazioni geniche indotte da diversi tipi di malattia che
portano all’ipertrofia patologica sono molteplici e diverse da quelle che
stanno alla base della risposta fisiologica. Probabilmente è proprio per
questo che tale risposta è conservata anche in condizioni patologiche.
IMPLICAZIONI CLINICHE
Recentemente è stato dimostrato che programmi d’esercizio ad alta
intensità (90% VO2 max) possono essere adeguati per pazienti con
ipertrofia post infarto, malattia coronarica o aumentato rischio
cardiovascolare. Tutti questi programmi si basavano su una frequenza
cardiaca pari al 95% del massimo teorico e hanno ottenuto effetti molto
superiori a quelli di esercizi moderati, che aumentano la capacità
d’esercizio ma fanno poco sul cuore.
Cardiac remodeling and failure From molecules to man (Part II)
Paul W.M. Fedak T , Subodh Verma, Richard D. Weisel, Ren-Ke Li
Division of Cardiac Surgery, University of Toronto, Toronto General Hospital, 14EN-215, 200 Elizabeth Street, Toronto ON, Canada M5G 2C4
Cardiovascular Pathology 14 (2005) 49 – 60
La matrice extracellulare (ECM) della maggior parte dei tessuti consiste
di una complessa rete di collagene fibrillare, elastina, proteine
miofibrillari, proteoglicani e protene di adesione, come la laminina e la
fibronectina. L’ECM costituisce l’impalcatura fisica dell’organizzazione
tridimensionale delle cellule e determina le proprietà fisiche dei tessuti:
è un tessuto dinamico che modifica composizione e disposizione in
risposta a stimoli ambientali o a lesioni. I tessuti metabolicamente attivi,
compresi miocardio e vasi, ricambiano in continuazione il loro ECM.
L’ECM non si limita a fornire un supporto strutturale alle cellule, ma è un
microambiente dinamico che trasmette segnali alle cellule dallo spazio
interstiziale e pertanto contribuisce alla regolazione delle funzioni
cellulari. Quindi, l’interazione delle cellule con la matrice circostante
condiziona in vario modo il rimodellamento cardiovascolare, regolando
anche la differenziazione, la proliferazione, la crescita e la sopravvivenza
dei miocardiociti.
Se gli elementi della matrice sono insufficienti, l’abbattimento delle
interazioni ECM-cellule porta alla loro morte per apoptosi. Queste
osservazioni significano che la composizione, l’orientamento e
l’abbondanza degli elementi della matrice del cuore possono avere
un’influenza preponderante sulla struttura e la funzione del miocardio.
I fibroblasti sono le cellule principali del miocardio e hanno lo scopo di
sintetizzare e regolare la composizione dell’ECM. L’elevato numero di
fibroblasti nel cuore indica che l’ECM è regolato dinamicamente e
suggerisce che esso debba avere importanti effetti sulla funzione
cardiaca.
Il collagene fibrillare nel cuore è organizzato in strati che circondano
gruppi di miocardiociti e li collegano fra loro. Lo strato più esterno,
l’epimisio circonda tutti i gruppi di miocardiociti del cuore.
L’onnipresente perimisio descrive lo strato di tessuto connettivo che
circonda e collega gruppi di miocardiociti in una particolare direzione; si
può studiare in microscopia ottica o confocale. L’endomisio è la parte di
matrice più interna che avvolge le singole cellule cardiache di un
gruppo; si vede solo al microscopio elettronico. L’epimiso e il perimisio
sono costituiti soprattutto da connettivo fibrillare, mentre l’endomisio è
un complesso agglomerato di collagene ed elastina. È chiaro che il
contenuto totale e la disposizione di questi elementi della matrice,
soprattutto la rete di collagene fibrillare, controllano la forma e la
distensibilità dell’intero miocardio.
L’orientamento spaziale del perimisio si modifica a seconda delle
condizioni di carico del cuore, assumendo una struttura a spirale quando
è rilasciato e lineare quando è stirato passivamente. Le fibre del
perimisio si orientano secondo l’asse lungo dei gruppi di miociti che
avvolgono, ma forniscono anche estese ramificazioni e interconnessioni
che legano insieme i miocardiociti in tutto il miocardio, formando una
rete organizzata di fibrille connettive.
È evidente che le capacità contrattili del miocardio rappresentano un
importante esempio di ingegneria biologica, realizzato dalla sua
struttura tridimensionale che è largamente basata sul contenuto e
l’organizzazione della rete di fibrille collagene.
Rimodellamento del collagene in CHF.
Molte malattie cardiovascolari, compreso l’infarto miocardico,
l’ipertensione e l’insufficienza cardiaca, si associano ad alterazioni della
quantità, del tipo, della stabilità e dell’organizzazione del collagene
fibrillare. Oltre alle modificazioni cellulari, anche la ristrutturazione della
matrice extracellulare gioca un ruolo centrale nel rimodellamento del
cuore insufficiente e nella transizione finale verso lo scompenso.
La deposizione di nuovo collagene (aumento della quantità totale) è una
risposta classica al danno tessutale e serve come supporto strutturale e
rinforzo delle zone danneggiate e indebolite. Sotto questo punto di
vista, all’interno di una zona di intensa necrosi cellulare, l’aumento del
collagene rappresenta un meccanismo adattativo. Il collagene non
aumenta con un sovraccarico puro di volume.
Se la quantità di collagene è certamente importante, altrettanto lo sono
la sua composizione e qualità. Il cuore umano contiene soprattutto
collagene di tipi I e III: il primo ha la resistenza alla tensione dell’acciaio e
costituisce l’85% del totale. La sua presenza aumenta lo spessore del
perimisio e questo è in relazione con la capacità del collagene fibrillare
di sostenere lo stiramento e di coordinare la contrazione globale
dell’organo. Il collagene di tipo III è meno rigido e conferisce elasticità al
miocardio.
In tutti i tessuti e organi, compreso il cuore, le fibre collagene si
stabilizzano maturando, con la formazione di legami crociati biochimici:
il grado di interconnessione del collagene è probabilmente più
importante della quantità e del rapporto fra le diverse isoforme, per il
rimodellamento cardiaco.
Nel miocardio normale la maglia di collagene fibrillare è molto
confluente, ampia e distribuita omogeneamente. Ogni fibra del
perimisio è abbondante e relativamente spessa. È dimostrato che nel
cuore insufficiente la maglia collagene è alterata e degradata e le fibre
del perimisio sono di meno e più sottili.
Turnover del collagene
L’ECM del cuore ha una notevole plasticità: si stima che gli elementi
delle diverse componenti del collagene siano degradati e rimpiazzati al
ritmo dello 0,6% al giorno, con una semivita delle proteine compresa fra
80 e 120 giorni. Quindi, le componenti dell’ECM sono continuamente
sintetizzate e degradate, anche se lentamente, nel cuore normale
Le MMPs sono un’importante famiglia di enzimi endogeni dipendenti
dallo zinco che degradano l’ECM di quasi tutti i tessuti biologici: sono
coinvolte nel rimodellamento fisiologico dei tessuti nello sviluppo, la
morfogenesi, la riproduzione e l’infiammazione, così come nel
rimodellamento patologico. Se ne conoscono più di 20 specie, che
degradano la maggior parte delle proteine dell’ECM, ma ognuna ha una
speciale affinità per singole componenti della matrice ed agiscono in
maniera organizzata e coordinata durante il processo di rimodellamento.
Le MMPs sono classificate in 4 gruppi a seconda della loro specificità
primaria per le componenti della matrice, cioè: le collagenasi (MMP-1 e
MMP-13), le gelatinasi (MMP-2 eMMP-9), le stromolisine (MMP-3), e le
MMPs di membrana (MT1-MMP).
La maggior parte delle MMPs sono costitutive e la loro espressione è
altamente inducibile in risposta a diversi fattori quali lo stiramento
meccanico, i fattori di crescita, le citochine e altri peptidi bioattivi che si
trovano nel miocardio, in particolare nel processo dell’insufficienza
cardiaca. L’espressione delle MMPs è iniziata in risposta a segnali
ambientali e in effetti la maggior parte di esse si trovano nell’ECM in uno
stato latente di proenzimi (pro-MMP) e sono attivate rapidamente.
Pertanto, le MMPs rispondono a stimoli ambientali in maniera rapida e
sostenuta in modo da riorganizzare la struttura e il contenuto dell’ECM
nel tessuto che le contiene.
Si ritiene che nel miocardio sia i fibroblasti sia le mast cellule sintetizzino
e secernano quasi tutte le MMPs nello spazio extracellulare.
L’espressione e l’attività delle MMPs aumentano nell’insufficienza
cardiaca di diversa eziologia, perché il rimodellamento cardiaco da parte
di questi enzimi costituisce una risposta deliberata e comune al danno
tessutale.
Regolazione dell’attività delle MMPs
Svariati processi regolano l’equilibrio dell’attività delle MMPs: l’espressione e la secrezione delle MMPs nell’ECM, l’attivazione di MMPs latenti
e l’inibizione competitiva da parte di inibitori endogeni. Il risultato netto
di tutti questi processi determina l’attività enzimatica complessiva nel
compartimento extracellulare e il destino dell’ECM.
A livello dell’espressione genica delle MMPs e della secrezione nell’ECM,
si sa che le citochine e altri fattori di crescita aumentano nella
insufficienza cardiaca, e sono importanti induttori genetici. In particolare
le citochine proinfiammatorie, come il TNF-, sono coinvolte sia
nell’espressione delle MMPs, sia nella riduzione dei loro inibitori
specifici, e questo provoca un aumento generalizzato delle MMPs.
TIMPs: presentazione e concetti chiave
Un interessante sviluppo delle conoscenze sulle MMPs è stata la
scoperta di una famiglia di 4 inibitori endogeni delle MMPs, denominati
TIMPs, che rappresentano il sistema endogeno primario che controbilancia dinamicamente l’attività delle MMPs e sono probabilmente il
punto di regolazione primario nei mammiferi. Il miocardio umano è in
qualche modo unico, nel senso che esprime, quando è sano, tutte e
quattro le specie di TIMPs. Tutte insieme, le diverse TIMPs si legano
saldamente a quasi tutte le MMPs e le inattivano. Si considerano ora le
TIMPs proteine multifunzionali dotate di diversi effetti biologici e varie
modalità d’azione. Per esempio, le proteine TIMP sono coinvolte nella
crescita, proliferazione e apoptosi delle cellule, e talvolta i loro effetti
non dipendono dalle MMPs.
Il profilo dell’espressione delle TIMPs è alterato nel cuore insufficiente: è
stata descritta una riduzione della metà dell’espressione della TIMP-1 in
associazione con il degrado della matrice e con la disfunzione
miocardica in seguito a danno da ischemia-riperfusione. Il controllo del
rimodellamento dell’ECM dovrebbe fornirci l’anello mancante
nell’attuale insufficiente armamentario terapeutico nei CHF e una
migliore comprensione del ruolo delle proteine TIMP nel miocardio
normale e insufficiente dovrebbe indirizzare la messa a punto di
specifiche strategie anti rimodellamento.
Cardiac remodelling: concentric versus eccentric hypertrophy in strength and endurance
athletes
C. Mihl, W.R.M. Dassen, H. Kuipers
Netherlands Heart Journal, Volume 16, Number 4, April 2008
Ci siamo chiesti in che modo l’ipertrofia cardiaca indotta dall’esercizio
differisca da quella di origine patologica.
• il rimodellamento fisiologico è un’alterazione compensatoria sia delle
proporzioni sia della funzione del cuore: si verifica negli atleti;
• il rimodellamento patologico accompagna stati come l’infarto
miocardico (sovraccarico da pressione), infiammazioni miocardiche, la
miocardiopatia dilatativa o il sovraccarico da volume.
La distensione provocata dall’aumento del carico emodinamico inizia la
risposta ipertrofica del cuore. I miocardiociti si espandono sintetizzando
nuove proteine contrattili e assemblando nuovi sarcomeri in parallelo,
aumentando la forza contrattile della cellula. Questo tipo di rimodellamento è omogeneo. Quando il cuore è sottoposto ad un aumento
cronico delle richieste funzionali (come dopo un infarto) ha luogo un
diverso tipo di rimodellamento, che è per lo più irreversibile. Questo
tipo di rimodellamento, dovuto a sovraccarico cronico, si associa ad un
contributo sproporzionato e inomogeneo dei fibroblasti che aumentano
il collagene fibrillare nell’interstizio
Questo provoca la perdita di miocardiociti per apoptosi o necrosi e le
cellule morte sono sostituite da fibroblasti e collagene extracellulare. La
fibrosi aumenta la rigidità del cuore interferendo con il riempimento
diastolico. La perdita di miocardiociti è un fattore importante per
l’insufficienza cardiaca: l’apoptosi riduce la forza contrattile e assottiglia
le pareti, portando alla dilatazione miocardica.
Si distinguono due diverse forme del cuore d’atleta: un cuore allenato
alla forza e uno allenato alla resistenza. Aumenta il diametro del
ventricolo sinistro e lo spessore di parete
Nell’allenamento aerobico, il fattore dominante è il sovraccarico di
volume e quindi si sviluppa un’ipertrofia eccentrica.
L’aumento della pressione arteriosa nel sollevamento di pesi può
arrivare a 320/250 mmHg. Livelli così elevati di postcarico e pressione
ventricolare aumentano lo sforzo (stress) di parete e questo è il
principale stimolo per l’ipertrofia nel cuore sovraccaricato. Il cuore
risponde all’aumento dello sforzo di parete nel training di forza
aggiungendo nuovi sarcomeri in parallelo a quelli già esistenti. Aumenta
così lo spessore della parete e si ha l’ipertrofia concentrica.
Negli sport di endurance, come ciclismo, maratona e triatlon, prevale il
rimodellamento eccentrico, soprattutto nei ciclisti.
Gli effetti del lavoro isometrico dipendono da due fattori, cioè l’intensità
dell’esercizio e l’entità delle masse muscolari coinvolte. Negli atleti di
resistenza aumenta lo spessore di parete e anche un poco il volume
ventricolare, ma lo stress di parete rimane invariato.
Una meta analisi della funzione e della struttura cardiaca di ciclisti,
corridori e atleti di forza nonché soggetti di controllo non ha trovato
differenze per quanto riguarda la massa ventricolare degli atleti (ma nei
controlli era minore); il diametro ventricolare era diverso nei tre gruppi
rispetto ai controlli, mentre lo spessore relativo di parete era minore
negli atleti di endurance che in quelli di forza (0.39 mm vs. 0.44 mm).
CONCLUSIONI:
lo sviluppo di un cuore d’atleta di endurance oppure di resistenza non va
considerato obbligatorio. Atleti di forza, che avrebbero dovuto sviluppare un’ipertrofia concentrica pura, avevano il diametro ventricolare aumentato; atleti di resistenza, per i quali ci si aspettava un’ipertrofia
eccentrica pura avevano un pronunciato aumento dello spessore di
parete.
Physiological Society Symposium – The Athlete’s Heart
Exercise-induced cardiac hypertrophy: a substrate for sudden death in
athletes?
G. Hart
Experimental Physiology (2003) 88.5, 639–644
Negli studi sperimentali, l’indice più comunemente usato per stabilire la
presenza e la gravità dell’ipertrofia è il rapporto fra il peso del cuore e
quello corporeo. Indagini ecocardiografihe nell’uomo hanno dimostrato
che l’aumento dello spessore della parete del ventricolo sinistro è
normalmente distribuito in maniera concentrica attorno alla cavità della
camera, benché si possa riscontrare un’ipertrofia asimmetrica negli
atleti fino al 12% dei casi, con un aumento sproporzionato del setto.
Finora si considera che l’aumento del volume del cuore sia dovuto
essenzialmente ad ipertrofia, piuttosto che ad iperplasia. Ogni aumento
delle dimensioni dei miocardiociti implica un’alterazione delle caratteristiche elettriche delle cellule, a causa della maggiore superficie del
doppio strato dielettrico del sarcolemma.
Alterazioni funzionali del miocardiocita
In un’ipertrofia di media entità è stato descritto un aumento modesto,
oppure nullo, dell’ampiezza della contrazione, mentre nell’ipertrofia
importante, accompagnata o meno da insufficienza cardiaca, l’ampiezza
della contrazione è normalmente ridotta e la durata è aumentata. Sono
state descritte modificazioni a tutti i livelli nel processo di accoppiamento eccitazione-contrazione nell’ipertrofia. A livello del sarcolemma, la risposta più consistente è un prolungamento della durata del
potenziale d’azione (APD), che, all’opposto di quel che riguarda le
proprietà meccaniche, è comune a tutti i tipi di ipertrofia.
Il prolungamento dell’APD dipende da un’alterazione dell’equilibrio delle
correnti di membrana nella fase di plateau, con un aumento delle
correnti in ingresso o una riduzione di quelle in uscita, o più frequentemente con entrambi. La variazione più frequente nell’ipertrofia è
una riduzione della corrente transitoria verso l’esterno di potassio (Ito).
L’APD dei miociti ventricolari cambia nello spessore del ventricolo: è più
lunga nello strato sub-endocardico: nell’ipertrofia, la durata del potenziale d’azione non cambia, o addirittura diminuisce, nei miociti subendocardici, mentre aumenta negli strati intermedi e sub-epicardici.
Comunque, per la maggior parte dei miociti che compongono la massa
ventricolare, l’aumento dell’APD rimane la risposta principale
all’ipertrofia.
Meccanismi cellulari alla base delle aritmie nell’ipertrofia cardiaca
Il prolungamento dell’intervallo QT, sia esso dovuto ad una delle
sindromi congenite di QT lungo, o alla somministrazione di particolari
farmaci che bloccano le correnti ripolarizzanti, predispone ad un tipo di
tachicardia ventricolare detto «torsade de pointes» e alla morte
improvvisa. Oggi si sa che il prolungamento dell’APD e il blocco delle
correnti ripolarizzanti nell’ipertrofia cardiaca possono predisporre ad
aritmie e morte improvvisa, analogamente alla sindrome del QT lungo.
Elettrofisiologia cellulare in seguito ad allenamento
Un esercizio di resistenza regolare induce molte modificazioni adattative
nel sistema cardiovascolare, come l’espansione del volume plasmatico,
la bradicardia a riposo, l’aumento del tono vagale, la riduzione del tono
simpatico, l’inibizione dei riflessi barocettivi, l’aumento della gittata
sistolica e l’aumento della circolazione coronarica.
Molte delle risposte adattative positive del cuore degli atleti, che
aumentano la contrattilità e la potenza, hanno luogo a livello del
miocardiocita, anche se non mancano importanti contributi del sistema
nervoso autonomo e della circolazione periferica. L’allenamento di
resistenza porta ad un aumento della lunghezza e della capacitanza dei
miocardiociti; tuttavia le variazioni morfometriche dei miocardiociti su
un modello di ratto sottoposto ad esercizio volontario non sono risultate
uniformi: le dimensioni delle cellule epicardiche non cambiavano,
mentre quelle sub-endocardiche aumentavano di ampiezza e di volume,
suggerendo che le prime modificazioni elettriche dovute all’allenamento
abbiano luogo in questo strato.
TORSADE DE POINTES
Alterazioni elettrocardiografiche negli atleti
Le variazioni elettrocardiografiche che si riscontrano nei pazienti con
ipertrofia cardiaca da ogni causa consistono in un aumento di ampiezza
delle deflessioni ventricolari (che rappresentano il cosiddetto criterio del
voltaggio per diagnosticare l’ipertrofia ventricolare), alterazioni della
onda T, con inversione del segmento ST, e battiti extrasistolici
ventricolari premature più frequenti e complessi. L’intervallo QT, che
corrisponde alla durata della depolarizzazione ventricolare, è normale o
appena aumentato nel cuore ipertrofico. Questo richiede una
spiegazione, dato che a livello delle cellule il prolungamento dell’APD è
sempre marcato e ben documentato in tutte le forme di ipertrofia:
probabilmente dipende dalla distribuzione alterata della ripolarizzazione.
Nel cuore normale, l’APD è più lungo negli strati endocardici, mentre
invece nell’ipertrofia l’APD dura di più negli starti intermedi e superficiali
e quindi i miocardiociti che danno origine alla parte terminale dell’onda
T sono quelli endocardici nel cuore normale, ma cedono il passo a quelli
più superficiale nell’ipertrofia. In conseguenza di tutto ciò, l’ipertrofia
cardiaca può prolungare poco l’intervallo QT elettrocardiografico, anche
se rimane una «sindrome del QT lungo» a livello della maggior parte, ma
non di tutti, i miocardiociti.
Importanza clinica dell’ipertrofia cardiaca nell’allenamento
C’è una certa sovrapposizione fra l’ipertrofia dell’atleta e quella dovuta
ad ipertensione, sia rispetto all’entità, sia alla sua reversibilità e alle
variazione della geometria ventricolare. Un’ipertrofia moderata da
cause patologiche, come quella da esercizio, può associarsi ad una
funzione contrattile aumentata oppure normale, ma sostanzialmente le
caratteristiche elettriche del tessuto e delle cellule dell’ipertrofia da
esercizio sono simili a quelle dell’ipertrofia da altre cause. Nell’ipertrofia
da esercizio non siamo in grado di distinguere variazioni legate ad un
aumento delle funzioni normali da quelle associate a condizioni
patologiche che comportano la morte improvvisa. È pertanto opportuno
considerare l’ipertrofia da esercizio nello spettro delle risposte cellulari
al sovraccarico cardiaco da qualunque causa e valutare le possibili
conseguenze fisiopatologiche in questo quadro. I dati della ricerca di
Framingham e di altri studi hanno dimostrato chiaramente che la
mortalità per cause cardiache è aumentata dall’ipertrofia di qualunque
entità.
La morte improvvisa negli atleti è rara e i dati pubblicati indicano che la
maggior parte degli eventi è legata a malattie cardiache pre-esistenti,
gravi ma non diagnosticate e asintomatiche, che possono essere congenite o acquisite, per esempio patologia coronarica, alterazioni specifiche
del muscolo cardiaco (cardiomiopatia) e infiammazione del cuore (miocardite). Rimane però il fatto che nel 15% dei casi, soprattutto nei più
giovani, l’unica anomalia riscontrabile è l’ipertrofia. Le aritmie ventricolari frequenti e complesse che sono comuni negli atleti allenati si
spiegano sulla base di specifiche alterazioni soltanto in un terzo dei casi.
In conclusione, per la maggior parte degli atleti allenati le conseguenze
cardiache della loro attività hanno caratteristiche adattative, benigne e
probabilmente reversibili. Rimane il fatto che allenamenti atletici intensivi sono associati con un piccolo ma evidente aumento del rischio di
morte improvvisa, che può dipendere dalle alterazioni elettriche a livello
cellulare che accompagnano l’ipertrofia di grado medio o moderato.
The athlete’s heart
David Oakley Sheffield, UK
Heart 2001;86:722–726
Sull’argomento del cuore d’atleta, bisogna distinguere fra atleti d’élite,
maschi e femmine che fanno attività ricreazionale, non atleti che
desiderano mantenere una buona efficacia cardiovascolare e pazienti
atleti con malattie cardiache diagnosticate.
Un programma di allenamento regolare porta a cambiamenti favorevoli
nella performance del muscolo scheletrico e a due chiari effetti
cardiovascolari – cioè l’ingrandimento del cuore e una bassa frequenza a
riposo: queste sono le componenti di un quadro clinico caratteristico,
definito «cuore d’atleta».
I canoisti, i ciclisti e gli sciatori di fondo sono quelli che hanno il cuore più grande, ma il grado di
ipertrofia non correla con l’intensità dell’esercizio o con la performance degli atleti. Molti
campioni olimpici hanno dimensioni cardiache normali, quando studenti che fanno sport
possono avere un’ipertrofia pronunciata. Questa osservazione significa che la risposta cardiaca
all’allenamento non è dovuta solo allo sforzo emodinamico durante l’esercizio, mentre entrano
in gioco altri fattori, come stimoli ormonali e predisposizione genetica. È infatti sempre più
chiaro che la tendenza all’ipertrofia è in parte determinata geneticamente e che l’esercizio è un
fattore scatenante. Studi su gemelli identici confermano questa ipotesi.
Qualunque sia il meccanismo, è evidente che l’ipertrofia è una risposta diretta all’allenamento.
Atleti che si allenano periodicamente hanno variazioni stagionali del volume ventricolare. Dopo
disallenamento si assiste spesso alla regressione dell’ipertrofia, anche dopo molti anni di
allenamento. La dilatazione cardiaca e l’ipertrofia possono essere tali da assomigliare a stati
patologici, ma gli indici della funzione ventricolare, sia sistolica sia diastolica, sono
sostanzialmente normali. Non ci sono prove che soggetti sani possano allenarsi al punto da
indursi condizioni patologiche, come fibrosi e disallineamento delle fibre.
La bradicardia a riposo è caratteristica dell’atleta allenato: in casi eccezionali po’ scendere sotto
a 40 battiti al minuto. Se cuori denervati battono più lentamente dopo allenamento, la
bradicardia degli atleti è dovuta soprattutto ad aumento del tono vagale e ad una riduzione di
quello simpatico a riposo.
Gli atleti nell’insieme consultano frequentemente il medico lamentando
palpitazioni, capogiro, affaticamento, dolore toracico e dispnea
esagerata. La visita può mettere in luce alcuni segni inconsueti, che non
tranquillizzeranno il medico, ben consapevole dei casi clamorosi di
morte improvvisa durante le attività sportive, e il reperto di un ECG
apparentemente alterato aumenterà la preoccupazione. Se le dimensioni cardiache sono corrette per la superficie corporea e o per la massa
magra, diventa più difficile dimostrare l’ipertrofia concentrica negli atleti
di resistenza. Ci sono molti dati sull’entità di queste variazioni e su cosa
deve essere considerato compreso nei valori normali per un atleta.
Anche se le conclusioni sono svariate, un’utile meta analisi di Fagart sui
dati disponibili indica che uno spessore di parete superiore a 1.6 cm è
raro per un atleta sano e che per lo più è meno di 1,3 cm.
La bradicardia a riposo può predisporre ad un aumento di attività
ectopiche atriali o ventricolari e in alcuni casi alla fibrillazione atriale.
L’aumentare dell’età può modificare alcuni degli adattamenti di cui
abbiamo parlato. Molti atleti si tengono allenati fino alla mezza età e
partecipano a competizioni «master» e «veterani». Ci sono prove che
l’allenamento continuato migliora le funzioni diastoliche negli anziani,
ma in uno studio sono stati visti problemi al ventricolo sinistro in ciclisti
giapponesi veterani, anche se non fu possibile stabilire se fossero
dovuti all’allenamento o all’insorgere di altre patologie, per esempio alle
coronarie. È stato anche visto che la bradicardia è più pronunciata negli
anziani, in cui è anche ridotta la frequenza massima; tutto questo può
contribuire alla riduzione della performance.
Gli atleti possono riferire sintomi, che in genere hanno una spiegazione
benigna – giramenti di testa da disidratazione o da ipotensione postesercizio, dolore toracico da tracheite o dolore muscolo scheletrico (in
particolare negli sport di contatto e in allenamenti molto pesanti),
palpitazioni da contrazioni premature benigne e mancanza di fiato per
infezioni polmonari o broncospasmo da esercizio. Ciononostante è
spesso necessaria un’indagine approfondita per garantire al paziente e
al suo medico la sicurezza di cui hanno bisogno.
L’ovvia preoccupazione del medico consultato da un atleta è «sto
trascurando un problema cardiaco che potrebbe essere mortale?». In un
giovane atleta con ipertrofia o bradicardia eccessivi, la diagnosi
differenziale si pone con la cardiomiopatia dilatativa o con la sindrome
da seno patologico (sick sinus). Non c’è test che possa garantire la
differenza fra cuore d’atleta e miocardiopatia dilatativa, anche se
possono aiutare l’entità e la simmetria dell’ipertrofia all’ecocardiogramma, la risposta a tre mesi di riposo, il reperto di ipertrofia
non spiegata nei familiari, la risposta pressoria e metabolica all’esercizio
e altre caratteristiche ecocardiografiche, come i profili di riempimento
del ventricolo sinistro.
La morte di un giovane atleta ben preparato è estremamente rara, con
un’incidenza di 1:200.000, ma diverse indagini danno esiti molto variabili. Le morti sono più frequenti in giocatori dilettanti e di mezza età,
ma anche in questi gruppi il rischio è molto basso, e comunque minore
che nella popolazione sedentaria. I casi di morte sono però più frequentemente associati all’esercizio che a periodi di riposo. La morte può
essere non cardiaca – per esempio traumatica, da ipo o iper termia, da
disidratazione o da abuso di droghe. Rimane il fatto che la morte
improvvisa è comunque soprattutto cardiovascolare e un’autopsia ben
fatta in genere rivela una causa sottostante. Nei giovani, la cardiomiopatia dilatativa è la causa più frequente, ma alcuni sostengono che la
displasia aritmogena del ventricolo destro sia ancora più comune. Fra
altre cause vi sono l’origine anomala delle coronarie, la stenosi aortica,
la miocardite, la sindrome di Marfan, la sindrome di Wolff-ParkinsonWhite, la sindrome del QT lungo, il prolasso della mitrale e malattie
coronariche.
Non vi è uno sport che abbia il monopolo delle morti improvvise, anche
se lo squash è stato indicato come particolarmente a rischio, forse a
causa della sua natura molto vigorosa e competitiva. Sta crescendo
l’interesse per gli sport estremi (per esempio triatlon, corse di 24 ore,
fell running): lo stato di esaurimento fisico completo di alcuni
partecipanti comporta alterazioni metaboliche che influenzano
negativamente la performance cardiaca.
Il fatto che all’autopsia di atleti morti improvvisamente si riscontrino
frequentemente alterazioni patologiche indica che avrebbe potuto
essere compiuta una diagnosi precedente delle loro condizioni nel corso
di screening di routine, e che un trattamento appropriato e giusti
consigli avrebbero potuto evitare la morte. In alcune nazioni, come
l’Italia, lo screening è obbligatorio ed è dimostrato che il programma è
efficace.
C’è però chi critica questa pratica sostenendo che si cercano malformazioni rare, per le quali mancano trattamenti risolutivi e gli esami non
sono perfetti. Anche se si istituisce un programma di screening, non ci
sono linee guida riconosciute su come debba essere organizzato e con
quali esami. Gli esami che abbiamo a disposizione non sono abbastanza
sensibili e specifici, mentre la probabilità che ci siano alterazioni cardiache è molto bassa: questo comporta inevitabilmente diagnosi mancate
e, ancor peggio, numerosi falsi positivi. La diagnosi errata di un problema cardiaco in un atleta normale è disastrosa per una persona per la
quale lo stato di salute è, per definizione, della massima importanza.
Una volta sollevato il dubbio di un problema cardiaco, è molto difficile
superarlo. Mentre la disputa sui vantaggi dello screening continua, è
evidente che ogni sintomo o segno sospetto in un atleta richiede le
indagini più approfondite.