LA VITA (METABOLISMO) RICHIEDE ENERGIA
- Fonte di energia ?
TUTTE LE ATTIVITA’ CELLULARI
CRESCITA , MOVIMENTO, SINTESI DI MACROMOLECOLE
COMPLESSE, TRASPORTO SELETTIVO DI SOSTANZE VERSO
L’INTERNO O VERSO L’ESTERNO E
DA UN COMPARTIMENTO AD UN ALTRO
RICHIEDONO ENERGIA,
OGNI CELLULA DEVE OTTENERE ENERGIA DAL SUO AMBIENTE E
CONSUMARLA NEL MODO PIU’ EFFICIENTE POSSIBILE.
LA MAGGIOR PARTE DELLA STRUTTURA MOLECOLARE DELLA
CELLULA E’ DEPUTATA A QUESTO COMPITO.
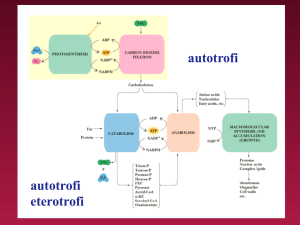
CLASSIFICAZIONE DEGLI ORGANISMI
1. Autotrofi - si nutrono da soli
ottengono il carbonio dalla CO2
fonte di energia
fotosintetica: uso dell’energia della luce Es.: piante e qualche
batterio
chemiosintetica: energia da reazioni chimiche utilizzando composti
inorganici. Es. batteri solforici
2. Eterotrofi - utilizzano altri organismi come fonte di energia.
si nutrono di autotrofi, di altri eterotrofi, e composti inorganici
acquistano carbonio ed energia dagli autotrofi
es: animali, batteri, funghi
CARBONIO E ENERGIA ENTRANO NEL CICLO DELLA VITA PER
FOTOSINTESI (AUTOTROFI) E VENGONO RILASCIATI PER GLICOLISI
E RESPIRAZIONE CELLULARE (ETEROTROFI)
LA BIOENERGETICA CONSISTE NELL’ANALISI QUANTITATIVA DELLE
MODALITA’ CON CUI GLI ORGANISMI OTTENGONO ED UTILIZZANO
L’ENERGIA. ESSA E’ UN RAMO PARTICOLARE DELLA SCIENZA GENERALE
DELLE TRASFORMAZIONI ENERGETICHE, LA TERMODINAMICA.
LA TERMODINAMICA CHIMICA SI OCCUPA DEGLI SCAMBI
ENERGETICI CHE ACCOMPAGNANO LE REAZIONI CHIMICHE.
Reazioni chimiche
Reagenti
1.
prodotti
2. Reazioni procedono fino all’ equilibrio (dinamico)
3. La maggior parte delle reazioni è reversibile a meno che siano regolate dalle
cellule.
Terminologia metabolica
1.
2.
3.
4.
5.
6.
Substrati: sostanze che entrano nelle reazioni
Intermedi : composti diversi dai reagenti che verranno convertiti in prodotti
Enzimi: catalizzatori delle reazioni
Cofattori e coenzimi: contribuiscono alle reazioni metaboliche
Trasportatori energetici. Es ATP
Prodotti finali : risultati delle reazioni.
METABOLISMO
La somma dei cambiamenti chimici che
converte i nutrienti in energia e in prodotti
chimici complessi delle cellule.
Centinaia di reazioni enzimatiche
organizzate in vie discrete.
I substrati vengono trasformati in
prodotti tramite specifici intermedi.
L’ENERGIA
E’ LA CAPACITA’ DI UN
SISTEMA di COMPIERE LAVORO
energia
energia
energia
energia
energia
etc.
potenziale
cinetica
termica
chimica
radiante
Il contenuto energetico globale di un sistema è dato dalla
somma di tutti questi contributi e viene generalmente indicato
con la lettera E
Lavoro: Forza x Spostamento
Salire le scale; sollevare un peso, respirare……
Energia potenziale
Energia immagazzinata
Esempi pratici
acqua in una diga (meccanica)
molla schiacciata (meccanica)
legami chimici nella benzina o carbone (chimica)
cibo (chimica)
Energia del movimento
Esempi pratici
peso in caduta
l’acqua che esce dalla diga
bruciare della benzina
Energia cinetica
IL LAVORO:
L = FORZA (F) × SPOSTAMENTO (s)
Espansione di un sistema contro una pressione esterna
(espansione dei polmoni)
Lavoro elettrico
Espansione di una superficie contro una tensione superficiale
La flessione del flagello che sospinge un protozoo o uno spermatozoo
Il sollevamento di un peso per mezzo della contrazione di un muscolo
(pompaggio di ioni attraverso una membrana)
QUINDI SI ESERCITA UNA FORZA CONTRO
UNA RESISTENZA PER PRODURRE UNO SPOSTAMENTO
Lavoro (meccanico)
Quando una forza applicata ad un oggetto sposta
il suo punto di applicazione compie un lavoro.
Esempio: se spostiamo un peso trascinandolo sul pavimento,
la forza da noi applicata sposta il suo punto di applicazione
e compie un lavoro.
ENERGETICA BIOCHIMICA
Si occupa dell’energia chimica,
cioè l’energia potenziale
immagazzinata nei legami delle molecole dei nutrienti
Termodinamica
Scienza che studia proprietà macroscopiche della
materia e le correla con stati microscopici della stessa.
Lo scopo della termodinamica è quello di prevedere quali
processi chimico-fisici siano possibili, in quali condizioni e di
calcolare quantitativamente le proprietà dello stato
d’equilibrio risultante del processo.
La termodinamica ha una validità generale.
Limiti: Previsione delle proprietà di una sostanza senza
però spiegare il perché. Previsione se un processo possa
avvenire senza darne una scala temporale.
LA TERMODINAMICA OBBEDISCE A
TRE LEGGI DI VALIDITÀ GENERALE:
I TRE PRINCIPI DELLA TERMODINAMICA
Gli esseri viventi possono essere interpretati
come forme di materia
che, nel corso della evoluzione, da molecole a coacervi di molecole
dotati di particolari proprietà,
quindi a cellule e ad organismi via via sempre più complessi,
hanno avuto modo di organizzarsi e di perfezionarsi
per fronteggiare, in particolare,
IL PRIMO ED IL SECONDO PRINCIPIO della termodinamica.
TERMINOLOGIA
Sistema: porzione dell’universo analizzata durante un esperimento.
Ambiente: parte dell’universo restante che può scambiare energia con
il sistema in esame.
Sistema + Ambiente = Universo termodinamico
Sistema chiuso:
può scambiare con l’ambiente esterno energia ma non materia.
confini fisici che impediscono il passaggio della materia dall’esterno
all’interno del sistema e viceversa (gas in una bombola)
Sistema aperto:
può scambiare con l’ambiente esterno sia materia che energia.
confini solo concettuali. Continuo passaggio di materia dall’esterno
all’interno del sistema e viceversa (gas al centro di una stanza).
Sistema isolato (adiabatico) :
non può scambiare né materia né energia. E= costante (Universo)
Gli esseri viventi sono sistemi APERTI
Per descrivere lo stato di un sistema termodinamico:
dare un valore minimo di parametri (variabili di stato)
Pressione
Temperatura
Densità
Volume
Energia interna
Massa
Grandezze intensive
(non dipendono dalla quantità di materia in osservazione)
Grandezze estensive
(dipendono dalla quantità di materia)
Una funzione di stato dipende solo dallo stato del sistema e non da “come”,
ossia dal cammino (reversibile o irreversibile) con cui questo viene raggiunto.
STATO TERMODINAMICO:
STATO DEL SISTEMA CHE CORRISPONDE AD UN PARTICOLARE
GRUPPO DI VALORI DELLE VARIABILI DI STATO.
Spontanei
Processi (chimici o fisici) di
trasformazione della materia
Non spontanei
Processo termodinamico: Passaggio da uno stato
termodinamico del sistema ad un altro. Questo processo può
essere fisico (variazione di temperatura, di pressione o di
volume) o chimico.
Processo reversibile: Processo che si realizza attraverso una
serie continua di stati termodinamici. I reagenti si
trasformano in prodotti, ma avviene anche il viceversa.
Processo irreversibile: Processo in cui il passaggio da uno
stato termodinamico all’altro non è rappresentabile come
serie continua di stati termodinamici.
Le proprietà del sistema tendono a modificarsi
nel tempo in modo tale che il sistema raggiunga:
LO STATO DI EQUILIBRIO.
LA
TERMODINAMICA
STUDIA
LE
TRASFORMAZIONI E LE RIDISTRIBUZIONI
DELL’ENERGIA CHE DEVONO VERIFICARSI IN
UN SISTEMA AFFINCHE’ LO STATO DI
EQUILIBRIO VENGA RAGGIUNTO
L'EQUILIBRIO
Una reazione chimica non converte sempre completamente i reagenti nei
prodotti.
In realtà in moltissimi casi la conversione dei reagenti nei prodotti e'
incompleta.
L'incompletezza di moltissime reazioni chimiche si spiega con la loro
reversibilità.
Keq
[C][D]
A + B C + D
Keq =
[A][B]
IL PUNTO IN CUI LA VELOCITA' DELLA REAZIONE DIRETTA
UGUAGLIA QUELLA DELLA REAZIONE INVERSA:
le concentrazioni di reagenti e prodotti restano invariate nel tempo e
il sistema raggiunge uno stato di equilibrio
La quantità di reagenti consumata nell'unità di tempo dalla reazione
diretta e' uguale a quella prodotta dalla reazione inversa.
Analoga considerazione vale per il prodotto.
Primo Principio della Termodinamica
Nell'Universo, l'energia non può essere né
creata, né distrutta.
Tutte le forme di energia sono interconvertibili.
Questo risponde alla legge della conservazione
dell’energia:
Euniverso = costante
L’energia interna di un sistema e’ una funzione di stato
LA VARIAZIONE DI ENERGIA INTERNA :
ΔE = Ef – Ei
Ef : energia nello stato finale
Ei: energia nello stato iniziale
Secondo il primo principio della termodinamica
ΔE sistema + ΔE ambiente = 0
In un sistema isolato come l’universo l’energia che è stata guadagnata
da una certa porzione del sistema deve essere pari a quella perduta da
un’altra porzione del sistema stesso.
La somma algebrica delle variazioni di energia interna deve essere
zero.
IL CALORE:
Energia scambiata fra due sistemi a diversa temperatura.
Se un sistema viene posto a contatto termico con un altro sistema a
temperatura diversa, allora si ha un trasferimento di energia sotto forma
di calore dal sistema a temperatura più elevata a quello a temperatura
minore, fino a che i due sistemi raggiungono la medesima temperatura, cioè
l'equilibrio termico.
Il calore e' una forma di energia e quindi si misura in joule (J), ma non è
una variabile di stato. Tuttavia, un'unita' di misura molto usata e‘ la
caloria, cal, definita come la quantità di calore necessaria per innalzare di
un 1°C la temperatura di 1 gr di acqua da 14.5 °C a 15.5°C:
1 cal = 4.184 J
La caloria o più precisamente la Kilocaloria (1 Kcal = 1000 cal)
viene anche comunemente usata per indicare
il contenuto energetico dei cibi.
Il calore scambiato da un sistema dipende dalla sua CAPACITA' TERMICA
CAPACITA' TERMICA
Calore necessario per innalzare di un grado
(Celsius o Kelvin) la temperatura di un corpo.
• La Capacita’ Termica e’ una proprietà di ogni sostanza
• La conoscenza dei valori di capacità termica di vari materiali, ha
grandi applicazioni pratiche e tecnologiche.
• La Capacità Termica dipende dal processo
• La Capacità Termica dipende dalla quantità di sostanza
• Grande C, piccolo aumento di T per tanto calore scambiato
CALORE SPECIFICO
Calore necessario per innalzare di un grado
(Celsius o Kelvin) l’unità di massa di una sostanza.
LA VARIAZIONE DI ENTALPIA DIVENTA
UNA MISURA DIRETTA
DELLA VARIAZIONE DI ENERGIA INTERNA
A PRESSIONE COSTANTE.
In genere le variazioni di energia che si trovano nei libri ,ad esempio
l’energia ottenibile dall’ossidazione di un molecola biologica,
sono date come valori di H, infatti in vivo le varie reazioni avvengono
in condizione di pressione pressocché costanti.
• Se H < 0 reazione esotermica
(energia termica viene rilasciata dal sistema che perde parte
della sua energia, trasformata in calore)
• Se H >0 reazione endotermica
(il sistema assorbe calore: la sua energia interna aumenta)
Miscelazione graduale di una soluzione ad es. di saccarosio e acqua pura
Acqua pura
aggiunta
(a)
(b)
STATO INIZIALE
ALTA ENTROPIA
( distribuzione casuale
delle molecole di
saccarosio)
AGGIUNTA DI UNO
STRATO DI ACQUA PURA
STATO DI BASSA
ENTROPIA
(le molecole occupano solo
metà soluzione, assetto più
ordinato)
(c)
STATO FINALE
ALTA ENTROPIA
( distribuzionee casuale
per tutta la soluzione)
I SISTEMI MOLECOLARI TENDONO
NATURALMENTE AL DISORDINE.
Il grado di disordine di un sistema è misurato da una funzione di
stato denominata ENTROPIA (S)
SECONDO PRINCIPIO DELLA TERMODINAMICA
L’ENTROPIA DI UN SISTEMA ISOLATO TENDE
AD AUMENTARE FINO AD UN VALORE MASSIMO.
Nell’esempio precedente la spinta verso il nuovo equilibrio è conseguenza della tendenza
dell’entropia ad aumentare.
Un sistema non passa mai dallo stato (c) allo stato (b) spontaneamente.
Il saccarosio non si concentrerà mai in un angolo della soluzione:
E’ CONCETTO COMUNE CHE GLI OGGETTI NON SI RIORDINANO MAI
SPONTANEAMENTE!!
UN ESEMPIO: Passaggio Di Stato
SE CONSIDERIAMO QUALSIASI SOSTANZA, LE UNITÀ COSTITUENTI SONO PIÙ
ORDINATE NELLO STATO SOLIDO CHE IN QUELLO LIQUIDO E PIÙ ORDINATE
NELLO STATO LIQUIDO CHE IN QUELLO GASSOSO.
PER QUALSIASI SOSTANZA L’ENTROPIA AUMENTA PROGRESSIVAMENTE SECONDO
LA SEQUENZA:
S
solido <
S
liquido <
S
gas
La fusione di un solido, l’evaporazione di un liquido la dissoluzione di un soluto (passaggi di stato), il
riscaldamento(aumento dei moti traslazionali, vibrazionali, rotazionali delle molecole) sono tutti processi
che aumentano l’entropia di un sistema, che passa da uno stato ordinato ad uno meno ordinato.
La variazione di Entropia di un sistema è ΔS :
ΔS > 0 (S finale > S iniziale )
o meglio ΔS universo = ΔS sist +ΔS amb > 0
il sistema evolve verso uno stato di disordine .
Il processo è:
spontaneo, ossia favorito (ma ciò non significa rapido)
irreversibile, perché tende verso l’equilibrio, da cui è lontano
al contrario un processo reversibile avviene sempre in prossimità di uno stato di
equilibrio.
ΔS universo = ΔS sist +ΔS amb = 0
ΔS < 0 ( S finale < S iniziale )
ΔS universo = ΔS sist +ΔS amb < 0
Il sistema evolve verso uno stato più ordinato:
• meno probabile
• non spontaneo. (il processo è spontaneo nella direzione opposta)
SAPERE SE UN PROCESSO E’ REVERSIBILE, FAVORITO O SFAVORITO E’ DI
VITALE IMPORTANZA PER LA BIOENERGETICA ED E’ PERMESSO DAL SECONDO
PRINCIPIO.
MOLTO IMPORTANTE È
LA RELAZIONE TRA
ENTALPIA ED ENTROPIA
Infatti il secondo principio così formulato non è utile a
biologi e biochimici, poiché essi hanno a che fare con
sistemi aperti (cellule organismi popolazioni), in grado di
scambiare energia con l’ambiente.
Sia le variazioni di energia che di entropia sono importanti
in molte reazioni nel determinare la direzione dei processi
termodinamici.
UNA FUNZIONE DI STATO
CHE COMPRENDE
SIA L’ENTROPIA CHE L’ENTALPIA E’ :
L’ENERGIA LIBERA DI GIBBS (G)
L’ESPRESSIONE
(H -TS) = G
espressa in joule/mole
ovvero l’energia libera, la cui variazione
G = H - TS
Questa funzione di stato tiene conto sia del termine entalpico che
misura la variazione di energia a pressione costante, che del termine
entropico, che valuta il grado di disordine.
Abbiamo detto in precedenza che :
un aumento di entropia (S positivo)
una diminuzione di energia/entalpia (S negativo)
sono tipici delle trasformazioni favorite/spontanee
ENTRAMBE QUESTE CONDIZIONI TENDERANNO A RENDERE IL
G NEGATIVO
REAZIONI ESOERGONICHE :
(G<0)
ACCOMPAGNATE DA VARIAZIONI NEGATIVE DELL’ENERGIA LIBERA
(la reazione procede rilasciando energia libera nell’ambiente.
Il contenuto energetico dei prodotti è minore di quello dei reagenti.)
REAZIONI ENDOERGONICHE:
(G>0)
ACCOMPAGNATE DA VARIAZIONI POSITIVE DELL’ENERGIA LIBERA
(esse procedono facendo guadagnare energia libera al sistema,
prelevandola dall’ambiente)
Ma se nell’equazione G
= H - TS, H e S si equivalgono, il G=0,
La trasformazione non è favorita nè in un senso nè nell’altro,
IL SISTEMA E’ IN EQUILIBRIO,
La reazione è reversibile, cioè può essere spostata in qualsiasi direzione da
una spinta infinitesimale in un senso o nell’altro.
Le regole dell’energia libera :
SE IL G È…
IL PROCESSO È…
REAGENTI
PRODOTTI
Negativo
Termodinamicamente favorito
Zero
Reversibile; all’equilibrio
Positivo
Termodinamicamente
sfavorito;
(il processo inverso è favorito)
Secondo G = H - TS
l’ entropia può diminuire in una trasformazione favorita,
ma solo se contemporaneamente si ha un’elevata
diminuzione di energia nel sistema.
ALLA VITA OCCORRE UNA NOTEVOLE SPESA ENERGETICA PER
PAGARE IL PREZZO DELLA SUA ORGANIZZAZIONE.
Perché le trasformazioni vitali procedano occorre una variazione complessiva
di energia libera negativa.
La vita è un processo irreversibile
Un organismo che arriva all’equilibrio (G=0) è morto.
D’altro canto mentre gli organismi viventi consumano la propria energia
cedono calore aumentando il moto casuale delle molecole intorno ad
essi e concorrendo all’ aumento di entropia del sistema chiuso di cui
fanno parte, l’universo.
L’APPLICAZIONE PRATICA
la possibilità di prevedere la direzione favorita di un
processo in condizioni definite.
Un processo importante a cui si applica questa
relazione
è per es. la diffusione attraverso le
membrane.
Le concentrazioni
eguagliarsi.
ai
due
lati
tendono
ad
La termodinamica può giustificare questo fenomeno.
LA STRUTTURA DI UN SISTEMA CHE STA REAGENDO, TENDERÀ A
MODIFICARSI IN CONTINUAZIONE, SINO AL RAGGIUNGIMENTO DI
UNO STATO DI EQUILIBRIO.
Immaginiamo di avere una reazione:
REAGENTI
A+B
PRODOTTI
C+D
Se le concentrazioni di reagenti e di prodotti sono IN EQUILIBRIO:
- non si potranno apprezzare ulteriori variazioni nel sistema
- questo punto determina la COSTANTE DI EQUILIBRIO
Se un sistema NON È ALL’EQUILIBRIO:
- sarà la tendenza a spostarsi verso l’equilibrio a divenire la forza trainante, la
cui ampiezza è pari alla variazione di energia libera (∆G) della reazione.
STATO STANDARD IN BIOCHIMICA
In biochimica lo stato standard si riferisce a pH 7
dove H+ non si trova a concentrazione 1M e si indica
con G°’
All’equilibrio chimico aA + bB cC + dD
G= 0
In tal caso il rapporto tra le concentrazioni è k , costante di equilibrio,
[ C ]c [ D ]d
in quanto le concentrazioni sono all’equilibrio.
Keq =
G°’= -RT ln K’eq
Se K’eq > 1 G° < 0
[ A ]a [ B ]b
Se K’eq < 1 G° > 0
Il valore di G ° ci dà un’idea del valore della costante di equilibrio.
SERIE DI REAZIONI: Per reazioni consecutive in
serie i valori di G sono additivi
Nell’ipotesi di REAZIONI SEQUENZIALI :
( A <=> B e B <=> C)
ogni reazione ha una propria costante di equilibrio ed ognuna ha una sua
variazione di energia libera.
Essendo le due reazioni sequenziali, B può essere eliminato, e la reazione
diviene
A <=> C,
con propria costante di equilibrio e variazione di energia libera standard, data
dalla somma algebrica delle singole variazioni di energia libera standard.
Tale principio della bioenergetica chiarisce come sia possibile che, una reazione
termodinamicamente sfavorita, possa essere guidata mediante una reazione
altamente esoergonica per mezzo di un intermediario comune.
Ne è un classico esempio la sintesi del glucosio-6-fosfato, ovvero la prima tappa
nella via di utilizzo del glucosio in molteplici organismi.
Reazioni favorevoli e sfavorevoli
Reazioni sfavorevoli
Alcune reazioni necessarie al metabolismo hanno un ΔG positivo
Reazioni favorevoli
Idrolisi di ATP (Adenosina trifosfato) ovvero la moneta
energetica della cellula
conformazione di proteine attivate
gradienti ionici attraverso le membrane
Ogni via metabolica deve essere termodinamicamente favorevole.
Ma le singole reazioni possono essere sfavorevoli ed avere G positivi.
Molte reazioni possono procedere perchè I loro prodotti sono continuamente
rimossi, utilizzati e le reazioni tenute lontane dall’equilibrio vanno avanti.
In molti casi ciò non basta.
TALI REAZIONI INTRINSECAMENTE
SFAVORITE POSSONO ESSERE “TRASCINATE”
Accoppiamento
Una reazione termodinamicamente
sfavorevole può essere guidata da una
termodinamicamente favorevole
mediante accoppiamento
Le reazioni con G positivo vengono accoppiate ad
altre con G negativo , tale che la somma algebrica
dei singoli valori dia G negativo finale che sposta a
destra il processo, cioè verso i prodotti:
la reazione, viene così “trascinata”, anche se
termodinamicamente sfavorita
REAZIONI ACCOPPIATE
A
B
C
G° = 10 kj/ mol
D
G° = - 30 kj/ mol
Se la cellula riucirà ad accoppiare queste due reazioni il G° complessivo =
somma algebrica dei singoli valori:
A + B
C + D
G° = - 20 kj/ mol
QUELLO DELLE REAZIONI ENDO ED ESOERGONICHE ACCOPPIATE E’ UNO DEI
PRINCIPI PIU’ IMPORTANTI DELLA BIOCHIMICA:
L’AGGANCIAMENTO DI PROCESSI FAVORITI E SFAVORITI E’ USATO :
SPINGERE REAZIONI
TRASPORTO DI MEMBRANA
TRASMISSIONI D’IMPULSI NERVOSI
CONTRAZIONI MUSCOLARI
Ossidazione
Maggiore e’ il contenuto in
elettroni e protoni di una
macromolecola e maggiore
sara’
la
sua
capacità
fornire energia:
Glucosio ~16 kJ·g-1
Palmitico acido ~39 kJ·g-1
di
Reazioni cataboliche
reazioni di ossido/riduzione
Reazioni di ossidazione (perdita di elettroni)
Attraverso l’ossidazione delle macromolecole, viene
liberata l’energia presente all’interno delle loro
strutture (e.s. zuccheri e lipidi)
Le reazioni di ossidazione sono sempre accoppiate
a reazioni di riduzione (guadagno di elettroni)
Reazioni accoppiate
Reazioni Accoppiate
G<O
Reazioni spontanee
G>O
Reazioni non spontanee
40% dell’energia ottenuta dalla combustione
delle macromolecole è utilizzata per la sintesi di ATP
La posizione intermedia
dell’ATP nella scala dei
potenziali di trasferimento
del fosfato
le consente di funzionare
come buon trasportatore di
gruppi fosforici
La reazione di idrolisi dell’ ATP e degli altri composti
altamente energetici è notevolmente favorita.
Ciò dà la possibilità di utilizzare questi composti come fonte
di energia libera, tramite la loro idrolisi.
PERCHE’ QUESTE IDROLISI SONO ALTAMENTE FAVORITE?
Basi chimiche
Stabilizzazione per risonanza
repulsione elettrostatica tra
ossigeni dei gruppi fosfato
Rilascio di
un
ortofosfato
Rilascio di
un
pirofosfato
ATP+H2O
ATP2O
ATP+H
AMP
+ 2Pi +
O-
O-
O= P – O-
O - P – O-
O-
O-
O-
O-
O - P =O-
O - P – O-
O-
O-
energia
3e- , H+
IN CHIMICA, SI
HA RISONANZA
QUANDO PIÙ
FORMULE, DETTE
FORMULE
LIMITE,
CONCORRONO A
DEFINIRE LA
VERA
STRUTTURA DI
UNA MOLECOLA.
Nel caso del fosfato, o meglio ortofosfato, le diverse forme di
risonanza contribuiscono ad elevare l’entropia, quindi il rilascio dell’
ortofosfato è notevolmente favorito.
Il processo di idrolisi e rilascio del fosfato,
inoltre l’idrolisi del pirofosfato generano prodotti con carica
negativa: la repulsione tra questi favorisce la reazione di idrolisi.
Quando è rilasciato il gruppo fosfato il resto della molecola si
ionizza rilasciando un H+ nel mezzo, azione favorita perché
effettuata in ambiente neutro, in cui la concentrazione di H+ è
molto bassa
(situazione che favorisce l’idrolisi).
La reazione :
è più frequente in vivo.
La resa energetica tra le due possibili reazioni di idrolisi che coinvolgono l’ATP,
è la stessa.
In alcune reazioni viene utilizzata la scissione del pirofofato, per ottenere ulteriore
energia. L ‘ AMP non è un composto ad alto contenuto energetico.
Il PPi viene idrolizzato dalla pirofosfatasi inorganica, originando due fosfati con un
∆G pari a –33,4 kj/mole (somma della rottura di entrambi i legami):
kj/mole
PPi+H2O-> 2Pi
∆G°’ = - 33,4
Quando è generato AMP, esso è poi riconvertito in ATP mediante
l’azione, in una prima fase, dell’enzima adenilato chinasi che, in un
ambiente in cui è presente Mg2+, catalizza la reazione reversibile:
ATP + AMP < Mg2+ > = ADP + ADP
∆G°’ ≈ 0
L’ADP formato può essere poi fosforilato ad ATP.
OSSIDAZIONI BIOLOGICHE
In linea di principio qualsiasi reazione esoergonica
può far procedere una reazione endoergonica,
purchè rilasci sufficiente energia libera
GLI ORGANISMI VIVENTI RICAVANO QUESTA ENERGIA
DALL’OSSIDAZIONE DEI SUBSTRATI ORGANICI.
PARTE DI QUESTA ENERGIA VIENE INTRAPPOLATA SOTTOFORMA DI
ENERGIA CHIMICA,
PRINCIPALMENTE TRAMITE LA SINTESI DI ATP.
NEL CATABOLISMO DEL GLUCOSIO CIRCA IL 40%
DEI 2870 KJ/mol RILASCIATI SONO RESI
DISPONIBILI PER SINTETIZZARE ATP
Ossidazione, riduzione e
trasferimento energetico
Durante la demolizione dei nutrienti
(molecole organiche complesse) aumenta
l’entropia e viene rilasciata energia libera
Attraverso quale via viene trasferita
l’energia contenuta nei legami chimici dei
nutrienti e ad altre molecole durante il
metabolismo?
SINTESI DELL’ATP
FOSFORILAZIONE A LIVELLO DEL SUBSTRATO : reazioni che liberano energia
sufficiente per :
ADP+ Pi
ATP
ΔG : 7,3 kcal/ mol
La glicolisi ed il ciclo di Krebs producono
una quantità piccola di energia come ATP (4 MOLI)
FOSFORILAZIONE OSSIDATIVA:
Nella glicolisi e nel ciclo di Krebs vengono prodotti dall’ossidazione del
glucoso nel complesso anche 10 moli di NADH ed 2 moli di FADH2 per ogni
mole di glucoso ossidato.
La riossidazione di questi trasportatori di elettroni ridotti produce la
maggior parte dell’energia necessaria per la sintesi dell’ATP.
A + NAD+
NADH + ADP +Pi
B + NADH
NAD+ + ATP
I NUCLEOTIDI PIRIDINICI E FLAVINICI
SONO TRASPORTATORI DI ELETTRONI,
CHE HANNO IL COMPITO DI TRASFERIRE
ELETTRONI ALL’OSSIGENO
NAD+
ESSI CORRISPONDONO AD
EQUIVALENTI DI RIDUZIONE
GENERATI DAL CATABOLISMO
CELLULARE, CHE VERRANNO
RIOSSIDATI A LIVELLO DELLA
MEMBRANA MITOCONDRIALE
INTERNA
FMN
FAD
Le CELLULE AEROBIE trasferiscono elettroni dai substrati
ridotti all’ossigeno molecolare, mediante una serie di passaggi a
livello della membrana mitocondriale interna.
Qui si ha una serie di reazioni accoppiate di
ossidoriduzione, in cui gli elettroni vengono fatti passare
lungo una serie di trasportatori speciali di elettroni ,
che costituiscono la catena respiratoria.
ATP
Sintasi
IL PASSAGGIO FINALE È LA RIDUZIONE DELL’ O2 AD
H2O
Complessivamente la sequenza è assai esoergonica;
l’energia è sfruttata per produrre ATP da ADP + Pi
Il processo di fosforilazione
ossidativa (produzione di ATP) è
catalizzato dall'ATP sintasi,
complesso proteico integrato nella
membrana mitocondriale interna
così come lo sono i complessi della
catena respiratoria.
SI GENERA UN FLUSSO DEGLI ELETTRONI MOLTO
COMPLESSO,
PASSANDO DA NUMEROSI TRASPORTATORI
ATTRAVERSO REAZIONI ENZIMATICHE SPECIFICHE.
TALI TRASPORTATORI DONANO GLI ELETTRONI A
DEGLI ACCETTORI
CON IL CONTEMPORANEO RILASCIO DI ENERGIA.
Complessivamente vengono prodotte 38 molecole di ATP :
38 x ~31 / 2870 = 40 % (energia utilizzata per la sintesi di ATP)
(ΔG di sintesi dell’ATP)
L’energia libera dalla demolizione
completa del glucosio
MOLECOLA DI GLUCOSIO
• All’interno degli organismi la fonte di elettroni può
essere un composto relativamente ridotto, come il
glucosio.
• Il glucosio, ossidato enzimaticamente, libera elettroni
che fluiscono spontaneamente attraverso una serie di
trasportatori sino a raggiungere un’altra specie chimica
con elevata affinità per gli elettroni trasportati, come è
l’ossigeno.
• L’OSSIGENO , ACCETTORE FINALE E’ UN POTENTE
OSSSIDANTE, POSSIDE UNA SPICCATA TENDENZA
AD ATTRARRE ELETTRONI E DI CONSEGUENZA A
RIDURSI
• Il flusso è spontaneo ed esoergonico avendo l’ossigeno
un’affinità per gli elettroni maggiore di tutti gli altri
intermediari che lo precedono.
QUESTE REAZIONI SONO POSSIBILI GRAZIE A :
COMPOSTI IN GRADO DI DARE GROSSE VARIAZIONI DI ENERGIA LIBERA
TRASPORTATORI DI ENERGIA LIBERA DELLA CELLULA.
COMPOSTI :
AD ALTO CONTENUTO ENERGETICO
POSSONO SUBIRE L’IDROLISI DEI LORO
GRUPPI FOSFORICI
Non spontanea
spontanea
ADP + Pi <- ATP
G=+31 KJ/mol
Fosfoenolpiruvato + H2O > PIRUVATO G= -62 KJ/mol
L’ ADENOSIN-TRIFOSFATO (ATP)
E’ IL PIU’ IMPORTANTE DI QUESTI COMPOSTI
Nucleotide costituito da una adenina, un riboso un’unità trifosfato.
La forma attiva è normalmente un complesso ATP con ioni Mg2+ o Mn2+.
E’ UNA MOLECOLA RICCA DI ENERGIA PER VIA DEI LEGAMI FOSFOANIDRIDICI
NELL’UNITÀ TRIFOSFATO.
ATP + H2O
ADP + Pi + H+
ΔG° = - 7,3 kcal /mole
-30,5 Kj/mole
ATP + H2O
AMP + PPi + H+
ΔG° = - 7,3 kcal /mole
–30,5 Kj/mole
Tra tutti i composti ad alto contenuto energetico l’ATP occupa una
posizione unica
Larga parte dell’energia utile ai fini biologici prodotta dalle
reazioni cataboliche viene convogliata nell’ATP e da questo
distribuita per le varie forme di lavoro cellulare
La maggior parte dei legami ad alta energia di idrolisi si forma
nella catena respiratoria durante la riossidazione dei coenzimi
ridotti NADH e FADH2 ad opera dell’O2
Nella catena respiratoria l’energia libera delle reazioni
ossidoriduttive viene utilizzata per formare ATP da ADP e Pi
(fosforilazione ossidativa)
NB. Legami ad alta energia libera di idrolisi si formano anche al di
fuori della catena respiratoria, direttamente sui substrati che
vanno incontro alle trasformazioni cataboliche (fosforilazione a
livello del substrato)
ATP
ATP = Adenosin Trifosfato
ADP = Adenosin Difosfato
ADP
Rottura pirofosforica
(G°’ = -33.5 kJ/mol)
Champe et al., Le basi della biochimica, Ed. Zanichelli
I COMPOSTI FOSFORILATI
possono essere suddivisi in due gruppi
in virtù della loro energia libera standard di idrolisi:
composti ad alta energia con ∆G°’ di idrolisi più
negativo di –25 kj/mole
i composti a bassa energia con valori meno negativi di
–25 kj/mole.
L’ATP, con un valore di ∆G di idrolisi pari a –
30kj/mole (7,3 kcal/mole), risulta come appartenente ai
composti ad alta energia.
Il glucosio-6-fosfato, con energia libera standard di
idrolisi di –13,8 kj/mole (3,3 Kcal/mole), appartiene
invece ai composti a bassa energia.
In altri termini i composti fosforilati possono avere
alto o basso POTENZIALE DI TRASFERIMENTO del
gruppo fosforico.
Es.:
Nel caso del gruppo fosforico del fosfoenolpiruvato (PEP), il potenziale
di trasferimento del gruppo stesso è molto elevato, maggiore di quello
dell’ATP,
il potenziale di trasferimento del gruppo fosfato
del glucosio-6-fosfato è basso.
POTENZIALE DI TRASFERIMENTO : - ∆G° di idrolisi
CIASCUN COMPOSTO PUÒ “SPINGERE”
LA FOSFORILAZIONE
DEI COMPOSTI PIÙ IN BASSO
NELLA SCALA DI ∆G°.
REAZIONI ACCOPPIATE
Glucosio + Pi --> glucosio-6-fosfato + H2O
∆G = 13,8 Kj/mole.
In condizioni normali, la reazione non procederà spontaneamente nella direzione proposta.
L’idrolisi di ATP ad ADP + Pi è, al contrario, molto esoergonica:
ATP + H2O --> ADP + Pi
∆G = –30,5 Kj/mole
Le due reazioni descritte hanno in comune gli intermedi Pi e H2O,
possono pertanto divenire sequenziali originando:
ATP + glucosio --> ADP + glucosio-6-fosfato
La variazione di energia libera standard complessiva viene calcolata sommando i
valori di ∆G delle due reazioni, pari a –16,7 Kj/mole.
In questo caso l’energia conservata nei legami dell’ATP viene usata per favorire la
sintesi di glucosio-6fosfato.
Ad es. :
il fosfoenolpiruvato ha un potenziale di trasferimento molto alto :
- 62 kj/mol
Esso può aggiungere un gruppo fosforico all’ADP : ∆G°= +31 kj/mol
La reazione accoppiata:
PEP + ADP
piruvato + ATP
L’ATP può cedere il Pi al glucoso
∆G°= +14 kj/mol
ha un ∆G°= - 31 kj/mol
glucoso-6-fosfato:
La fosforilazione del glucoso arriva ad avere un ∆G°= -17 kj/mol
Acetil CoA
Coenzima A
-31.5 kJ/mol
Il termine
LEGAME FOSFORICO AD ALTA ENERGIA
non deve trarre in inganno,
in quanto non è direttamente il legame a
contenere energia,
(non c’è nulla di speciale in questo legame)
ma l’elevata energia rilasciata è dovuta al fatto
che, i prodotti della reazione hanno un
contenuto energetico minore rispetto a quello
dei reagenti
Coenzimi redox
NAD+, NADP+
FAD, FMN
Champe et al., Le basi della biochimica, Ed. Zanichelli
Ossidoriduzioni
Enzimi che usano NAD O NADP come cofattori
Reazioni di ossido-riduzione
Mentre la demolizione di molecole organiche produce sia energia che equivalenti di
riduzione, la biosintesi li richiede entrambi.
La principale fonte di elettroni nelle biosintesi riduttive (acidi grassi) è il NADPH
NADP+ e NADPH sono identici a NAD e NADH eccetto che per un gruppo fosfato.
NAD+ e NADP+ hanno la stessa tendenza ad accettare e-, (identico E0)
Le vie cataboliche e gli enzimi ossidanti (deidrogenasi) utilizzano NAD+ ,
Le vie anaboliche e gli enzimi riducenti (reduttasi) utilizzano il NADPH
Nella via dei pentosi due deidrogenasi convertono NADP+ in NADPH e
costituiscono la
via di sintesi principale di questi nucleotidi ridotti.
FAD
Enzimi che usano FAD e FMN come cofattori
Reazioni di ossido-riduzione
Forma ossidata
Forma ridotta
Il Metabolismo è quindi l'insieme delle attività chimiche
che vengono svolte da un organismo vivente per conservare
il proprio livello di organizzazione
Le cellule catturano quindi l'energia dall'ambiente
attraverso processi esoergonici (DG < 0);
la convertono in ATP e NADH e la utilizzano per
sostenere i processi endoergonici (DG > 0) e per tutte
le altre loro necessità.