Proteine e Amminoacidi
Proteine e Amminoacidi
Lezione 1
Domanda!
Che trasformazione avviene quando cuociamo
un uovo al tegamino?
Prova tu a rispondere e poi continua a leggere….
Proteine e amminoacidi
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Le proteine sono macromolecole biologiche costituite
da catene di amminoacidi.
Amminoacido
(unità base)
Esistono decine di migliaia
di differenti proteine
Proteina
Catena
polipeptidica
20 amminoacidi
che possono
concatenarsi in
ordine diverso
Una o più catene
polipeptidiche
formano
Gli amminoacidi
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Gli amminoacidi essenziali sono 20, si trovano in tutte le cellule
e formano le proteine.
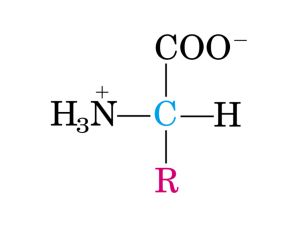
Struttura generale di un amminoacido:
H
PARTE FISSA
(comune a tutti
gli amminoacidi)
H
GRUPPO
AMMINICO
O
N
H
C
GRUPPO
CARBOSSILICO
C
CARBONIO
α
OH
R
GRUPPO
VARIABILE
Determina le proprietà
chimico fisiche
Alcuni amminoacidi
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
H
H
H
H
O
N
C
N
C
C
H
C
H
O
OH
OH
H
HC
CH3
OH
GLICINA
TREONINA
LISINA
Emoglobina
Classificazione degli amminoacidi
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
La classificazione degli amminoacidi avviene in base al gruppo variabile
Amminoacidi con
gruppi
R.
apolari
1.
2.
3.
4.
5.
6.
7.
8.
9.
Amminoacidi con
Glicina
Alanina
Valina
Leucina
Isoleucina
Metionina
Fenilanina
Triptofano
Prolina
gruppi
1.
2.
3.
4.
5.
6.
Amminoacidi con
R.
polari non carichi
Serina
Treonina
Asparagina
Glutammina
Tirosina
Cisteina
R
gruppi
R.
polari e carichi
1.
2.
3.
4.
5.
Lisina
Arginina
Istidina
Acido Aspartico
Acido Glutamminico
Legame peptidico
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Gli amminoacidi si legano tra loro attraverso un legame peptidico.
REAZIONE DI CONDENSAZIONE
Amminoacidi
Dipeptide
Il carbonio del gruppo carbossilico si lega all’azoto del gruppo amminico e si
libera una molecola d’acqua.
Catena Polipeptidica
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Tramite altre reazioni di condensazione si possono legare più amminoacidi
formando una Catena polipeptidica (o polipeptide)
Una catena polipeptidica può essere formata da 2-3 amminoacidi fino a
centinaia di amminoacidi.
Idrolisi
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Il processo inverso alla condensazione è l’IDROLISI e permette di scindere,
per effetto dell’acqua, una catena polipeptidica nei suoi amminoacidi.
PROCESSO DI IDROLISI
Dipeptide
Amminoacidi
Le proteine
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Le proteine sono macromolecole formate da una o più catene polipeptidiche.
Queste catene possono assumere differenti disposizioni spaziali che dipendono
dalla sequenza di amminoacidi da cui sono formate.
Esistono migliaia di differenti proteine.
La funzione di una proteina dipende
dalla sua struttura tridimensionale.
Struttura primaria
Introduzione
Amminoacidi
Legame
peptidico
Classificazione
Proteine
Classificazione
Struttura
Albumina
Emoglobina
La struttura primaria consiste nella sequenza di amminoacidi da cui è
costituita la catena polipeptidica.
Lys
Hys
Gly
Leu
Val
Gly
Lys
Ala
hys
Lys
Leu
Ala
Val
Gly
Lys
Ogni cambiamento della struttura primaria può influenzare la struttura globale
della proteina e la sua funzionalità.
Struttura secondaria
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
La struttura secondaria consiste nella forma che assume la catena
polipeptidica ripiegandosi su se stessa.
ALFA ELICA
LAMINE BETA
(FOGLIO RIPIEGATO)
Miosina (nei muscoli)
Fibroina (nella seta e nella
tela di ragno)
Gli amminoacidi presenti in punti diversi della catena si uniscono tra loro
formando legami a idrogeno.
Struttura terziaria
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
La struttura terziaria è data da un ulteriore ripiegamento della molecola che
dà origine all’aspetto globulare della proteina.
Formazione di legami a idrogeno o di altro tipo tra i gruppi R di amminoacidi
posti in posizioni diverse della catena polipeptidica.
La struttura terziaria è direttamente legata alla funzione della proteina.
Esempio:
Le proteine globulari presenti in
soluzioni acquose si avvolgono in modo
da avere gruppi R idrofili rivolti verso la
parte esterna della proteina e quindi a
contatto con l’acqua.
Struttura quaternaria
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
La struttura quaternaria è formata dall’unione di più molecole proteiche con
una struttura terziaria (subunità).
Le subunità che formano la
stuttura possono essere
identiche oppure di tipi diversi
(come avviene nell’emoglobina).
Struttura
Introduzione
Amminoacidi
Lys
Hys
Gly
Leu
Val
Gly
Lys
Ala
Legame
peptidico
Classificazione
hys
Lys
Leu
Ala
Val
Lys
Gly
Proteine
Struttura
Classificazione
Albumina
Emoglobina
STRUTTURA PRIMARIA
STRUTTURA SECONDARIA
STRUTTURA TERZIARIA
STRUTTURA QUATERNARIA
Classificazione delle proteine
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
Le proteine vengono classificate in base alla loro funzione in 7 classi:
CLASSE
FUNZIONE
ESEMPI
1
STRUTTURALI
Materiali per costruire ogni struttura
Fibre dei tendini e dei legamenti, tela del
ragno, albumina, ….
2
CONTRATTILI
Permettono i movimenti muscolari
Actina e Miosina (nei muscoli)
3
DI RISERVA
Funzione energetica, scorta di
nutrienti essenziali
Ovalbumina (nell’albume dell’uovo): riserva
di amminoacidi per l’embrione
4
DI DIFESA
Difesa degli organismi da agenti
esterni
Anticorpi: difendono dalle infezioni
5
DI TRASPORTO
Trasporto di elementi essenziali
Emoglobina: trasporto dell’ossigeno
6
SEGNALE
Messaggeri tra cellule per
coordinare le attività corporee
Ormoni
7
ENZIMI
Catalizzatori chimici (aumentano la
velocità di una reazione chimica)
Idrolasi: catalizza reazioni di idrolisi
Curiosità: l’ALBUMINA
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Che trasformazione avviene
quando cuociamo
un uovo al tegamino?
Proteine
Struttura
Classificazione
Albumina
Emoglobina
La struttura di una proteina può cambiare
anche a causa di fattori chimici o fisici
DENATURAZIONE:
deformazione della struttura terziaria per
rottura dei legami tra amminoacidi situati
in posizioni diverse della catena
polipeptidica.
Nella cottura di un uovo l’alta
temperatura causa la
denaturazione dell’albumina
rendendola non più solubile.
Non viene compromessa la struttura
primaria ma la molecola perde la sua
funzione.
Esempio di proteina: l’ EMOGLOBINA
Introduzione
Amminoacidi
Classificazione
Legame
peptidico
Proteine
Struttura
Classificazione
Albumina
Emoglobina
L’emoglobina è una proteina globulare che si trova nei globuli rossi del sangue.
La sua funzione è di trasporto dell’ossigeno dai polmoni alle altre parti del corpo.
ANEMIA FALCIFORME
Malattia causata dalla sostituzione di un
amminoacido con un altro nella struttura primaria
dell’emoglobina.
Le molecole di emoglobulina risultano con una
conformazione diversa e indurite
I globuli rossi assumono una forma a falce
anziché tonda e, ostacolandosi a vicenda, si
creano accumuli nei vasi capillari.
Proteine e Amminoacidi
ESERCIZI
Proteine e Amminoacidi
Completa l’immagine con le seguenti parole
CARBONIO α
GRUPPO CARBOSSILICO
PARTE FISSA
GRUPPO VARIABILE
GRUPPO AMMINICO
H
……………….
H
O
N
………………..
C
………………….
C
H
OH
…………………
R
……………….
Soluzione
Proteine e Amminoacidi
Collega ogni struttura con la relativa immagine e descrizione:
Struttura primaria
Primo ripiegamento della catena
polipeptidica
Struttura secondaria
Struttura terziaria
Struttura quaternaria
Unione di più
subunità
Ulteriore ripiegamento della
catena polipeptidica
Sequenza di amminoacidi
Soluzione
Proteine e Amminoacidi
Collega ogni tipo di proteina con la sua funzione e il relativo esempio:
Classe di proteine
CONTRATTILI
DI RISERVA
Funzione
Esempio
Trasporto di elementi
essenziali
albumina
Permettono i movimenti
muscolari
Ovalbumina
Anticorpi
ENZIMI
Messaggeri tra cellule
STRUTTURALI
Difesa degli organismi da
agenti esterni
Miosina
Ormoni
SEGNALE
Funzione energetica
DI TRASPORTO
Emoglobina
Materiali per costruire i tessuti
DI DIFESA
Catalizzatori chimici
Idrolasi
Soluzione
STRUTTURALI
Materiali per costruire i
tessuti
CONTRATTILI
Permettono i movimenti
muscolari
DI RISERVA
Funzione energetica
DI DIFESA
Difesa degli organismi da
agenti esterni
Anticorpi
DI TRASPORTO
Trasporto di elementi
essenziali
Emoglobina
SEGNALE
Messaggeri tra cellule
ENZIMI
Catalizzatori chimici
albumina
Miosina
Ovalbumina
Ormoni
Idrolasi
Proteine e Amminoacidi
Indica se ogni affermazione è vera (V) o falsa (F):
Una catena polipeptidica è formata da una sequenza di proteine
□V
□F
Esistono migliaia di tipi di amminoacidi che formano le proteine
□V
□F
La denaturazione è un processo che causa l’alterazione della struttura terziaria di
una proteina
□V
□F
La denaturazione causa non causa cambiamenti nella funzionalità della proteina
□V
□F
Una proteina può essere costituita da più catene polipeptidiche diverse tra loro
□V
□F
L’α-elica è un tipo di struttura quaternaria delle proteine
□V
□F
Un cambiamento nella struttura primaria di una proteina può influenzare la sua
funzionalità
□V
□F
Il processo di idrolisi, per scindere i legami peptidici, necessita di H2O
□V
□F
Il legame peptidico si instaura tra i gruppi carbossilici di due amminoacidi
□V
□F
La classificazione degli amminoacidi avviene in base al gruppo amminico
□V
□F
Soluzione
Una catena polipeptidica è formata da una sequenza di proteine
□V
□F
Esistono migliaia di tipi di amminoacidi che formano le proteine
□V
□F
La denaturazione è un processo che causa l’alterazione della struttura terziaria di
una proteina
□V
□F
La denaturazione causa non causa cambiamenti nella funzionalità della proteina
□V
□F
Una proteina può essere costituita da più catene polipeptidiche diverse tra loro
□V
□F
L’α-elica è un tipo di struttura quaternaria delle proteine
□V
□F
Un cambiamento nella struttura primaria di una proteina può influenzare la sua
funzionalità
□V
□F
Il processo di idrolisi, per scindere i legami peptidici, necessita di H2O
□V
□F
Il legame peptidico si instaura tra i gruppi carbossilici di due amminoacidi
□V
□F
La classificazione degli amminoacidi avviene in base al gruppo amminico
□V
□F
Proteine e Amminoacidi
Individua la risposta corretta:
Le proprietà chimiche e fisiche di un amminoacido dipendono
A)
B)
C)
D)
dal gruppo carbossilico
dal gruppo amminico
dal gruppo variabile
da tutti e 3 i gruppi
L’emoglobina è
A) un amminoacido strutturale
B) un amminoacido di trasporto
C) una proteina strutturale
D) una proteina di trasporto
L’anemia falciforme è una malattia causata da una anomalia
A)
B)
C)
D)
nella struttura primaria
nella struttura secondaria
nella struttura terziaria
nella struttura quaternaria
Soluzione
Le proprietà chimiche e fisiche di un amminoacido dipendono
A)
B)
C)
D)
dal gruppo carbossilico
dal gruppo amminico
dal gruppo variabile
da tutti e 3 i gruppi
L’emoglobina è
A)
B)
C)
D)
un amminoacido strutturale
un amminoacido di trasporto
una proteina strutturale
una proteina di trasporto
L’anemia falciforme è una malattia causata da una anomalia
A)
B)
C)
D)
nella struttura primaria
nella struttura secondaria
nella struttura terziaria
nella struttura quaternaria