Proprietà delle soluzioni
elettrolitiche
Soluzioni Elettrolitiche
Soluzioni in cui il soluto è un elettrolita
Elettrolita: sostanza che determina la presenza di ioni in soluzione per
dissociazione o ionizzazione
Elettroliti
Composti ionici
(NaCl, CuSO4, ecc.)
Composti molecolari
(HCl, NH3, ecc.)
In solventi
polari (H2O, ecc.)
Puri in fase liquida
Dissociazione/ionizzazione completa
o parziale in ioni positivi
e ioni negativi
Elettroliti forti Dissociazione completa (acidi e basi forti, sali)
Elettroliti deboli Dissociazione parziale (acidi e basi deboli)
Grado di dissociazione
ndissociate
niniziali
L’Osservazione Sperimentale
Le soluzioni elettrolitiche sono capaci di chiudere il circuito elettrico
Le soluzioni elettrolitiche sono conduttori di corrente elettrica
La spiegazione
• La conducibilità elettrica è dovuta al moto orientato di cariche elettriche
In soluzione sono presenti
specie cariche (ioni)
La differenza di potenziale applicata
attraverso il generatore di corrente
induce un moto orientato di cariche
elettriche
Moto orientato di cationi e
anioni in soluzione
Conducibilità elettrica delle
soluzioni elettrolitiche
Tipi di conduttori
Conduttori elettronici o di prima specie: a conduzione elettronica,
senza trasporto di materia (metalli, leghe, grafite, …)
Conduttori elettrolitici o di seconda specie: a conduzione ionica,
con trasporto di materia (elettroliti)
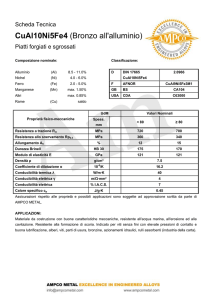
Conducibilità elettrica
I Conduttori di I specie rispettano le leggi di Ohm
Legge di Ohm
V RI
l
R
S
V: differenza di potenziale (volt, V)
R: resistenza elettrica (ohm, )
I: intensità di corrente (ampere, A)
1 1S
C
R l
1
l: lunghezza del conduttore (cm)
S: sezione del conduttore (cm2)
: resistività o resistenza specifica ( cm)
C: conduttanza (-1 o siemens, S)
: conducibilità o conduttanza specifica (S-1)
Le soluzioni elettrolitiche non sono conduttori ohmici in corrente continua (DC) ma rispettano
abbastanza bene la legge di Ohm in corrente alternata (AC) ad alta frequenza
Fattori che influenzano la Conducibilità delle soluzioni elettrolitiche
•concentrazione, carica e mobilità (cm/s•V) degli ioni
•temperatura
Conducibilità e Concentrazione di Elettrolita
Osservazioni sperimentali
A parità di temperatura e di solvente la conduttività:
Forte
Debole
- aumenta al crescere della concentrazione
dell’elettrolita (C°).
Forti: L’incremento è proporzionale alla
concentrazione C°.
Deboli: L’andamento è non lineare.
- Per valori di concentrazione elevati, la conduttività,
raggiunto un massimo, diminuisce.
C°
[mol/lt]
Conducibilità e Concentrazione
Il passaggio di corrente elettrica
alternata in una soluzione è
possibile grazie al movimento degli
ioni in essa contenuti.
In soluzioni diluite (basse
concentrazioni di elettrolita) gli
ioni non interagiscono tra loro
Il movimento degli ioni è indipendente
La conducibilità (χ) di una soluzione sarà tanto
maggiore quanto maggiore è la concentrazione di
specie ioniche presenti.
Conducibilità e Concentrazione
Il passaggio di corrente elettrica
alternata in una soluzione è possibile
grazie al movimento degli ioni in
essa contenuti.
In soluzioni concentrate (alte
concentrazioni di elettrolita) gli
ioni interagiscono tra loro
Le forze elettrostatiche ostacolano
la mobilità degli ioni
La conducibilità (χ) di una soluzione diminuisce ad
alte concentrazioni di elettrolita
Conducibilità e Concentrazione
Elettroliti Forti
Grado di dissociazione = 1
All’aumentare della concentrazione di
elettrolitica (C°) , aumenta
proporzionalmente la concentrazione dei
portatori di carica
C°
[mol/lt]
La conducibilità aumenta
linearmente con la concentrazione
di elettrolita.
Conducibilità e Concentrazione
Grado di dissociazione < 1
Elettroliti deboli
F- + H3O+
H O F
ka
3
HF
1,0
2
1
Co
Forte
0,10
Concentrazione Portatore Carica
Grado di dissociazione
HF + H2O
0,8
0,6
0,4
0,2
0,0
0,00
0,01
0,02
0,03
0,04
0,05
0,06
0,07
Concentrazione Iniziale
Concentrazione Molare dei Portatori di Carica:
0,05
[F-] =[H3O+] = C0
Debole
0,00
0,00
0,05
Concentrazione Iniziale (mol/lt)
0,10
Per gli elettroliti deboli la concentrazione
dei portatori di carica aumenta con C0, ma
non in modo lineare
Conducibilità e Natura Chimica degli Ioni
A parità di concentrazione (C0), la conducibilità (χ) sarà tanto maggiore quanto più
facile è il movimento degli ioni nella soluzione :
La χ diminuisce all'aumentare delle interazioni ione-solvente. Queste
dipendono dal rapporto carica/raggio degli ioni
Conducibilità e Temperatura
Uno ione in soluzione
è solvatato, ossia
circondato
da
molecole di solvente
Ogni fluido è caratterizzato da una
resistenza allo scorrimento (attrito
interno)
La
viscosità
esponenzialmente
temperatura
diminuisce
con
la
Nel suo movimento trascina le
molecole di solvente che lo
circondano, determinando un moto
relativo (scorrimento) rispetto a
quelle più distanti
La viscosità è una proprietà dei fluidi
che quantifica la resistenza allo
scorrimento
La mobilità degli ioni solvatati aumenta
con l’aumentare della temperatura
La conducibilità dei conduttori di II specie
aumenta all’aumentare della temperatura