INTRODUZIONE ALLA CONDUTTIMETRIA
CONDUTTIMERIA: tecnica analitica strumentale basata sulla misura della conducibilità elettrica di
una soluzione elettrolitica.
SOLUZIONI ELETTROLITICHE: sono soluzioni acquose di acidi, idrossidi oppure sali, che
conducono l’elettricità grazie alla dissociazione ionica dei soluti. Il trasporto dell’elettricità è dovuto
alla migrazione dei cationi ed agli anioni quando la soluzione è sottoposta all’influenza di un campo
elettrico.
Conducibilità o Conduttanza () della soluzione: è l’inverso della resistenza:
1
R
1
R = resistenza; ohm ( )
= conduttanza; siemens (S)
Conducibilità specifica () della soluzione: è l’inverso della resistività:
= resistività; ( cm)
= conducibilità specifica; (S cm1)
Relazione tra Conduttanza e Conducibilità specifica:
in base alla 2^ legge di Ohm la resistenza dipende dalla geometria del conduttore:
R
= resistività; ( cm)
l = lunghezza; cm
S = area della sezione; cm2
S
elettrodi
Elaborando, si ottiene la relazione tra e :
S
S
1 1 S
S
K
R
l
Il rapporto S / l =K dicesi costante di cella
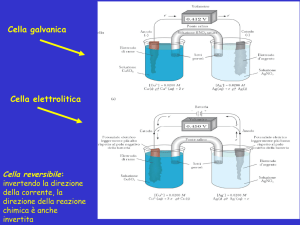
La conducibilità di una soluzione si misura mediante conduttimetro e cella conduttimetrica;
quest’ultima è costituita da due elettrodi piani e paralleli, di area S cm2 , posti alla distanza l cm.
La costante di cella tiene conto della superficie effettiva degli elettrodi che risultano ricoperti
da una “spugna di platino”; perciò la costante di cella K viene determinata sperimentalmente.
Legge fondamentale della conduttimetria:
=K
La conducibilità specifica della soluzione dipende dai seguenti quattro fattori:
1
Concentrazione ionica
2
Cariche ioniche
3
Velocità di migrazione degli ioni
4
Temperatura
In soluzioni diluite, è proporzionale alla concentrazione ionica,
sia per elettroliti forti che per elettroliti deboli.
A parità di condizioni, è proporzionale alla carica ionica; ioni
bivalenti trasportano una carica doppia rispetto i monovalenti.
La velocità di migrazione di uno ione dipende dal rapporto
carica/raggio e dalla sua massa; inoltre risente dell’interazione
con gli altri ioni e con il solvente.
aumenta dell’1-3% per ogni grado di aumento della
temperatura
1
INTRODUZIONE ALLA CONDUTTIMETRIA
Conducibilità equivalente (e): è la conducibilità d una soluzione che contiene 1 equivalente di soluto,
ovvero 1 mole di cariche elettriche.
La conducibilità equivalente e permette di confrontare soluzioni di elettroliti diversi, essendo e
indipendente dalla concentrazione della soluzione e dalla carica degli ioni.
Si definisce volume equivalente Ve il volume di soluzione che contiene 1 equivalente di soluto; esso è
Ve
legato alla normalità N dalla relazione:
1000
N
(deriva da:
1 = VN/1000)
In pratica, rappresenta la conducibilità di 1 ml (= 1cm3) di soluzione, mentre e rappresenta la
conducibilità di Ve ml di soluzione; vale la proporzione:
e : Ve = : 1
e Ve
1000
N
(Scm2/eq)
Il calcolo di e viene sempre eseguito indirettamente, tenendo conto della e della normalità N .
ESERCIZIO: calcolare e di una soluzione di CH3COOH 0,9893 N avente = 1,311 S/cm.
e = 1000 / N = 1,3111000 / 0,9893 = 1326 (Scm2/eq)
Conducibilità equivalente limite (°): è il valore massimo raggiunto dalla conducibilità equivalente
di un elettrolita a diluizione infinita.
In queste condizioni gli ioni di un elettrolita contribuiscono al passaggio di corrente l’uno
indipendentemente dall’altro e perciò cade la distinzione tra elettroliti forti e deboli. Su questo concetto
si fonda la seguente legge di Kohlrausch.
Legge di Kohlrausch (o legge della migrazione indipendente degli ioni): la conducibilità equivalente a
diluizione infinita di un qualunque elettrolita è uguale alla somma delle conducibilità equivalenti limite
dei singoli ioni:
° = °+ + °
° = conducibilità equivalente a diluizione infinità dell’elettrolita; (S cm2 /eq)
°+ = conducibilità equivalente a diluizione infinità del catione
° = conducibilità equivalente a diluizione infinità dell’anione
ESERCIZIO: dati i valori di ° riportati in tabella, calcolare ° di CH3COOH
elettrolita
CH3COONa
NaCl
HCl
° (Scm2 /eq)
91,0
126,45
426,16
Kohlrausch
° (CH3COONa) = ° (Na+) + ° (CH3COO)
° (NaCl)
= ° (Na+) + ° (Cl)
° (HCl)
= ° (H+)
+ ° (Cl)
° (CH3COOH) = ° (H+) + ° (CH3COO)
° (CH3COOH) = ° (HCl) + ° (CH3COONa) ° (NaCl) = 426,16 + 91 126,45 = 390,71 (Scm2/eq)
° (CH3COOH) = ° (H+) + ° (Cl) + ° (Na+) + ° (CH3COO) ° (Na+) ° (Cl)
Equazione di Onsager:
e (B A ) N
Per elettroliti forti, l’equazione precedente rappresenta una retta e ° è l’ordinata all’origine della retta.
2