Come primo argomento si affronterà
lo studio delle soluzioni elettrolitiche
poi gli aspetti legati ai processi elettrodici
e per ultimo le modalità di controllo dei processi.
Prof. M. Pasquali
Elettroliti
Definizione: CONDUTTORI IONICI ALLO STATO CONDENSATO (liquidi o
solidi), contenenti ioni mobili in grado di spostarsi sotto l’azione di un gradiente di
potenziale chimico o elettrico.
Gradiente di potenziale chimico → diffusione
Gradiente di potenziale elettrico → conduzione
Il trasporto di
materia per
d i f f u s i o n e
comporta una
separazione di
cariche (carica
spaziale) con
formazione di un
potenziale di
diffusione
Il trasporto di
cariche elettriche
per conduzione è
accompagnato da un
trasporto di materia
che dà luogo a
gradienti
di
concentrazione
(polarizzazione di
concentrazione)
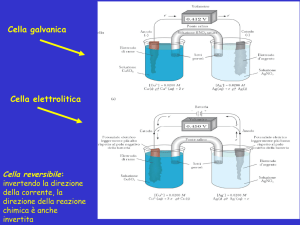
Doppio flusso degli ioni in soluzione a fronte di un passaggio di elettroni nel circuito esterno
Mobilità ioniche, conducibilità elettrica e numeri di trasporto
Mobilità ionica
Su uno ione di valenza zi in un campo elettrico con gradiente di potenziale (Volt/cm)
agisce la forza elettrica
in cui e = carica elettrica dell’elettrone
che tende a farlo muovere in direzione del campo elettrico a secondo del segno di zi .
In condizioni stazionarie la forza agente sullo ione è bilanciata da una forza resistente
(equazione di Stokes)
Fr = 6# r !" ! vi
proporzionale alla velocità vi con cui lo ione si muove, al suo raggio r e alla viscosità
del mezzo η.
vi =
V zi e
6" r #!
Se il gradiente del campo elettrico ( ) è unitario, la velocità assume un valore
caratteristico per lo ione ed è detta mobilità che è definita dalla relazione:
µi =
dimensionalmente
zi e
6" r #!
ovvero sottintendendo la condizione di 1V/cm.
Conducibilità elettrica
Dalla legge di Ohm
V = R!I
Si ricorda che I è la quantità di corrente (misurata in Ampere) che attraversa il conduttore
metallico quando ai suoi estremi si applica una differenza di potenziale V .
R detta resistenza del conduttore è costante a Temperatura costante e si misura in Ohm (Ω).
R="!
L
S
In cui ρ è la resistenza specifica o resistività del mezzo, L
è la lunghezza del conduttore ed S è la sua sezione.
Quindi ρ è la resistenza offerta al passaggio di corrente da
un conduttore che ha lunghezza di 1 cm e superficie 1cm2.
ρ si misura in Ω cm.
Spesso si fa uso del concetto di conducibilità del conduttore e
non di resistenza; la conducibilità non è altro che l’inverso della
resistenza
!=
1 1 S
= !
R " L
si misura in Siemens (S o Ω-1 )
"=#!
S
L
In cui χ è la conducibilità specifica o conduttanza del mezzo, è l’inverso della resistenza
specifica e si misura in S cm-1 oppure in Ω-1 cm-1.
Prof. M. Pasquali
Conducibilità elettrica
Ora se si scrive la legge di Ohm in funzione della conducibilità χ, della lunghezza
L e della sezione S si ha:
V =I!
Introducendo il gradiente di potenziale
e la densità di corrente
si ha:
Oppure sostituendo ad
si ha
1 L
!
" S
(volt/cm)
La conducibilità specifica χ , espressa in Ω-1 cm-1, si può definire come la quantità di carica
elettrica q che attraversa nel tempo unitario (t = 1 sec) un cubetto di lato unitario (L =1 cm; S =
1 cm2) tra le cui facce opposte sia applicata la differenza di potenziale di 1 volt (= 1 V/cm).
Conducibilità Equivalente
La conducibilità equivalente è la conducibilità misurata tra due elettrodi tra i quali
vi è un volume di soluzione che contiene un equivalente di elettrolita.
N : 1000 (cm3) = 1 eq : Veq
Veq =
1000
N
& cm 3 #
$$
!!
% eq "
Ω-1cm-1 cm3 eq-1
Λ = (Ω-1cm2 eq-1)
Numeri di trasporto
La conducibilità specifica χ , espressa in Ω-1 cm-1, è la quantità di carica elettrica q che
attraversa in 1 sec, un cubetto di lato unitario 1cm, quando viene applicato un gradiente di
potenziale di 1 V/cm.
La carica trasportata dai singoli ioni
µ+ e µ- la loro mobilità (velocità sotto il gradiente unitario di campo elettrico, = 1 V/cm)
Per la condizione di elettroneutralità il numero
di cariche elettriche positive sono uguali al
numero di cariche elettriche negative cioè
Conducibilità in termini di mobilità
Definiamo ora il numero di trasporto che per i diversi ioni sarà:
Per un elettrolita binario si ha
Prof. M. Pasquali
Più genericamente
Trasporto di materia nelle soluzioni elettrolitiche in seguito al
passaggio di corrente
Nella soluzione elettrolitica si ha un movimento di
ioni nelle due direzioni: i cationi vanno verso il polo
negativo mentre gli anioni vanno verso il polo
positivo
Alla superficie di separazione elettrodo/elettrolita la
corrente elettrica è trasportata solo dagli ioni di un dato
segno: i cationi al polo negativo e gli anioni al polo
positivo.
Supponiamo di dividere idealmente in tre scomparti la soluzione elettrolitica di un
elettrolizzatore: uno scomparto anodico in vicinanza dell'anodo, uno scomparto centrale,
ed uno scomparto catodico in vicinanza del catodo
Prof. M. Pasquali
Considerazioni sul trasporto di materia
Supponiamo che la mobilità del catione e dell'anione siano diverse, per esempio: µ+ = 2 ed
µ- = 1, studiamo il movimento degli ioni quando si fa passare corrente elettrica.
Supponiamo di far passare tre cariche elementari
Ricordando che q+ e q_ sono direttamente proporzionali alle mobilità µ+ e µ- , si avrà:
Da qui risulta che q+=2 e q-=1
Δja= -2
Δjc= -1
La variazione di concentrazione nel comparto anodico e
catodico,risulta proporzionale alla mobilità degli anioni
I° esempio esplicativo
Un elettrolizzatore in cui non si abbia scarica degli anioni all'anodo, ma dissoluzione
dell'elettrodo a formare cationi, come ad esempio Ag/AgN03/Ag.
Si suppone che sia: µ+=3 e µ-=2, e di far passare 5 cariche elettriche equivalenti (q = 5).
5Ag →5Ag+ +5e-
Quindi si ha q+ + q-= q = 5 ;
Prof. M. Pasquali
5Ag+ + 5e- → 5Ag
; q+=3 ; q-=2
II° esempio esplicativo
Un elettrolizzatore in cui non si ha scarica di cationi al catodo, ma formazione di anioni.
Due elettrodi di platino-iridio immersi in una soluzione di ioduro potassico e iodio.
2 I- → I2 + 2e-
I2 + 2e- → 2 I-
Risulta che per K+ e I- è µ+= µ- , e di far passare 4 cariche elettriche equivalenti (q = 4).
Quindi si ha q+ + q-= q = 4 ;
Prof. M. Pasquali
; q+=2 ; q-=2
In pratica
Consideriamo una soluzione di HCl contenente ad esempio 5 grammoequivalenti/litro, che
elettrolizzata svolga idrogeno al catodo (2H+ +2e- →H2) e cloro all'anodo (2Cl- →Cl2 +2e-),
potremo calcolare le variazioni di concentrazione dalle mobilità che risultano rispettivamente:
µ+ = 36,2·10-4 cm2 sec-1 V-1 e
µ- = 7,91·10-4 cm2 sec-1 V-1
e se si fanno circolare 1,1 F di elettricità si ha:
Si ha:
Approssimando: q+=0,9F e q-=0,2F
La variazione del n° di grammoequivalenti all'anodo (Δja) risulterà uguale a -1,1 Cl- + 0,2 Cl- = - 0,9 ClLa variazione del n° di grammoequivalenti al catodo (Δjc) risulterà uguale a -1,1 H+ + 0,9 H+ = - 0,2 H+
Se il volume delle zone anodica e catodica è di 0.5 litri ciascuna
il Δca. nella zona anodica è 1,8 g equ/lit e Δcc nella zona catodica è 0,4 g equ/lit
la nuova concentrazione risulta quindi 5 - 1,8 = 3,2 grammoequivalenti/litro all'anodo, e 5 - 0,4 =
4,6 grammoequivalenti/litro al catodo
Prof. M. Pasquali
Si ha quindi
dove
il numero di trasporto del catione
il numero di trasporto dell’anione
Considerando una soluzione elettrolitica comprendente “i” diverse specie ioniche, avremo:
Prof. M. Pasquali
Concludendo
•
La mobilità (ed il coefficiente di diffusione) rappresenta la
proprietà di trasporto assoluta del singolo ione;
• La conducibilità rappresenta la proprietà di trasporto
cumulativa di tutti gli ioni presenti nella soluzione elettrolitica:
la conducibilità specifica si riferisce agli ioni presenti
nell'unità di volume della soluzione elettrolitica considerata; la
conducibilità equivalente invece si riferisce agli ioni la cui
carica corrisponde ad un grammoequivalente di ioni positivi e
ad un grammoequivalente di ioni negativi;
• Il numero di trasporto rappresenta la proprietà di trasporto
relativa di uno ione rispetto alle proprietà di trasporto di tutti
gli altri ioni globalmente presenti nella soluzione elettrolitica.
Analisi dimensionale
V=
V kg " m 2 " s !3 A!1
=
m
m
zi ! e = coulomb = A ! s
# = viscosità = kg " s-1 " m!1
vi =
V zi e
6" r #!
kg " m " s !3 " A!1 " A " s
vi =
= m " s !1
!1 !1
m " kg " s m
Torna alla
presentazione
Prof. M. Pasquali
Gli elettroliti binari, rappresentano la stragrande maggioranza degli elettroliti e
sono quelli più comunemente trattati in elettrochimica,
si distinguono in:
simmetrici (aventi il catione e l'anione di ugual valenza, cioè gli uni/uni-valenti
(NaCl), bi/bi-valenti (CaCO3) , tri/tri-valenti (FePO4), ... , z/z-valenti)
asimmetrici (aventi il catione e l'anione di diversa valenza, cioè gli uni/bi-valenti
(Na2SO4), uni/tri-valenti (K3PO4), uni/tetra-, bi/tri- ( Ca3(PO4)2 ), ... , z/w-valenti).
Gli elettroliti ternari (esempi: KNaC03, K(SbO)C4H4O6, KNaC4H4O6) o i
quaternari sono di limitato interesse, sia dal punto di vista teorico che pratico.