isotopi
Scoperta
Spiegazione di anomalie
proprietà
applicazioni
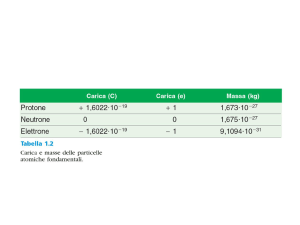
Masse atomiche
• Ogni atomo ha una massa che risulta
dovuta alla somma delle masse dei suoi
nucleoni :protoni
• Potremmo aspettarci che le masse
atomiche siano valori interi, somme di
particelle tra loro praticamente uguali
• Invece spesso le masse determinate con
i metodi sperimentali forniscono valori
con decimali
Andamento prevedibile nelle masse atomiche secondo numero
atomico (protoni=elettroni) crescente
Numero atomico
1
1
Numero di massa
2
2
4
3
3
5
4
2
3
4
3
7
Masse atomiche sperimentali variabili se presenti neutroni:
elementi anche diversi (diverso numero di protoni)
possono presentare masse uguali…
interpretazione
• Ogni elemento possiede atomi con
numero di protoni costante ma con
possibile aggiunta di neutroni (di massa
simile ai protoni):
• Quindi un elemento chimico può avere
masse diverse nei diversi atomi:isotopi
• La massa determinata sperimentalmente
si riferisce in genere alla massa media
ponderata(che considera le % dei singoli isotopi)
degli atomi dell’elemento presenti nella
miscela naturale
protoni
neutroni
Cloro = miscela
elettroni
17
18
17
Massa 35 % 0.75
17
20
17
Massa 37 % 0.25
Massa media = (34.969 * 0.75 + 33.996*0.25)=26.22+9.24 = 35.45
Nota:le masse vanno assegnate secondo u.m.a.
1
1
prozio
1
deuterio
Media= 1+1+1/3 = 1
trizio
Media =1+2+3/3=2
1
2
1
%99.98
2
% 0.01
3
3
tracce
Media ponderata
massa=1.0078
prozio
Massa 1 % 99.98
deuterio
Massa 2 % 0.01
Massa media idrogeno = 1.0078
trizio
Massa 3 % tracce
Isotopi periodicità proprietà
Ordinando gli elementi chimici secondo
massa atomica crescente si osserva una
ricomparsa abbastanza regolare di proprietà
simili in elementi con masse
diverse:tuttavia in alcuni casi tale regolarità
viene compromessa:può essere riottenuta
ordinando gli elementi secondo il numero
atomico crescente.Perchè ?
Massa atomica crescente e proprietà chimiche simili ricompaiono periodicamente
In teoria
Massa atomica crescente e proprietà chimiche con anomalie di posizione
In pratica
Atomo verde con massa >> atomo azzurro ma con proprietà più simili a giallo:
risulta fuori posto nella serie ( e così per altri elementi)
Elementi ordinati secondo massa atomica crescente: anomalia
Elementi ordinati secondo numero atomico crescente: scomparsa anomalia
In pratica
Atomo verde con massa >> atomo azzurro ma con proprietà più simili a giallo:
risulta fuori posto nella serie ( e così per altri elementi)
Elementi ordinati secondo massa atomica crescente: anomalia In teoria
47,47
48,48
49,49
40,40
42,42
41,41
43,43
47,47
49,49
48,50
In pratica:si presenta anomalia
se ordinati secondo massa crescente
Si rinormalizza ordinando secondo
numero atomico crescente
47,47
49,49
48,50
Conclusione:la periodicità nella comparsa delle
proprietà dipende dal numero atomico
Isotopi e fenomeni radioattivi
Il rapporto tra protoni e neutroni presenta
dei valori ottimali per la stabilità dei nuclei:
in certi elementi tale rapporto modificato
in alcuni loro isotopi può essere causa
di un comportamento di decadimento
radioattivo con tendenza a ritrovare un
valore di maggiore stabilità
decadimento alfa,beta,gamma,K
applicazioni varie in medicina, industria,
datazione reperti geologici ecc.