Diametro del nucleo: 10–15 m
Diametro dell’atomo: 10–9-10–10 m
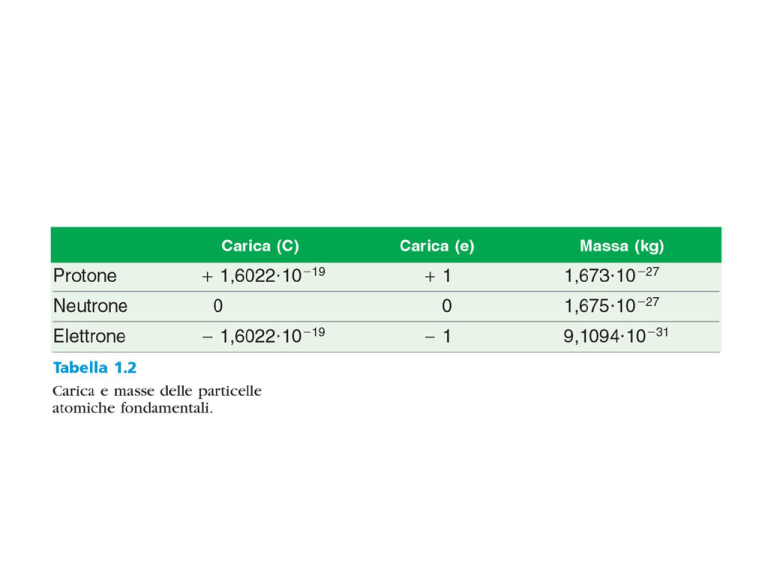
Thomson (Premio Nobel per
la Fisica nel 1907) scopre
l’elettrone nel 1897
The nuclear atom
Rutherford (Premio Nobel per
la Chimica nel 1908) scopre il
protone nel 1919
Chadwick (Premio Nobel
per la Fisica nel 1935)
scopre il neutrone nel 1932
• In un atomo neutro il numero dei protoni è uguale al numero degli elettroni
• Il numero atomico (Z) è uguale al numero dei protoni presenti nel nucleo
• Il numero di massa (A) è uguale alla somma del numero dei protoni e dei neutroni
• Il numero di neutroni (N) è uguale a A Z
• Due o più atomi con lo stesso numero atomico ma differente numero di massa si
dicono isotopi
protoni+neutroni (numero di massa)
protoni (numero atomico)
12
C
6
A
X
Z
13
C
6
simbolo dell'elemento
Esercizio
Quali dei seguenti atomi rappresenta un atomo di Na?
E uno ione Ca2+?
E uno ione F?
•
Un atomo che ha perso o acquistato un elettrone viene detto ione ed ha una
carica elettrica
•
Quando un atomo si trasforma in uno ione il numero dei protoni resta
costante , mentre diminuisce (ione positivo o catione) o aumenta (ione
negativo o anione) quello degli elettroni
23
+
Na
11
Ione positivo (catione)
35
Cl
17
Ione negativo (anione)
Esercizio
Completare la tabella [suggerimento: non tutte le righe possono essere
completate].
Nome
Simbolo
n° protoni
n° elettroni
n° neutroni
Numero di massa
Sodio
23Na
11
11
12
23
Silicio
14
37
85
40K
33
42
20Ne2+
80
126
•
La percentuale presente in natura dei diversi isotopi di un atomo si dice
abbondanza percentuale naturale e si determina con uno strumento chiamato
spettrometro di massa
12
C=98.89%
6
13
C=1.11%
6
Approfondimento
• Nello spettrometro di massa un atomo viene trasformato attraverso collisioni con un gas o
con degli elettroni in ioni positivi (in questo Hg diventa Hg+)
• Attraverso dei campi elettrici e magnetici gli ioni vengono separati e indirizzati su un
rivelatore (per es., una lastra fotografica)
• In questo modo è possibile stabilire quali isotopi naturali esistono e, dall’intensità relativa
sulla lastra, che dipende dal numero degli ioni Hg+) qual è la loro abbondanza relativa
196Hg
(0.146%)
198Hg (10.02%)
199Hg (16.84%)
200Hg (23.13%)
201Hg (13.22%)
202Hg (29.80%)
204Hg (6.85%)
•
Non è possibile determinare la massa di un singolo atomo semplicemente
sommando la massa delle sue particelle fondamentali
•
La scala delle masse atomiche è una scala di masse atomiche relative (o pesi
atomici relativi)
•
All’isotopo di carbonio con numero di massa 12 (12C) è stata assegnata per
convenzione la massa atomica 12.0000
•
L’unità di massa atomica (u.m.a. o u o Dalton) è esattamente 1/12 della massa
dell’isotopo di carbonio 12C
12
C=98.89%
6
12
C=12.0000
6
u
13
C=1.11%
6
13
C=13.0034
6
u
Massa atomica (media) del carbonio naturale =
(98.89/100) × 12.0000 u + (1.11/100) × 13.0034 u = 12.011 u
Esercizi
• I due isotopi naturali del litio, 6Li e 7Li, hanno masse di 6.01512 u e 7.01600 u.
Quale di questi due isotopi è il più abbondante?
• I due isotopi naturali del boro, 10B e 11B, hanno masse di 10.0129370 u e
11.0093054 u. Quale di questi due isotopi è il più abbondante?
• Le masse e le abbondanze naturali dei tre isotopi del silicio sono: 28Si
(27.976926 u, 92.22%); 29Si (28.976495 u, 4.69%); 30Si (29.973377 u, 3.09%).
Calcolare la massa atomica media del silicio.
• Il bromo ha due isotopi naturali. Il 79Br ha massa pari a 78.9183 u e abbondanza
naturale dello 50.69%. Qual è la massa e l’abbondanza naturale dell’altro
isotopo, il 81Br?
Approfondimento
Nella formazione dei nuclei vi è un difetto di massa, cioè la massa sperimentale è
inferiore rispetto alla somma delle masse di protoni e neutroni
La massa perduta (m) è proporzionale all’energia liberata (E) secondo l’equazione
E = mc2
Per esempio, la massa del nucleo di He
è inferiore di 0.03035 u rispetto alla
somma delle masse di due protoni e
due neutroni
L’energia equivalente a tale massa
secondo la reazione di Einstein, E =
mc2, è quella che tiene assieme le
particelle del nucleo (energia di legame
nucleare)
Particella o nuclide
Massa (u)
e (elettrone)
0.0005486
n (neutrone)
1.00866
p (protone)
1.00728
Alla massa di un atomo contribuiscono essenzialmente i protoni
e i neutroni
Esercizio
•
Determinare la massa molecolare (in u) dell’anidride solforosa (SO3), del
glucosio (C6H12O6) e del carbonato di sodio (Na2CO3)












