Ministero dell’Istruzione, dell’Università e della Ricerca
Istituto di Istruzione Superiore “MARTIN LUTHER KING”
via Allende, 3 – 20835 Muggiò (MB)
telefono: 039 2789430 – fax: 039 2789432 – Codice Fiscale: 94517460153
Indirizzi: Relazioni Internazionali per il Marketing – Turismo – Liceo Linguistico
E-mail: [email protected] – Posta Certificata: [email protected] – Sito: www.mlkmuggio.gov.it
Codici Meccanografici: MIIS08400Q – MITD084012 – MIPS084016
ANNO SCOLASTICO 2015 / 2016
CLASSE 2
SEZIONE G
PROGRAMMA SVOLTO di Scienze Integrate CHIMICA
Prof. CAPPUCCILLI Maria
Libro di testo in adozione: Chimica dappertutto. Terza edizione di Conoscere la materia.
Chimica
Autori: Franco Bagatti, Elis Corradi, Alessandro Desco, Claudia Ropa
Editore: Zanichelli
Programma svolto:
Materia: teoria atomica della materia; stati di aggregazione della materia; passaggi di
stato della materia; definizione di sistema e ambiente; miscugli omogenei ed eterogenei;
metodi di separazione dei miscugli.
Sostanze: classificazione in elementi e composti; introduzione storica al linguaggio della
chimica e dei simboli degli elementi chimici.
Razioni chimiche: legge di Lavoisier; definizione di reagenti e prodotti; trasformazioni
chimiche e fisiche; reazioni endotermiche ed esotermiche; legge di Proust; legge di Dalton;
bilanciamento delle equazioni chimiche.
Gas: proprietà dei gas; modello particellare per i gas; legge generale dei gas; legge di
Boyle; legge di Charles; legge di Gay-Lussac; legge del gas ideale;
Molecole: legge di Avogadro; massa degli atomi; peso atomico; calcolo delle massi
molecolari; concetto di mole; numero di Avogadro; massa molare; volume molare.
Soluzioni: definizione; percentuale in massa; percentuale in volume; molarità.
Struttura dell’atomo: lettura su cariche elettriche; filmato su legge di Coulomb; particelle
subatomiche: elettroni, protoni, neutroni; modello atomico di Rutheford; modello atomico
nucleare; isotopi; radioattività; decadimento radioattivo; energia di ionizzazione; livelli
energetici; struttura elettronica e sua rappresentazione; transizioni elettroniche.
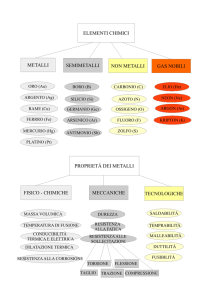
Tavola periodica: come si legge la tavola periodica; periodi; gruppi; elementi naturali e
artificiali; metalli; non metalli; semimetalli; famiglie chimiche e proprietà: metalli alcalini,
metalli alcalino-terrosi, metalli di transizione, alogeni, gas nobili, lantanidi e attinidi.
Pag. 1 a 2
Ministero dell’Istruzione, dell’Università e della Ricerca
Istituto di Istruzione Superiore “MARTIN LUTHER KING”
via Allende, 3 – 20835 Muggiò (MB)
telefono: 039 2789430 – fax: 039 2789432 – Codice Fiscale: 94517460153
Indirizzi: Relazioni Internazionali per il Marketing – Turismo – Liceo Linguistico
E-mail: [email protected] – Posta Certificata: [email protected] – Sito: www.mlkmuggio.gov.it
Codici Meccanografici: MIIS08400Q – MITD084012 – MIPS084016
Formule chimiche: numero di ossidazione; regole per assegnare numero di ossidazione;
elementi e classi di composti; nomenclatura tradizionale; nomenclatura IUPAC; formule e
nomi dei composti binari con l’ossigeno; formule e nomi dei composti binari con l’idrogeno;
formule e nomi degli idrossidi e degli ossiacidi; formule e nomi dei sali.
Legami chimici: elettroni di legame e proprietà chimiche; simboli di Lewis; regola
dell’ottetto; legame ionico; legame covalente; doppi legami e tripli legami; elettronegatività;
modello di legame per i metalli; lavorabilità delle sostanze metalliche; conducibilità elettrica
delle sostanze metalliche; molecole polari e apolari; miscibiltà delle sostanze polari e
apolari (il simile scioglie il simile); legami e proprietà.
Ricerche: ogni allievo ha svolto una ricerca su un elemento chimico della tavola periodica
indicando il gruppo , il periodo, la formula di Lewis, le sue proprietà, come è stato scoperto
e il suo impiego.
I Rappresentanti di Classe
Alessia Cammarano
Valeria Vita
Il Docente
Maria Cappuccilli
Pag. 2 a 2