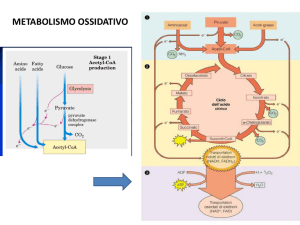
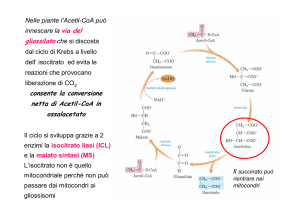
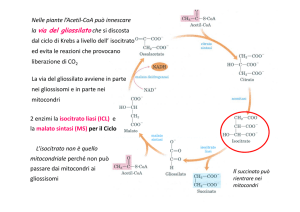
CICLO DEI PENTOSI
Molti i nomi alternativi…
Via dei pentosi fosfati
Via del Fosfogluconato
Shunt dei pentosi
Shunt dell’esosomonofosfato
Ciclo di Horecker
Via del catabolismo di G6-P alternativa alla glicolisi, dove si ha
ossidazione del glucosio senza produzione di ATP; quindi il ciclo dei
pentosi non ha funzione energetica. La sua funzione è quella di
rappresentare la principale via di formazione dei pentosi fosfati
necessari alla sintesi di DNA e RNA. Altra importante funzione è
quella di fornire NADPH, potere riducente usato per le biosintesi
riduttive.
Avviene nel citosol di tutte le cellule.
Questa via si dirama dalla glicolisi a livello del G6-P ed è perciò anche
nota come shunt dell’esoso monofosfato; il termine shunt,
letteralmente “deviazione”, è usato perché nel caso la cellula non
necessiti di pentosi per le biosintesi, i suoi intermedi sono
trasformati in fruttosio-6-P e gliceraldeide-3-P e ricondotti nel flusso
principale della glicolisi.
Funzioni della via del pentoso fosfato
1. Principale produzione di NADPH, potere riducente per le
biosintesi riduttive di acidi grassi, steroidi e sali biliari. Inoltre
il NADPH è il substrato di glutatione reduttasi, enzima che è in
grado di rigenerare glutatione ridotto che funge da
antiossidante, specialmente negli eritrociti dove scherma
l’ossidazione del Fe2+ a Fe3+.
2. Produzione di pentosi tra cui riboso-5-P utilizzato per la sintesi
di nucleotidi e acidi nucleici
3. Degradazione ossidativa dei pentosi (di origine alimentare) in
esosi che entrano nella glicolisi o nella gluconeogenesi
Nei globuli rossi la via del pentoso fosfato è l’unica fonte di NADPH che
serve per mantenere Fe2+ ed impedire l’ossidazione dei doppi legami
dei lipidi di membrana.
Chi usa la via del pentoso fosfato…
Circa la metà del glucosio mobilizzato nel fegato entra nella via
del pentoso fosfato. E’ una via metabolica importante nei
tessuti in grado di effettuare biosintesi riduttive, utilizzando
NADPH, ovvero:
Tessuto adiposo (molto attivo ciclo dei pentosi per avere
NADPH usato nella biosintesi riduttiva degli acidi grassi)
Fegato
Invece nel Muscolo è
Rene
pressochè
assente
mentre
Eritrociti
dominante glicolisi perché
Ghiandola mammaria
prevalgono
processi
Corteccia surrenale
energetici (contrazione).
Tiroide
Testicoli
Tessuto nervoso (oligodendrociti)
NADP+
NADPH
Glucosio-6-P
Gluconolattone
G-6-P
Deidrogenasi
Lattonasi
Transaldolasi, Transchetolasi e zuccheri a
3, 5 e 7 C
6-Fosfogluconato
NADP+
6-fosfogluconato
Deidrogenasi
Biosintesi acidi
nucleici
NADPH
Ribosio-5-P
Ribulosio-5-P
Isomerasi
Questa via metabolica può essere suddivisa in 2
fasi:
La prima, detta OSSIDATIVA, è costituita da reazioni
irreversibili e in essa il glucosio-6-P viene ossidato in
pentoso fosfato. Fornisce NADPH e FOSFOPENTOSI
La seconda, detta “DELLE INTERCONVERSIONI”, è
costituita da reazioni reversibili e trasforma un certo
numero di carboidrati tra loro, attraverso reazioni di
isomerizzazione. In essa i fosfopentosi in eccesso sono
trasformati in intermedi della glicolisi e si ha la
risintesi del glucosio-6-P in pentoso fosfato.
La via dei
Fosfopentosi (fase
redox)
La via dei Fosfopentosi
(fase delle
interconversioni)
Prima fase : Ossidativa
Ossidazione del glucosio-6-P. Per
azione della glucosio-6-P-deidrogenasi
il glucosio-6-P viene ossidato in 6fosfogluconolattone
(estere
intramolecolare
fra
il
gruppo
carbossilico in C-1 e il gruppo
ossidrilico in C-5) con la concomitante
riduzione di una equivalente quantità
di NADP+ a NADPH + H+.
In questa deidrogenazione vengono
eliminati 2 H+ dal C1 del G-6-P e
trasferiti al NADP +, con formazione di
doppio legame C=O sul C1 del 6fosfogluconolattone e di NADPH + H+.
L'attività
della
glucosio-6-P
deidrogenasi è regolata dal
rapporto NADPH+(H+)/NADP+ (più
questo è elevato, cioè più NADPH
c’è, e più l'enzima è inibito) e dagli
acidi grassi liberi (un eccesso dei
quali ha azione inibitrice). In
particolare,
la
glucosio-6-P
deidrogenasi
è
soggetta
a
inibizione allosterica da parte del
NADPH, e quindi in virtù di questo
semplice
meccanismo,
la
produzione di NADPH nel ciclo è
autolimitante. Questa reazione
limita la velocità del ciclo.
Formazione del 6-fosfogluconato. La
idrolisi del 6-fosfogluconolattone in 6fosfogluconato è catalizzata dalla 6fosfogluconato lattonasi: la stessa idrolisi
può avvenire anche spontaneamente ma
con molta maggiore lentezza. In questa
reazione di idrolisi, grazie all’entrata di
una molecola di H2O, l’OH dell’ H2O si va
a legare sul C1 ( e poi l’H+ se ne va),
mentre l’altro H dell’ H2O va a legarsi
sull’Ossigeno del C5. Questa reazione è
irreversibile, quindi nonostante la
reversibilità della reazione precedente,
nel complesso, l’ossidazione del glucosio6-P in 6-fosfogluconolattone risulta un
processo irreversibile.
Decarbossilazione ossidativa del 6fosfogluconato. La trasformazione del 6fosfogluconato in ribulosio-5-P è un
processo di decarbossilazione ossidativa,
catalizzato
dalla
6-fosfogluconato
deidrogenasi e una seconda molecola di
NADP+ viene ridotta a NADPH + H+.
Il C1, che fa parte della molecola di CO2 se
ne va, mentre a livello del C3 se ne vanno
2 H (che ritroviamo nel NADPH + H+) con
la contemporanea formazione del doppio
legame C=O.
Al termine della FASE
OSSIDATIVA che comprende
queste prime tre reazioni, il
glucosio-6-P viene ossidato a
ribulosio-5-P mentre si
generano 2 equivalenti di
NADPH(H+).
Seconda fase : “Delle Interconversioni”
Isomerizzazione del ribulosio-5-P.
Il ribulosio-5-P viene in parte
isomerizzato in ribosio-5-P per
azione
della
fosfopentoso
isomerasi, in parte il ribulosio-5-P
viene epimerizzato in xilulosio-5-P
ad opera della fosfopentoso
epimerasi.
Il ribosio-5-P è usato per la sintesi di nucleotidi, ma
in realtà solo una piccola parte di esso viene
sottratta al ciclo per questo scopo.
In ogni caso, per la formazione di
questi due composti, la rimozione di
un protone porta alla formazione di
un intermedio, l’ENEDIOLO. La
riprotonazione forma il chetoso
xilulosio-5-P o l’aldoso ribosio 5-P.
E’ implicito che se in un determinato momento, o in un particolare tessuto, il ribulosio5-P venisse impiegato solo per la sintesi dei nucleotidi, verrebbe trasformato
completamente in ribosio-5-P e l'ulteriore processo di interconversione, mediante
Transchetolasi e Transaldoasi, non avrebbe luogo. Viceversa se il tessuto non
richiedesse sintesi di nucleotidi, ma solo di equivalenti riducenti [NADPH(H+)], allora i
pentosi fostati verrebbero riciclati completamente nel processo seguente.
Le seguenti reazioni di Transchetolasi e Transaldoasi implicano un "rimescolamento"
degli atomi di C dei pentosi fosfati, che vengono così trasformati in fruttosio-6-P e
gliceraldeide-3-P.
Questi due enzimi creano un collegamento reversibile tra la via dei
pentosi fosfati e la glicolisi, catalizzando queste tre reazioni:
Transchetolasi
C5 + C5
C3 + C 7
Transaldolasi
C7 + C 3
C4 + C6
Transchetolasi
C5 + C 4
C3 + C6
La TRANSCHETOLASI trasferisce una unità a
due atomi di carbonio
La TRANSALDOLASI trasferisce una unità a
tre atomi di carbonio
Lo zucchero che dona le unità bi- o tri-carboniose è
sempre un CHETOSO, mentre l’accettore è sempre un
ALDOSO.
H2C—OH
Unità trasferita dalla
transchetolasi
C=O
Unità trasferita dalla transaldolasi
H2C—OH
C=O
HO—C—H
CHETOSO
ALDOSO
Ia Transchetolazione. Questa reazione, è
catalizzata
dalla
transchetolasi,
enzima
difosfotiamina (TPP) dipendente. In generale, la
reazione consiste nel trasporto di un frammento a
2 atomi di carbonio (chetolo) da un chetoso,
fosforilato sull'ultimo atomo di C ad un aldoso,
pure fosforilato, con formazione di una nuova
coppia di chetoso ed aldoso fosforilati, suscettibili
di transchetolazione. In particolare, in questa di
transchetolazione, si ha il trasferimento di due
atomi di carbonio dallo xilulosio-5-P (C5) al ribosio5-P (C5), formando sedoeptulosio-7-P (C7)ed
gliceraldeide-3-fosfato (C3). L’enzima richiede che
il chetoso abbia configurazione sterica sull’OH del
C3 come quella del fruttosio.
Transchetolasi
C5 + C 5
C3 + C7
Meccanismo
d’azione della
transchetolasi,
dove si
evidenzia il
ruolo
essenziale
della Tiamina
Pirofosfato
(TPP).
E’ mostrato
solo l’anello
tiazolico della
TPP.
Transaldolazione. Questa reazione è catalizzata
dalla Transaldolasi ed è caratterizzata dal
trasferimento di un frammento a 3 C
(diossiacetone) da un chetoso fosforilato
sull'ultimo atomo di carbonio e con la stessa
configurazione
sterica
vista
per
le
transchetolazione, ad un aldoso pure fosforilato.
In particolare, in questa di transaldolazione, si ha
il trasferimento di tre atomi di carbonio dal
sedoeptulosio-7-P (C7) alla gliceraldeide-3fosfato (C3), formando eritrosio-4-P (C4) e
fruttosio-6-P (C6). L’enzima richiede che il
chetoso abbia configurazione sterica sull’OH del
C3 come quella del fruttosio.
Transaldolasi
C7 + C 3
C4 + C 6
Meccanismo d’azione della transaldolasi
IIa Transchetolazione. Ancora
per azione della transchetolasi
un chetolo, cioè un frammento a
due atomi di carbonio viene
trasferito da una seconda
molecola di xilulosio-5-P (C5)
sull'eritrosio-4-P (C4), formando
gliceraldeide-3-P (C3) e fruttosio6-P (C6).
Transchetolasi
C5 + C 4
C3 + C6
Riepilogo della IIa
fase
Questa
fase
“delle
interconversioni”
è
controllata dalla disponibilità
dei substrati.
In totale: 2 xilulosio-5-P + 1
ribosio-5-P↔2 fruttosio-6-P
+ 1 gliceraldeide-3-P
Considerando
quindi
i
prodotti di partenza e di
arrivo del ciclo dei pentosi
fosfati, il G-6-P viene per
gran parte trasformato in F6-P (da qui il nome di shunt
dell’esoso-fosfato,
perché
alternativo alla glicolisi).
Relazione tra la glicolisi e la via dei pentosi fosfati
L’eccesso di Ribosio-5-P
viene convertito in
intermedi glicolitici
Bilancio e regolazione
Reazione totale:
G6-P + 12NADP+ → 6CO2 + 12NADPH + 12H+ + Pi
Potere riducente funzione primaria
In adipociti 60% del glucosio viene utilizzato
Flusso metabolico varia secondo necessità del momento
Disponibilità di NAD e NADP che regola
Glucosio-6PDH aumenta da aumentata ingestione di glucidi, inibita da
aumento rapporto NADPH/NADP, stimolata da Glutatione ossidatoAnossia aumenta via dei pentosi
Il metabolismo del glucosio-6-P fra glicolisi e ciclo dei pentosi
Il glucosio-6-fosfato viene metabolizzato sia attraverso la glicolisi che il ciclo dei
pentosi fosfato; dipende dalla concentrazione citoplasmatica di NADP+, Ribosio-5-P e
ATP
Metabolismo del G-6-P in quattro diverse situazioni:
(1) Richiesta maggiore di ribosio-5-P rispetto al NADPH:
es. cellule in rapida divisione che necessitano di R-5-P per sintesi nucleici
5 glucosio-6-P + ATP → 6 ribosio-5-P + ADP + H+
(2) Le necessità di NADPH e ribosio-5-P sono bilanciate:
glucosio-6-P + 2 NADP+ + H2O → ribosio-5-P + 2 NADPH + 2H+ + CO2
(3) Richiesto più NADPH che ribosio-5-P:
es. il tessuto adiposo per produrre acidi grassi
glucosio-6-P + 12 NADP+ + 7 H2O → 6 CO2 + 12 NADPH + 12 H+ + Pi
(4) Sono richiesti NADPH e ATP:
3 glucosio-6-P + 6 NADP+ + 5 NAD+ + 5Pi + 8 ADP → 5 piruvato + 3 CO2 + 6 NADPH + 5
NADH + 8 ATP + 2 H2O + 8 H+
Bilancio e regolazione del ciclo dei pentosi fostati
La trasformazione di 6 molecole di glucosio-6-P nel ciclo dei
pentosi fosfati implica il seguente bilancio:
1) 6 glucosio-6-P + 12 NADP+ + 6 H2O → 4 fruttosio-6-P + 2
aldeide 3-P-glicerica + 6 CO2 + 12 NADPH(H+)
Considerando che il fruttosio-6-P è in equilibrio con il glucosio-6P e che 2 molecole di aldeide 3-P-glicerica possono formare 1
molecola di fruttosio-6-P e quindi di glucosio-6-P
(gluconeogenesi), la precedente reazione è omologabile alla
seguente:
2) 6 glucosio-6-P + 12 NADP+ + 7 H20 → 5 glucosio-6-P + 6 CO2 +
12 NADPH(H+) + Pi
Sopprimendo i termini comuni si ottiene:
3) glucosio-6-P + 12 NADP+ + 7 H2O → 6 CO2 + 12 NADPH(H+) + Pi
Trascurando i metaboliti intermedi, suscettibili di utilizzazione
metabolica particolare, nei ciclo dei pentosi fosfati 1 mole di
glucosio-6-P viene dunque ossidata in 6 moli di CO2 con
concomitante riduzione di 12 moli di NADP+ in NADPH(H+). E’
proprio la produzione del “potere riducente” in forma di
NADPH(H+) la funzione primaria del ciclo. Il NADPH(H+) è
necessario per sostenere gran parte dei processi di biosintesi
riduttiva (es. sintesi degli acidi grassi, sintesi del colesterolo,
sintesi dell'acido tetraidrofolico, etc.).
Infatti, come si è detto, il ciclo dei pentosi fosfati è
particolarmente attivo nei tessuti lipogenici (ghiandola
mammaria funzionante, ghiandola cortico-surrenale, tessuto
adiposo), caratterizzati da un rimarchevole ritmo dì sintesi degli
acidi grassi o degli steroidi.
Nel tessuto adiposo, ad esempio, il 60% del glucosio viene
metabolizzato nel ciclo dei pentosi fosfati, mentre nel muscolo
scheletrico, nel quale predomina la glicolisi, il flusso metabolico nel
ciclo dei pentosi fosfati è pressoché irrilevante.
Il flusso metabolico del glucosio nella glicolisi o nel ciclo dei
pentosi fosfati varia in funzione delle necessità metaboliche del
momento.
Quando c'è maggior bisogno di energia si accentua il metabolismo
del glucosio nella glicolisi e nel ciclo di Krebs, quando c'è maggior
necessità di biosintetizzare nuove molecole si accentua
l'immissione del glucosio nel ciclo dei pentosi fosfati. E’ la
disponibilità nel citoplasma di NAD+ e rispettivamente di NADP+
che stimola il flusso del glucosio-6-P nella glicolisi e,
rispettivamente, nel ciclo dei pentosi fosfati.
E’ infatti l'attività della glucosio-6-P deidrogenasi che impone il
ritmo all'intera via dei pentosi fosfati.
L'attività di questo enzima, che aumenta considerevolmente in
seguito ad aumentata ingestione di glucidi con la dieta, viene
inibita da un aumentato rapporto NADPH(H+)/NADP+ e
specificamente disinibita dal glutatione ossidato.
Nell'ambito dello stesso tessuto l'utilizzazione del glucosio nel
ciclo dei pentosi fosfati viene accentuata da uno stato di
anossia. La mancanza di ossigeno impedisce l'utilizzazione
ossidativa del piruvato e secondariamente induce un accumulo
degli intermedi glicolitici. Il glucosio-6-P viene così forzato nella
via dei pentoso-fosfati e l'accumulo conseguente di NADPH(H+)
accentua la biosintesi degli acidi grassi. Si spiegherebbe così,
almeno in parte, la steatosi che si verifica nei tessuti anossici.
Altra funzione del ciclo dei pentosi fosfati è la produzione dei
pentosi fosfati necessari per la sintesi dei nucleotidi, degli acidi
nucleici e di numerosi coenzimi. A questo riguardo va osservato
che la formazione di ribosio-5-P, precursore di tutti i nucteotidi,
può attuarsi, utilizzando intermedi della glicolisi, attraverso
semplici reazioni di transchetolazione e isomerizzazione
(xilulosio-5-P → ribulosio-5-P → ribosio-5-P). In questo modo il
flusso biosintetico dei nucleotidi può decorrere anche
indipendentemente dalla riossidazione del NADPH(H+).
Deficienza eritrocitaria della glucoso-6-P deìdrogenasi
Negli eritrociti umani si sono finora individuate più di 50 varianti
genetiche della glucosio-6-P deidrogenasi (l’enzima che catalizza la
prima reazione della fase ossidativa), ciascuna risultante da una
mutazione genica che causa la sintesi di un enzima con struttura
primaria non ortodossa. Nei casi più noti tale anomalia risulta dalla
sostituzione di un amminoacido con un altro. La variante più diffusa,
specie in alcune regioni dei Mediterraneo, è quella nota come
FAVISMO, in quanto i globuli rossi degli individui che ne sono affetti
vanno incontro ad estesa emolisi dopo ingestione di fave o di farmaci
antimalarici (es. promachina, aceitilfenilidirazone). Si tratta di un
difetto dell'attività della glucosio-6-P deidrogenasi eritrocitaria
derivante da un aumentato ritmo di degradazione dell'enzima. Si è
constatato infatti che la vita media dell'enzima geneticamente alterato
è di 14 giorni contro i 60 dell'enzima normale.
Inoltre nel favismo la G-6-P deidrogenasi presenta una minore
affinità per il NADP+ rispetto alla deidrogenasi dei normali.
Nella deficienza di glucosio-6-P deidrogenasi la diminuita
produzione
di
NADPH(H+)
facilita
la
trasformazione
dell'emoglobina (Fe2+) in metaemoglobina (Fe3+) e si traduce in una
deficienza di glutatione ridotto (G-SH). Il G-SH si forma infatti a
spese del NADPH(H+) nella seguente reazione catalizzata dalla
glutatione riduttasi:
NADPH(H+) + GS-SG → NADP+ + 2 G-SH
Una deficienza di G-SH consente ai processi perossidativi una più
intensa azione deleteria, per cui i costituenti dei globulo rosso e la
stessa membrana eritrocitaria si alterano, provocando lisi della
cellula. Gli agenti antimalarici e le fave scatenano la crisi emolitica
in quanto concorrono ad ossidare il già scarso G-SH, aggravandone
drammaticamente la deficienza.
La deficienza ereditaria della G-6-P deidrogenasi si riscontra
frequentemente nelle popolazioni esposte da secoli alla malaria.
Poiché l'agente della malaria richiede per la sua crescita ottimale
glutatione ridotto e prodotti del ciclo dei pentosi, la deficienza
della G-6-P deidrogenasi e quindi di G-SH parrebbe costituire un
adattamento di difesa contro il parassita, e quindi contro
l’insorgenza della malaria.
Nella deficienza di G-6-P deidrogenasi gli eritrociti sono le uniche
cellule colpite; mancano infatti del ciclo di Krebs e dei mitocondri e
l'unico processo ossidativo è in essi la prima fase del ciclo dei
pentosi fosfati.
Il Glutatione
Il glutatione è un tripeptide (γ-glutamil-cisteinil-glicina), presente nella
cellula in forma ridotta tiolica, ed è un coenzima essenziale per la
protezione della cellula contro il danno ossidativo.
La forma ridotta del glutatione (GSH), un tripeptide con un gruppo
sulfidrilico libero, ha la funzione di tampone sulfidrilico per mantenere i
residui di cisteina dell’emoglobina (Hb) e delle altre proteine allo stato
ridotto. In condizioni normali, quando le proteine sono esposte
all’ossigeno, i loro gruppi SH liberi vengono gradualmente ossidati a
formare ponti disolfuro intramolecolari o con altre proteine; in particolare
nei globuli rossi, il glutatione ridotto mantiene i gruppi SH dell’Hb allo
stato ridotto, inibendo la formazione di legami crociati nella proteina
stessa.
La forma ridotta del glutatione partecipa anche ad alcune reazioni di
detossificazione dell’acqua ossigenata (perossido d’idrogeno) e di altri
perossidi organici nel citosol e nelle membrane cellulari.
Il Glutatione
Attività antiossidanti del Glutatione
Meccanismo d’azione del glutatione negli eritrociti
Il glutatione è mantenuto allo stato ridotto GSH, dall’enzima glutatione reduttasi che nei
globuli rossi utilizza il NADPH formato dal ciclo dei pentosi.
Durante la sua funzione come coenzima antiossidante, il GSH è ossidato alla forma
disolfuro GSSG, ed è poi rigenerato dall’azione della glutatione reduttasi.
Meta Hb
NADPH
FAD
2 GSH
Fe 3+
NADP+
FADH2
GSSG
Fe 2+
Glutatione
Metaemoglobina reduttasi
Hb
reduttasi
Via dei
pentosi
Durante la rigenerazione del GSH, gli elettroni non
sono trasferiti dal NADPH direttamente al ponte
disolfuro del GSSG, ma sono invece trasferiti prima
dal NADPH al FAD, poi al ponte disolfuro e infine
al glutatione ossidato.
Meta Hb
NADPH
FAD
2 GSH
Fe 3+
NADP+
FADH2
GSSG
Fe 2+
Glutatione
Metaemoglobina reduttasi
Hb
reduttasi
Le monoossigenasi catalizzano reazioni ove solamente
uno dei due atomi della molecola di ossigeno viene
incorporato nel substrato; l’altro e’ ridotto ad acqua.
Questi enzimi vengono spesso chiamati idrossilasi (per
evidenziare il fatto che il substrato principale viene in
genere ossidrilato) oppure ossigenasi a funzione mista,
per indicare che ossidano contemporaneamente due
substrati diversi. Il termine ossidasi a funzione mista che
spesso viene usato e’ improprio: nelle ossidasi
propriamente dette l’ossigeno molecolare e’ l’accettore
di elettroni, ma gli atomi di ossigeno non compaiono nei
prodotti ossidati.
Una tipica reazione catalizzata dal citocromo P450 può essere così
schematizzata:
RH + O2 + 2H+ + 2e-
ROH + H2O
Come donatore di elettroni il citocromo P450 può utilizzare
indifferentemente NADH o NADPH; i due elettroni devono essere
trasferiti al citocromo attraverso una proteina trasportatrice (nel
caso dei citocromi microsomiali di una flavoproteina).