IL PLATINO
Introduzione
• Il platino è uno dei metalli più preziosi al mondo a causa
della sua scarsa reperibilità. Solo poche zone ne hanno
rivelato giacimenti; attualmente i più ricchi si trovano in
Sudafrica, da dove proviene circa l'85 per cento della
produzione globale, sono significative anche le riserve
dell'Unione Sovietica, del Canada, del Sud America.
• Sebbene resti un elemento insostituibile in molti impieghi
di natura scientifica e tecnologica, la purezza e
l'incredibile duttilità fanno del platino il metallo ideale per
la realizzazione di gioielli. Il contenuto di metallo puro,
nella lega usata in gioielleria, è del 95% e da un solo
grammo di platino si può ricavare un filo sottilissimo
lungo due chilometri. Il platino è perfettamente
compatibile con ogni tipo di pelle, immune da alterazioni
e da usura.
Generalità 1
• Probabilmente già usato da vari popoli fin da tempi
remoti, nelle sue leghe naturali (con oro, argento e
gli altri metalli della famiglia del platino)
considerate una varietà di argento, fu individuato
da A. de Ulloa, nel 1735, in depositi alluvionali
della Colombia; come elemento chimico venne
definito, però, solo all'inizio del sec. XIX. In natura
il platino è un elemento molto scarso, e nella
crosta terrestre gli si attribuisce un'abbondanza
relativa del 5·10-7%. Il minerale del platino più
importante è il platino nativo, in realtà costituito da
leghe più o meno ricche di platino con gli altri
elementi della sua famiglia (palladio, rodio,
rutenio, iridio, osmio).
Generalità 2
• Il platino nativo è il minerale dei giacimenti
alluvionali della Colombia, sfruttati fino al 1820,
di quelli del distretto di Perm, negli Urali (Russia)
e dell'Alaska; associato con altri elementi,
soprattutto rame, nichel e quelli della sua
famiglia, lo si rinviene in filoni negli Stati Uniti,
Sudafrica, America Meridionale, Giappone e
Canada: in quest'ultimo Paese lo si estrae
anche da un arseniuro, la sperrilite (PtAs2);
piccole quantità di platino si rinvengono anche in
alcuni minerali solforati.
Sperrilite
Uno splendido campione di sperrilite, arseniuro di
platino. La composizione della sperrilite è PtAs2
Sperrilite
Platino nativo proveniente dall'Alaska
Braggite
Cenni storici 1
• La storia del platino, il cosiddetto “nuovo metallo”, è
molto più antica di quello che ci si potrebbe aspettare; le
antiche civiltà sud americane (100 a.C.), tra cui i famosi
Incas, utilizzavano sia il platino che l'oro per creare anelli
da naso e altri gioielli cerimoniali. Tuttavia questa
testimonianza rimarrà assolutamente isolata nella storia
del platino, sia da un punto di vista temporale sia da un
punto di vista geografico.
• Successivamente il platino sparì per due millenni dalla
storia dell'umanità, dimenticato per centinaia d'anni, per
riapparire quando gli esploratori europei partirono alla
scoperta del nuovo mondo.
Cenni storici 2
• Fu rinvenuto nel 1735 nelle sabbie aurifere ad opera dei
Conquistadores spagnoli che da subito lo disprezzarono
definendolo “platina” ovvero “argento minore, di scarto”
(da “plata”, termine spagnolo che indica, appunto,
l'argento).
• Dopo queste apparizioni il più prezioso dei metalli è stato
ignorato per lunghissimo tempo almeno fino alla metà
del Settecento quando in Europa arrivarono i primi
campioni del “nuovo” metallo. Fin dall’inizio mercanti
poco onesti iniziarono ad usarlo per adulterare l'oro (lo
sconosciuto materiale pesava infatti molto di più dell'oro
e, a quell' epoca, era molto meno costoso), ed il governo
spagnolo ne vietò l'uso e iniziò a requisirlo nei luoghi
dell'estrazione per poi disperderlo nei fiumi.
Cenni storici 3
• Solo intorno alla metà del diciottesimo secolo il platino,
ad opera degli scienziati, fu oggetto di studio e di
approfondimento.
• I primi progetti si basavano sull’utilizzo del platino nelle
armi da fuoco sfruttando il suo altissimo punto di fusione
e l’inattaccabilità da parte della maggior parte degli
agenti chimici.
• Se si escludono alcuni eccezionali, ma isolati, esempi
ottocenteschi di utilizzo “artistico” del platino; la vera
scoperta delle potenzialità del platino in gioielleria risale
alle soglie del nostro secolo.
• Louis Cartier lanciò il felice abbinamento di platino e
diamanti in un settore dove la supremazia assoluta
dell'oro non era mai stata messa in discussione.
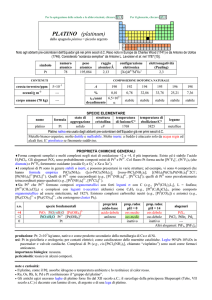
Caratteristiche chimico-fisiche 1
• E’ il metallo più importante del gruppo dei platinoidi
(PGM; Platinum Group Metals) che comprende anche
rutenio, rodio, palladio, osmio e iridio.
• Il platino, di simbolo Pt, di numero atomico 78 e di peso
atomico 195,09, è un solido bianco-grigiastro,
relativamente molle, duttile, malleabile, tenace.
• La sua densità è 21,4 g/cm3, fonde a 1.769ºC.
• È permeabile ai gas e, soprattutto se suddiviso (spugna
e nero di platino), ne assorbe in superficie notevoli
quantità, in particolare di idrogeno, con liberazione di
calore tale da diventare incandescente.
Caratteristiche chimico-fisiche 2
• Il platino non reagisce con l'ossigeno neppure a
temperatura elevata, determinando una delle
proprietà fondamentali di questo metallo ovvero
la resistenza alla corrosione; tuttavia si combina
a caldo con cloro, zolfo, fosforo, arsenico, silicio
e con i metalli a basso punto di fusione, come il
piombo e lo zinco.
• Non reagisce se attaccato da acidi tuttavia si
scioglie nell'acqua regia (miscela liquida
costituita da sostanze organiche di diversa
origine usata come solvente).
Metallurgia
• Dai giacimenti alluvionali il metallo (che non è
mai puro) è estratto direttamente mediante un
processo di arricchimento a gravità (o per
concentrazione idraulica); nel caso invece di
minerali filoniani si procede, dopo
frantumazione e macinazione, all'arricchimento
per flottazione e successivamente alla fusione
del concentrato di minerale miscelato a
carbone e fondenti per ottenere una metallina
di rame e nichel dalla quale, per via elettrolitica,
si separa una lega rame-nichel.
Il platino e gli altri metalli a esso associati (oro,
argento, palladio, rodio, iridio, ecc.) si possono
recuperare anche dai fanghi anodici residui dei
trattamenti di altri minerali, in particolare rame,
mediante trattamenti selettivi lunghi e complessi. La
metallurgia per ottenere platino puro è complicata a
causa della difficoltà di separarlo soprattutto dagli altri
metalli della sua famiglia che presentano proprietà
strettamente analoghe.
•Nel metodo Deville usato nella maggior parte dei
casi, il metallo grezzo è fuso con una quantità dieci
volte superiore di piombo; in tal modo il piombo si
lega con platino, palladio e rodio, mentre osmio, iridio
e rutenio restano inalterati e si separano per gravità
sul fondo della massa fusa da dove sono recuperati.
La lega di piombo è poi sottoposta a una fusione
ossidante che allontana la maggior parte del piombo;
il residuo è polverizzato e attaccato con acido nitrico
che discioglie il palladio e il piombo ancora presenti,
mentre resta inalterata una lega costituita soprattutto
da platino e da rodio.
•Questa si discioglie in acqua regia e si precipita poi il
platino sotto forma di cloroplatinato di ammonio
(NH4)2PtCl6; calcinando tale sale rimane come
residuo una massa spugnosa di platino metallico
ancora impuro di rodio (spugna di platino).
•Si sottopone il residuo a fusione con idrogenosolfato
di potassio, che attacca il rodio ma non il platino:
lisciviando infine la massa con acqua si ottiene come
residuo un platino tecnicamente puro, con un titolo in
genere superiore al 99,5% e che può venire
ulteriormente raffinato per via elettrolitica.
Preparazione 1
• Il platino si trova: allo stato natio, nella
sabbia mescolato con l'oro e con altri
metalli dello stesso gruppo (rodio, palladio,
osmio, iridio); e associato a ferro, nichel e
rame anche in tenori notevoli. Negli ultimi
anni la produzione è aumentata a causa
della crescente richiesta nell’industria
orafa, elettronica, aeronautica e
aerospaziale nonché per il controllo delle
alte temperature.
•Il metallo si estrae sul posto attraverso una serie di
lavaggi ottenendo così il platino minerale, che,
attaccato con acido nitrico, è separato da ferro,
nichel e rame.
•Dopo filtrazione il residuo solido è trattato con acqua
regia, la quale scioglie il platino sotto forma di cloruri
(H2PtCl6).
Preparazione 2
• Un'addizione di cloruro di ammonio
(NH4Cl) fa precipitare il platino allo stato di
cloroplatinato di ammonio (NH2PtCl6), tale
miscela in seguito è calcinata ottenendo
una massa spugnosa, la spugna di platino.
Successivamente la spugna è
solubilizzata con acqua regia e la
soluzione che si forma, addizionata con
cloruro di sodio, è fatta evaporare per
produrre Na2PtCl6 impuro.
Preparazione 3
• Questo è trattato con una soluzione di
bromato di sodio che scioglie il sale e
lascia come corpo di fondo, sotto forma di
idrossidi, eventuali impurezze di Ir e Rh
residui.
• Con l’aggiunta di cloruro d'ammonio si
forma il composto (NH4)2PtCl6 che per
combustione separa il metallo.
•Una certa quantità di platino è anche estratta da
specifici minerali come
•sperrilite PtAs2
•cooperite PtS
•braggite (Pt,Pd,Ni)S
•fanghi dell'affinazione elettrolitica del rame e del
nichel.
Impieghi
• Per la sua inerzia chimica il platino è
largamente impiegato nella fabbricazione
di recipienti da laboratorio (crogioli,
capsule, storte, tubi, ecc.), di elettrodi
inattaccabili e nella costruzione di
termocoppie per alte temperature oltre
che in gioielleria dove si usano leghe con
oro, argento e iridio.
Quantità notevoli di platino sono assorbite
dall'industria chimica per sfruttare l'attività catalitica e
l'inerzia chimica:
l'ossidazione dell‘ammoniaca a ossido di azoto, sulla
quale si basa il metodo generalmente usato per la
produzione di acido nitrico, si effettua su reti di filo di
lega platino-rodio, più resistente del platino puro nelle
condizioni di esercizio;
i processi di reforming usati nella produzione delle
benzine e di idrocarburi aromatici dal petrolio
e numerosi processi di idrogenazione impiegano
catalizzatori a base di platino finemente disperso su
un supporto costituito da allumina e da altri materiali
inerti.
Leghe di platino
• Nella tecnologia di fusione del vetro e
nelle turbine a propulsione di aerei e
navicelle spaziali sono richiesti materiali
resistenti ad alte temperature, ad alti sforzi
meccanici e ad ambienti ossidanti e
corrosivi. Le superleghe a base di nichel e
metalli refrattari sono materiali per
applicazioni ad alte temperature, tuttavia
non vanno dimenticati platino e leghe a
base di platino.
•Le leghe a base di platino possono essere
utilizzate a temperature superiori ai 2000K e,
nonostante i costi elevati, sono di grande
interesse per applicazioni strutturali in quanto
caratterizzate da eccezionale stabilità chimica,
resistenza ad ossidazione, alti punti di fusione,
duttilità, resistenza a shock termico e
conduttività termica ed elettrica. Lenti ottiche e
fibre di vetro di alta qualità necessitano l'uso di
forni, agitatori e alimentatori in platino.
Leghe di platino
• Il platino puro ha bassa resistenza meccanica ad alte
temperature; per questo viene generalmente legato con
iridio (fino al 20%) o rodio (fino al 30%) che ne
aumentano considerevolmente la resistenza a rottura.
Queste soluzioni solide hanno buona duttilità ad alta
temperatura e saldabilità.
• Le comuni leghe Pt-10%wt.Rh e Pt-20%wt.Rh resistono
all'ossidazione anche a temperature sopra i 1300K.
• Per la sua inalterabilità all'aria, sia a temperatura
ambiente sia ad alta temperatura, e la sua resistenza alla
maggior parte degli agenti chimici (acqua regia esclusa), il
platino è utilizzato per la fabbricazione di numerosi
apparecchi di laboratorio e attrezzature dell'industria
chimica (crogioli, termocoppie, termometri a resistenza,
ecc.).
Leghe di platino
• Per ovviare alla sua eccessiva malleabilità è spesso
necessario unirlo in lega ad altri metalli, come oro, rame,
rodio, iridio, palladio, tungsteno. Nell'oreficeria il platino è
impiegato in lega col rame (10%) o col rutenio (5%)
oppure con l'iridio (10%).
• In elettrotecnica sono impiegate leghe platino-rodio
(10%) per i contatti, per i resistori dei forni a resistenza e
per le termocoppie.
• Per i contatti elettrici sottoposti a frequenti manovre sono
preferite leghe di platino e iridio (20%), impiegate anche
per termocoppie, o di platino e rutenio (10%).
• Taluni elettrodi sono migliorati con l'addizione di una
piccola percentuale di tungsteno (fino al 5%).
Leghe di platino
• Il platino e le sue leghe hanno varie altre
applicazioni in chirurgia, nelle
apparecchiature fisiche di precisione, per
la preparazione di filiere per la lavorazione
del vetro o del raion (platino-rodio oppure
lega formata per il 25% di platino, per il
25% di oro, per il 50% di palladio).
Il platino nelle termocoppie
• I materiali usati per la costruzione delle
termocoppie sono diversi a seconda del
campo di temperatura in cui devono essere
utilizzati, ed a seconda delle caratteristiche
richieste. Dal punto di vista teorico
qualunque coppia di conduttori può servire
per misurare una temperatura, in pratica
invece sono poche le coppie di metalli che si
possono usare per la costruzione di
termocoppie.
• Infatti questa deve presentare una elevata
stabilità a tutte le temperature a cui lavora e
deve generare una forza elettro motrice
(f.e.m.) elevata, sempre crescente al
crescere della temperatura e possibilmente
lineare con la temperatura. La termocoppia
più comunemente usata nel campo delle
temperature elevate, sia nelle industrie, sia
nei laboratori, è quella costituita da chromelalumel (chromel = 90% Ni, 10% Cr; alumel =
94% Ni, 2% di Al, 3% di Mn, 1% di Si).
• Per le temperature più alte, quando nessuna
delle altre coppie può essere impiegata, si
usa la termocoppia platino-platino/rodio,
ottenute dalla deposizione di uno strato
sottile di platino (200 micrometri), o di sue
leghe, attraverso spruzzatura e fiammatura.
• Esistono due tipi di tali coppie che si
differenziano unicamente per la percentuale
di rodio che può essere del 10% o del 13%,
la differenza fra i due tipi è minima; la
seconda ha una f.e.m. leggermente
superiore.
• Le termocoppie al platino presentano il
vantaggio di poter essere usate fino a
temperature di 1500°C ed hanno una forza
elettromotrice più riproducibile di quelle
formate con metalli non nobili.
• Servono quasi esclusivamente per misure
di temperature elevate e, in particolare, non
possono essere usate a temperature
inferiori a 0°C perché al diminuire della
temperatura la f.e.m diminuisce
rapidamente fino ad annullarsi.
Due immagini di candele al platino. Il platino costituisce l'elettrodo positivo
Termometri a resistenza
• Il principio di funzionamento dei termometri a
resistenza metallici, più comunemente
chiamati termoresistenze, si basa sulla
variazione della resistenza elettrica di un
metallo al variare della temperatura a cui è
sottoposto.
• In campo industriale i materiali maggiormente
utilizzati sono il platino ed il nichel che, grazie
alla loro elevata resistività e stabilità,
permettono di realizzare termoelementi con
elevata riproducibilità, di piccole dimensioni e
con ottime caratteristiche dinamiche.
• Le misure di temperatura effettuate con le
termoresistenze sono di gran lunga più
precise e affidabili rispetto a quelle
effettuate con altri tipi di sensori quali
termocoppie o termistori.
• Normalmente i termometri a resistenza sono
identificati con la sigla del materiale
utilizzato per la loro costruzione (platino =
Pt, Nichel = Ni ecc.) seguito dalla loro
resistenza nominale alla temperatura di 0°C.
Il platino nella marmitta catalitica
• Piccolo reattore chimico incorporato nel sistema di scarico
dell'automobile, in grado di eliminare questi agenti inquinanti
dai gas di scarico.
• Questa è costituita da una struttura di ceramica a nido d'ape,
rivestita da una pellicola sottile di metalli catalizzatori,che
facilitano le reazioni chimiche, come il palladio, il rodio, ed il
platino.
• Le prime marmitte catalitiche introdotte erano di tipo
ossidante, in cui i composti parzialmente ossidati,
completavano la reazione di combustione reagendo con
l'ossigeno O2 rimasto nei gas di scarico ed andavano a
formare CO2 e H2O, prodotti della combustione ideale.
Tuttavia questo tipo di marmitta non era in grado di
abbattere l'ossido di azoto.
Il platino nella marmitta catalitica
• Per eliminare l'ossido di azoto NO non bisogna ossidare,
ma piuttosto ridurre, quindi utilizzare dei catalizzatori
riducenti, che favoriscono la decomposizione dell'ossido
in N2 e O2.
• A valle di questo si pone il catalizzatore ossidante che
utilizza l'ossigeno, ancora presente nei gas di scarico,
per completare la combustione dei composti non
completamente ossidati.
•
• Le moderne marmitte catalitiche sono dette trivalenti
perché riescono ad eliminare tutti e tre gli inquinanti dai
fumi di scarico.
Il platino industria chimica
• L'acido nitrico HNO3 fu scoperto dall'alchimista
arabo Geber e la sua determinazione quantitativa
si deve a Gay-Lussac.
• La soluzione acquosa è incolore e spesso
assume colorazione giallo-rossastra per la
presenza di vapori nitrosi. Ha densità 1,52,
solidifica a -41°C in cristalli incolori e bolle a
86°C, alla pressione atmosferica. Fuma all'aria
perché è avido d'acqua e forma nebbie con il
vapor acqueo atmosferico.
• Preparazione industriale:
• Il metodo industriale è basato sull'ossidazione
catalitica dell'ammoniaca mediante aria.
Il platino industria chimica
• La reazione avviene facendo passare la miscela
gassosa su reti di platino-iridio mantenute a 8001000°C per semplice azione del calore di
reazione. I gas vengono raffreddati e l'ossido di
azoto si trasforma in biossido per azione
dell'eccesso di ossigeno.
• Il biossido di azoto viene fatto passare
attraverso una serie di torri di lavaggio in cui, per
effetto di una pioggia d'acqua, avviene la
reazione di formazione dell'acido.
• L'ossido di azoto si riossida con l'eccesso di aria
e rientra in ciclo, mentre dalle torri si spillano
due tipi di acido, uno al 52% e uno al 67%
(acido nitrico concentrato).
Il platino in medicina
• Il pace-maker è un dispositivo elettronico
miniaturizzato capace di ripristinare, in caso di
patologie del ritmo cardiaco, la contrazione regolare
del cuore mediante invio di impulsi elettrici. E’
composto da un generatore di impulsi alimentato da
batterie la cui durata varia dai 5 ai 10 anni e da
elettrodi a base di iridio e platino che, partendo dal
generatore e inseriti in una vena, raggiungono la
parete di una delle camere cardiache.
• La chemioterapia curata con platino ed integrata da
trattamenti chirurgici e radioterapici è alla base dei
trattamenti delle neoplasie e dei linfomi maligni.
Il platino in gioielleria
• Sebbene resti un elemento insostituibile in molti impieghi
di natura scientifica e tecnologica, è nella gioielleria che
il platino ha trovato la sua grande occasione. Già prima
dell'Art Dèco la veloce crescita della domanda fece del
platino un metallo sempre più costoso e raro; inoltre tale
domanda non poteva essere soddisfatta anche a causa
dello scoppio della Prima Guerra Mondiale, in seguito
alla quale il platino fu dichiarato materiale strategico da
parte dei paesi belligeranti.
• Con le oscillazioni dovute alle variazioni della moda, alla
disponibilità di materia prima e alle leggi di mercato, il
platino ha continuato a ricoprire un ruolo molto
importante nella gioielleria del nostro secolo.
Il platino in gioielleria
• é raro
• é puro: I gioielli in platino sono generalmente
puri al 95%, a confronto l'oro a 18 carati è puro
al 75%. Nessun metallo in gioielleria è utilizzato
completamente puro, ma sotto forma di lega. Al
contrario il platino, dando luogo a poche leghe,
mantiene la sua purezza e non cambia aspetto o
colore, conservando la propria brillantezza per
anni.
Il platino in gioielleria
• é pesante: Il suo peso specifico (21,45 g/cm3) è
uno dei più elevati che si conoscano; si
consideri che quello dell'oro (19,3 g/cm3)e quello
dell'argento (10,5 g/cm3). Un cubo di 15 cm di
platino pesa 75 kg, più o meno il peso di una
persona
• é refrattario al calore
• é inossidabile
• é duttile
• é anallergico
Il platino in gioielleria
• è eterno: Il platino non si consuma e offre
garanzie di sicurezza per l'incastonatura delle
pietre preziose. Alcune delle gemme più
preziose del mondo sono incastonate in platino,
come il famoso diamante Koh-i-Noor, che fa
parte dei gioielli della Corona inglese. Tutti i
metalli preziosi si segnano nel tempo e il platino
non fa eccezione. Tuttavia, mentre l'oro si rovina
per dispersione e col tempo si consuma
riducendo parzialmente il suo volume, il platino
si segna per compressione e non perde
assolutamente peso.
Domanda ed offerta globale di platino e domanda per applicazione, 1975-2006
Fonte: UNCTAD based on data from Johnson Matthey's Platinum
Domanda per applicazione 1975-2006
Fonte: UNCTAD based on data from Johnson Matthey's Platinum
Domanda di platino per applicazione nel 2006
Fonte: UNCTAD based on data from Johnson Matthey's platinum
Offerta di platino per regioni (%), media 2002-2006
Fonte: UNCTAD based on data from Johnson Matthey's Platinum
Domanda di platino per regioni (%), media 2002-2006
Fonte: UNCTAD based on data from Johnson Matthey's Platinum