BIOENERGETICA
branca della biochimica che si occupa di trasferimento e
utilizzazione di E
Si applicano le leggi della termodinamica
I, II e III legge della termodinamica
Negli organismi viventi l’ordine è conservato prelevando
E dall’ambiente (nutrienti o luce solare) e restituendo E
all’ambiente (calore ed entropia)
DG’= DG°’+ RTln [prodotti]/[reagenti]
Tendenza a spostarsi verso l’equilibrio forza
trainante la reazione
In tutti gli organismi le sostanze vengono prodotte in una serie di
reazioni biochimiche rigorosamente coordinate.
Le energie libere di reazioni in successione sono
additive
L’E prodotta da processi esoergonici fornisce la forza
termodinamica per alimentare quelli endoergonici.
Le reazioni biochimiche accoppiate sono catalizzate da
enzimi
D G°’ = -30.5 kJ/mole
L’idrolisi di ATP è accompagnata da grande
variazione di energia libera standard (di segno
negativo). La scissione del legame fosfoanidridico
provoca:
• l’allontanamento di uno dei tre gruppi fosforici
dell’ATP, carico negativamente, rimuovendo dalla
molecola alcune delle repulsioni elettrostatiche
•Stabilizzazione del gruppo fosfato da alcune forme
di risonanza non possibili quando il gruppo è inserito
nella molecola dell’ATP
• ionizzazione della restante parte della molecola
con rilascio di uno ione H+ in un mezzo in cui la
concentrazione di ioni H+ è molto bassa (situazione
che favorisce l’idrolisi).
I processi vitali che richiedono energia sono alimentati
dall’idrolisi di molecole di ATP
Il flusso di E coinvolge la molecola di ATP e la maggior parte di
reazioni prevede il trasferimento di un gruppo Pi da ATP ad
un’altra sostanza o da una molecola ad alto contenuto di E ad
ADP per dare ATP, molecola che collega catabolismo ad
anabolismo immagazzinando E da ossidazione dei nutrienti o
luce solare e donandola per:
• sintesi di metaboliti,
•trasporto transmembrana
•movimento meccanico.
ATP molecola più versatile perché presente in tutte le cellule a
concentrazioni elevate e con enzimi utili per i vari processi.
Gli enzimi che catalizzano il trasferimento di Pi si chiamano
chinasi.
Il 90% di ATP, ADP e Pi forma complessi con lo ione Mg2+
Ciclo dell’ATP
Nel ciclo ATP/ADP, un apporto di energia permette a
una molecola di ADP (adenosindifosfato) di legarsi a
un gruppo fosfato (uno ione fosfato inorganico PO43indicato con Pi) formando una molecola di ATP; a sua
volta, poi, la molecola di ATP cede un gruppo fosfato e
si trasforma nuovamente in una molecola di ADP.
Il processo per cui un gruppo fosfato viene aggiunto a
una molecola è detto fosforilazione.
Quando una molecola viene fosforilata dall’ATP
generalmente il suo contenuto di energia aumenta,
sicché la molecola viene attivata e messa in grado di
partecipare a una determinata reazione.
Altre molecole ad alto contenuto energetico
Molecole con potenziale di trasferimento di Pi maggiore di
ATP trasferiscono Pi ad ADP, quelle con potenziale di
trasferimento minore ricevono Pi da ATP.
Alcuni tiesteri hanno energia libera di idrolisi molto elevata
Le reazioni di ossidoriduzione in biochimica
Nei sistemi biologici gli elettroni vengono trasferiti da una molecola (donatore)
ad un’altra (accettore) in quattro modi diversi.
1. Sono trasferiti direttamente come elettroni Es. la coppia redox Fe2+/Fe3+
può trasferire un elettrone alla coppia Cu+/ Cu2+: Fe2+ + Cu2+
Fe3+ +
Cu+
2. Gli elettroni possono essere trasferiti sotto forma di atomi di idrogeno (H+ +
e-)
AH2 A + 2e- + 2H+
AH2 agisce come donatore di atomi di H AH2 e A costituiscono una coppia
redox coniugata che può ridurre un altro composto B (o coppia redox B/BH2)
mediante trasferimento di H (H+ + e-)
AH2 + B A + BH2
3. Gli elettroni possono essere trasferiti da un donatore ad un accettore di
elettroni sotto forma di ione idruro H- Es. deidrogenasi NAD-dipendenti
4. Il trasferimento di elettroni può avvenire per combinazione diretta di un
riducente organico con l’ossigeno per formare un prodotto in cui l’ossigeno è
legato covalentemente Es. ossidazione di un idrocarburo ad alcol
R-CH3 + 1/2O2 R-CH2-OH
L’idrocarburo è il donatore di elettroni e l’ossigeno è l’accettore di elettroni
Trasferimento di e- di cruciale importanza
nelle reazioni metaboliche
Flusso di e- nelle reazioni redox
responsabile di tutto il lavoro prodotto dagli
organismi viventi
Gli e- passano da intermedi metabolici a
trasportatori specializzati in reazioni
catalizzate da enzimi, che a loro volta li
danno ad accettori ad alta affinità per gli
elettroni con rilascio di E (conversione del
flusso elettronico in lavoro utile).
Potenziali standard di ossido-riduzioni di interesse biologico
Trasferiscono 2 e- e 2 H+
NADH prodotto nelle reazioni
cataboliche
NADPH usato nelle reazioni
anaboliche, si spostano entrambi
rapidamente da un enzima all’altro
Nucleotidi flavinici sono spesso saldamente legati
agli enzimi (flavoproteine)
Chinoni solubili nei lipidi
trasportano e- nelle
membrane
Citocromi= proteine legate saldamente a gruppi prostetici, alcuni solubili
altri legati alle membrane. L’EME è legato fortemente ma non
covalentemente nei citocromi a e b alle proteine, quello c
covalentemente attraverso residui di cisteina
Spesso il nome del citocromo corrisponde a quello della l di max assorbimento
Fe-S proteine
Un atomo di Fe
2Fe-2S
4Fe-4S
I trasportatori di elettroni sono disposti in ordine di potenziale
dei riduzione crescente, poiché gli e- tendono a fluire da
trasportatori con E°’< a E°’>
Le diverse serie di reazioni catalizzate da enzimi
costituiscono le
VIE METABOLICHE
Ogni tappa di una via metabolica produce una modificazione
chimica specifica di uno specifico atomo o gruppo funzionale.
In una data via metabolica una molecola di PRECURSORE
viene convertita in un PRODOTTO attraverso una serie di
INTERMEDI chiamati METABOLITI
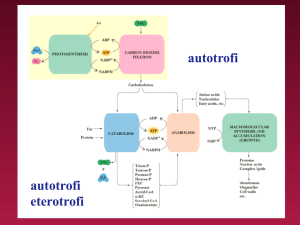
Tutti i processi biosintetici (ANABOLICI). Partendo da
molecole semplici ed ossidate (CO2, H2O, N2) si ottengono
biomolecole complesse. Sono PROCESSI RIDUTTIVI.
Reazioni di degradazione (CATABOLICHE). Partendo da
molecole complesse (carboidrati, lipidi, proteine, acidi
nucleici) si ottengono CO2, H2O e, nell’uomo, UREA. Sono
PROCESSI OSSIDATIVI.