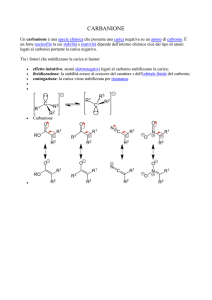
La chimica del carbonio
La chimica del carbonio
Lezione 5
Domanda!
Perché diamante e grafite sono formati dagli stessi
atomi ma sono così diversi?
Prova tu a rispondere e poi continua a leggere….
La chimica del carbonio
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
La chimica del carbonio
Studia il carbonio
e i suoi derivati
Composti naturali
Composti sintetici
Carboidrati, proteine,
acidi nucleici,….
Il carbonio è uno dei
costituenti principali di
animali e piante
Carburanti, farmaci,
sostanze plastiche, …
Il carbonio
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
• Usato anche in tempi antichi e ottenuto bruciando sostanze organiche
• Lavoisier (XVIII sec) scopre che il carbonio è una sostanza semplice
(atomi tutti dello stesso elemento chimico)
• I legami multipli tra atomi di carbonio sono molto stabili
• Possibilità di formare 10 milioni di composti
si combina con altri atomi di carbonio
oppure con alcuni altri elementi
CO2
Anidride carbonica
Cl
Cloro
CO
Monossido di carbonio
CHCL3
Cloroformio
Il carbonio
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
Configurazione elettronica dell’atomo di carbonio
1s2 2s2 2p2
2 orbitali p semipieni
Dovrebbe formare
2 legami covalenti
IBRIDAZIONE
Passaggio di un elettrone dall’orbitale
2s sull’orbitale 2p vuoto
4 orbitali semipieni
Carbonio tetravalente
Nella molecola di
metano il carbonio è
tetravalente
Ibridazione
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
IBRIDAZIONE sp3
4 nuovi orbitali ibridi identici sp3
caratteristiche intermedie
tra i due orbitali di partenza
ESEMPIO:
metano
Disposizione orbitali:
• a 109,5° l’uno dall’altro
• Puntano verso i vertici di un tetraedro
Struttura:
tetraedro
Ibridazione
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
LEGAME
COVALENTE
IBRIDAZIONE sp2
DOPPIO
C=C
3 orbitali di tipo sp2
caratteristiche
intermedie tra i due
orbitali di partenza
+
1 orbitale p
Disposizione orbitali:
• a 120° l’uno dall’altro
• complanari
Perpendicolare al piano
individuato dagli altri 3
orbitali
Struttura:
planare
ESEMPIO:
Etilene (C2H4)
Ibridazione
Introduzione
Carbonio
Ibridazione
Forme allotropiche
IBRIDAZIONE sp
Diamante e grafite:
curiosità
LEGAME
COVALENTE
TRIPLO
C≡C
2 orbitali ibridi sp
caratteristiche
intermedie tra i due
orbitali di partenza
ESEMPIO:
Anidride carbonica
(CO2)
+
Disposizione orbitali sp:
• a 180° l’uno dall’altro
2 orbitali p
Disposizione orbitali p:
• Perpendicolari tra loro
• Perpendicolari ai 2 orbitali sp
Struttura:
lineare
Ibridazione
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
Tipi di legami
In chimica organica il Carbonio forma 4
legami che possono essere:
4 legami semplici
C
2 legami semplici
e
1 legame doppio
1 legame semplice
e
1 legame triplo
C
C
Forme allotropiche
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
In natura il Carbonio è presente sotto diverse forme
3 forme allotropiche principali:
GRAFITE
DIAMANTE
Diverse strutture cristalline
FULLERENE
Forme allotropiche
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
Diamante
Tetraedro regolare
Atomi di carbonio
ai vertici
Legami covalenti
Ibridazione
sp3
Materiale più duro Prodotto della
natura
e miglior conduttore
(vulcani) e
in natura
prodotto in
laboratorio
Forme allotropiche
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
Grafite
Strati planari di
esagoni regolari
Atomi di carbonio
ai vertici
Ibridazione
sp2
Buon conducibilità
elettrica nella direzione
dei piani
Prodotto della natura
(trasformazioni di
sedimenti organici) e
prodotto in industria
Forme allotropiche
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
Fullerene
Forma sferica
o tubolare
Atomi di carbonio
ai vertici di esagoni
regolari che formano
la superficie
Alcuni anelli
di altre forme
Struttura simile
alla grafite
Quasi insolubile e molto
stabile
Scoperti nelle polveri
di carbonio
Curiosità
Introduzione
Carbonio
Ibridazione
Forme allotropiche
Diamante e grafite:
curiosità
Diamante e grafite
Diamante e grafite provengono entrambi dal Carbonio ma hanno proprietà molto diverse.
Diversa struttura cristallina
(disposizione degli atomi nello spazio)
la disposizione a
tetraedro che si ha nel
diamante gli conferisce
la durezza
La disposizione planare
degli strati di grafite tenuti
insieme da forze deboli fa
sì che si sfaldi facilmente
La chimica del carbonio
ESERCIZI
La chimica del carbonio
Indica se ogni affermazione è vera (V) o falsa (F):
Il carbonio non può essere sintetizzato in laboratorio
□V
□F
I legami tra atomi di carbonio sono in generale molto stabili
□V
□F
Lavoisier scopre il carbonio come sostanza semplice
□V
□F
□V
□F
Nell’ibridazione sp3 il carbonio è tetravalente
□V
□F
Nell’ibridazione sp2 si formano 4 orbitali identici
□V
□F
Nell’ibridazione sp si forma un legame doppio covalente
□V
□F
Un esempio di ibridazione sp è la CO2
□V
□F
Le diverse proprietà delle forme allotropiche del carbonio sono dovute alla diversa
disposizione degli atomi
□V
□F
Il diamante è un ottimo conduttore
□V
□F
Il fullerene può avere 2 diverse tipologie di struttura cristallina
□V
□F
La configurazione elettronica di un atomo di carbonio non ibrido è
1s2 1s2 2p2
Soluzione
Il carbonio non può essere sintetizzato in laboratorio
□V
□F
I legami tra atomi di carbonio sono in generale molto stabili
□V
□F
Lavoisier scopre il carbonio come sostanza semplice
□V
□F
□V
□F
Nell’ibridazione sp3 il carbonio è tetravalente
□V
□F
Nell’ibridazione sp2 si formano 4 orbitali identici
□V
□F
Nell’ibridazione sp si forma un legame doppio covalente
□V
□F
Un esempio di ibridazione sp è la CO2
□V
□F
Le diverse proprietà delle forme allotropiche del carbonio sono dovute alla diversa
disposizione degli atomi
□V
□F
Il diamante è un ottimo conduttore
□V
□F
Il fullerene può avere 2 diverse tipologie di struttura cristallina
□V
□F
La configurazione elettronica di un atomo di carbonio non ibrido è
1s2 1s2 2p2
La chimica del carbonio
Individua la risposta corretta:
In una molecola di metano gli orbitali liberi formano angoli di
A)
B)
C)
D)
90°
109°
120°
180°
La figura a lato rappresenta i legami di
A)
B)
C)
D)
un atomo di carbonio non ibrido
un atomo di carbonio con ibridazione sp3
un atomo di carbonio con ibridazione sp2
un atomo di carbonio con ibridazione sp
Quale di queste affermazioni sul carbonio non è corretta?
A)
B)
C)
D)
Il carbonio può formare milioni di composti
Il carbonio è tetravalente
Il cloro è un composto del carbonio
L’ibridazione sp porta a una struttura lineare
C
Soluzione
In una molecola di metano gli orbitali liberi formano angoli di
A)
B)
C)
D)
90°
109°
120°
180°
La figura a lato rappresenta i legami di
A)
B)
C)
D)
un atomo di carbonio non ibrido
un atomo di carbonio con ibridazione sp3
un atomo di carbonio con ibridazione sp2
un atomo di carbonio con ibridazione sp
Quale di queste affermazioni sul carbonio non è corretta?
A)
B)
C)
D)
Il carbonio può formare milioni di composti
Il carbonio è tetravalente
Il cloro è un composto del carbonio
L’ibridazione sp porta a una struttura lineare
C
La chimica del carbonio
Qual è la struttura chimica della grafite?
A
B
C
D
Soluzione
A
B
C
D