ISOMERIA
Sono chiamati isomeri composti diversi
aventi ugual formula molecolare (dal
greco so, uguale; mero, parte).
ISOMERI
Si definiscono isomeri
composti con identica formula molecolare, ma
diversa struttura (concatenazione degli atomi)
o diversa configurazione // conformazione
(disposizione degli atomi nello spazio)
N.B.
• formula bruta: quali e quanti atomi sono presenti
nella molecola
• formula di struttura: in che modo questi atomi sono
reciprocamente disposti
Gli isomeri hanno quindi stesso peso molecolare, ma
diverse caratteristiche chimico-fisiche
ISOMERIA
Le molecole organiche sono formate da pochi tipi di atomi, che
si possono legare tra loro in modi diversi. Per questo motivo
una stessa formula bruta può rappresentare composti differenti
Molecole differenti che hanno la stessa formula bruta si dicono
isomeri
Possiamo avere due tipi fondamentalmente di
isomerie
• ISOMERIA COSTITUZIONALE
• STEREOISOMERIA
Ricordiamo!!
Definizione di isomero
Si definiscono isomeri due o più molecole aventi stessa formula
molecolare ma differente formula di struttura.
Esistono vari tipi
di isomeria:
Costituzionale o Strutturale: gli atomi di carbonio sono legati tra di loro in maniera
differente (per esempio isobutano e normalbutano).(cambia l’ordine)
Stereoisomeria: gli stereoisomeri presentano gli stessi legami ma differiscono per il
modo in cui gli atomi sono orientati nello spazio.
Esistonoi due tipi di stereoisomeria :Isomeria Conformazionale e Configurazionale
Abbiamo. isomeri conformazionali gli isomeri che possono trasformarsi l’uno
nell’altro senza la rottura di legami (per esempio le diverse conformazioni anti e
gauche del n-butano).
Isomeria Configurazionale si divide in
Si chiamano isomeri geometrici i diastereoisomeri che debbono la loro esistenza
alla mancanza di libera rotazione intorno ai doppi legami (isomeria cis/trans nel
2-butene).
Si chiamano isomeri ottici ( legata all’atomo di C asimmetrico)gli isomeri che non
sono sovrapponibili alla loro immagine speculare.( enantiomeri) Per trasformare
uno stereoisomero nell’altro è necessario rompere e riformare almeno un legame.
Si chiamano diastereoisomeri gli stereoisomeri che non sono uno l’immagine
speculare dell’altro
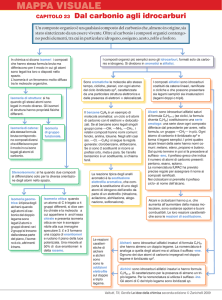
stessa formula molecolare
ma diversa distribuzione di atomi
ISOMERIA
C
di catena
C
C
C
C
C
C
C
C
C
C
C
H
STRUTTURALE o
Costituzionale
Atomi legati tra
loro in successione
differente
O
di posizione
C
C
di gruppo
funzionale
C
C
C
C
C
C
—C—C—C—C—O—H —C—C—O—C—C—H
Sfalsata
Conformazionale
STEREOISOMERIA
Eclissata
Atomi legati allo stesso modo
(ma =disposizione spaziale)
Configurazionale
Ottica
GEOMETRICA
enantiomeri
cis
trans
trans
cis
O
H
COSTITUZIONALE:
Se gli isomeri
differiscono per
l’ordine con cui
sono legati i loro
atomi
ISOMERIA:
è il fenomeno
per cui
composti che
hanno la
stessa
formula
molecolare
sono diversi
STEREOISOMERIA:
gli isomeri hanno la
stessa costituzione ma
differiscono per
la disposizione
degli atomi nello spazio
Di catena
Es.
CH3CH2CH2CH2CH3
CH3CH2CHCH3
I
CH3
Di posizione Es.
CH3CH2CH2-OH
CH3CHCH3
I
OH
Di funzione
CH3CH2CH2-OH
CH3CH2-OCH3
Es.
CONFORMAZIONALE:
gli isomeri sono
convertibili l’uno nell’altro
per semplice rotazione
attorno a un legame
CONFIGURAZIONALE:
gli isomeri sono
convertibili l’uno nell’altro
per rottura e ricostruzione
di un legame
GEOMETRICA
OTTICA
Isomeria COSTITUZIONALE o
STRUTTURALE
Gli isomeri differiscono per l’ordine con cui sono
legati i loro atomi
Cioè consiste in una diversa disposizione dei legami chimici
all’interno della molecola: gli atomi costituenti sono gli stessi,
ma risultano legati in modo diverso gli uni con gli altri.
Ci sono tre tipi di isomerie strutturale:
Isomeria di catena :stesso numero di atomi di C disposti in modo diverso
Isomeria di posizione: stessa catena ma diversa posizione di atomi sostituenti o
gruppi funzionali
Isomeria di gruppo funzionale:
gruppi funzionali diversi
diversa disposizione degli atomi determina
ISOMERIA STRUTTURALE o costituzionale
Esistono centinaia di composti diversi che hanno la stessa
formula molecolare.
Isomeri costituzionali
identica formula molecolare ma diversa struttura
• Isomeri di catena
C5H12
Isomeria di catena
Si parla di isomeria di catena se le differenze tra le molecole dei composti
riguardano lo scheletro della molecola, vale a dire i legami tra gli atomi di
carbonio; ad esempio, tali atomi possono formare una catena lineare oppure
ramificata
Gli idrocarburi sono formati da catene di soli atomi di carbonio
Gli atomi possono però essere legati in modo diverso
CH3
H3 C
C
CH3
CH3
Tutti questi composti hanno formula C5H12, ma sono diversi tra loro
(proprietà però molto simili)
C4H10
CH3CH2CH2CH3
butano
C4H10
CH3CHCH3
CH3
2-metilpropano
Isomeria di posizione
Due isomeri possono differire solo per la posizione del gruppo funzionale
Negli isomeri di posizione, invece, non cambiano i legami tra gli atomi di carbonio,
ma solo la disposizione dei sostituenti– gli atomi o i gruppi funzionali a essi legati.
Se poi la ridistribuzione dei legami interessa i gruppi funzionali,
si parla più propriamente di isomeria funzionale.
1-propanolo
OH
2-propanolo
H3C
C
H
Isomeria di posizione
CH3
• Isomeri di posizione
C4H9Cl
CH2Cl-CH2-CH2-CH3 1-clorobutano
CH3-CHCl-CH2-CH3 2-clorobutano
• Isomeri di funzione
In alcuni casi la stessa formula bruta corrisponde a gruppi funzionali
diversi:
Isomeria di gruppo funzionale
La formula C2H6O può essere
H3C
CH2OH
un alcol
H3C
O
un etere
Ma….sono composti differenti perché..
CH3
• Isomeri di funzione
Proprietà fisiche di due isomeri:
etanolo e dimetil etere
Proprietà
Etil alcol
Etil etere
Formula molecolare
Punto di ebollizione
Punto di fusione
Densità
Solubilità in acqua
C2H6O
78.5°C
-117°C
0.789 g/cc
completa
C2H6O
-24°C
-138°C
2 g/cc
leggera
Struttura molecolare
Gruppi funzionali
Alcuni gruppi di atomi conferiscono ai composti organici caratteristiche
e reattività particolari, e sono detti gruppi funzionali
alcol
R
chetone
OH
O
R
C
R
etere
R
O
R
carbossile
O
R
C
OH
aldeide
O
R
C
H
ammina
R
NH2
stessa formula molecolare
ma diversa distribuzione di atomi
ISOMERIA
C
di catena
C
C
C
C
C
C
C
C
C
C
C
H
STRUTTURALE o
Costituzionale
Atomi legati tra
loro in successione
differente
O
di posizione
C
C
di gruppo
funzionale
C
C
C
C
C
C
—C—C—C—C—O—H —C—C—O—C—C—H
Sfalsata
Conformazionale
Eclissata
STEREOISOMERIA
Atomi legati allo stesso modo
(ma =disposizione spaziale)
Configurazionale
Ottica
GEOMETRICA
enantiomeri
cis
trans
trans
cis
O
H
STEREOCHIMICA
La stereochimica è quella parte della chimica
organica che studia la struttura molecolare nelle
tre dimensioni (stereo= solido).
STEREOISOMERIA
Gli stereoisomeri sono quei particolari isomeri
che differiscono soltanto per il modo in cui gli
atomi sono disposti nello spazio
Stereoisomeria:
gli atomi rimangono gli stessi, ma è uguale anche il tipo di legami che
li unisce; quello che cambia è l’orientazione nello spazio di tali legami
• Anche la stereoisomeria può essere di
diversi tipi:
• conformazionale
• geometrica
• ottica.
Stereoisomeri conformazionali
derivano dalla diversa disposizione degli atomi
nello spazio correlata alla possibilità
di
rotazione intorno al legame semplice C-C
si possono interconvertire
senza rottura
di legami (con poca energia; temperatura
ambiente); non sono fisicamente separabili
(poiché si trasformano rapidamente uno
nell’altro)
ISOMERIA CONFORMAZIONALE
L’isomeria conformazionale è tipica di quei composti che
differiscono gli uni dagli altri per la diversa posizione degli atomi
intorno a un legame singolo tra due atomi di carbonio.
Più precisamente, nei diversi isomeri tali atomi risultano ruotati rispetto
all’asse centrale C-C
Uguali proprietà chimiche ma diverse proprietà biologiche
ISOMERIA CONFORMAZIONALE es butano
CH3
H
H
H
H
H
H
H
H
CH3
H
H
H
CH3
H CH3
CH3
CH3
H
H
H
H
H
CH3
CH3
CH3
H
H
H3C
H
CH3
H
H
H
H
CH3
Il conformero anti è quello a minore energia
perché presenta il minimo ingombro sterico
CH3
H
H
H
H
CH3
Altro es di isomeria
conformazionale
H
H
H
H
?
H
H
H
H
H
H
H
H
a = 109°
conformazione a sedia
Tutti i carboni del cicloesano hanno gli orbitali di valenza
ibridati sp3.
Questo implica che, nella conformazione a sedia,
ciascuno degli angoli di legame è 109°5’.
H
H
H
H
H
H
109°
H
H
H
H
H
H
conformazione a barca
2
4
3
1
6
5
a
4
1
1
3
2
6
3
2
5
b
Stereoisomeri
conformazionali
5
6
c
4
2
4
3
1
6
5
a
4
1
1
3
2
6
5
b
3
2
5
4
6
c
Sono sufficienti semplici rotazioni intorno ai legami s C-C per passare
dal conformero a al conformero b, al conformero c.
Il conformero b, a causa del maggiore ingombro sterico (frecce blu)
e della conformazione eclissata dei quattro atomi di carbonio posti in
basso (frecce rosse) è il meno stabile
a, b e c sono stereoisomeri conformazionali del metilcicloesano.
Il conformero più stabile è c, in quanto il gruppo metile, che è
il più ingombrante, occupa una posizione equatoriale.
CH3
H
H
H
H
C
H
C
H
C
C
H
H
H
C
H
C
H
a
H
H
H
H
H
H
H
H
CH 3
H
H
H
H
b
H H
H
C
H
H
C
C
H
H
C
C
CH3
H
H
H
C
H
c
IMPORTANZA BIOLOGICA DELLA
Isomeria conformazionale
L’isomeria conformazionale è legata alla possibilità che hanno le
molecole di ruotare attorno ai legami s
gli isomeri conformazionali sono la stessa molecola in forme diverse
IMPORTANTE!!
Nelle molecole piccole gli isomeri conformazionali possono
convertirsi l’uno nell’altro con grande facilità, ma nelle molecole
grandi, le macromolecole, le interazioni deboli tra le diverse parti
rende stabile le diverse conformazioni
I prioni sono isomeri conformazionali di costituenti proteici
normali (detti PrP, abbreviazione di prion protein) delle cellule
La proteina Prionica esiste in due
isoforme, che hanno peso
molecolare e sequenza
aminoacidica identiche ma
differiscono nella struttura terziaria
e quaternaria
Una proteina può
assumere +
conformazioni
resterà in quella più
stabile a minor
energia
Struttura di un α-elica, i
residui aminoacidici che
sporgono all'esterno mentre
all'interno la struttura è
stabilizzata da legami H
Isomeria conformazionale es biologici
L’isomeria conformazionale del farmaco è uno dei fattori che
influenza l’interazione farmaco-recettore.
Gli isomeri conformazionali originano da rotazioni rispetto a legami
semplici non ostacolate da barriere energetiche elevate. Le
disposizioni sin, gauche e anti del n-butano e quelle “a sedia”, “a
semisedia”, “a barca-distorta” e “a barca” del cicloesano sono tipici
esempi di conformazioni.
L’adozione da parte del farmaco della conformazione legata al
recettore (nota anche come conformazione bioattiva) è un evento
tanto più probabile quanto minore è il numero delle conformazioni
che può assumere lo stesso farmaco.
Di conseguenza, a parità di altre condizioni, i farmaci rigidi sono
dotati di maggiore potenza rispetto ai loro analoghi flessibili.
La conformazione del farmaco
riconosciuta dal recettore non è
necessariamente quella
energeticamente più stabile
Evidentemente, una conformazione meno stabile del
farmaco può possedere una geometria più adatta a stabilire
una serie di interazioni attrattive con il recettore. In tal caso,
il “guadagno” energetico associato a tali interazioni utili può
compensare la “spesa” energetica richiesta al farmaco per
assumere una conformazione caratterizzata da una maggiore
tensione sterica.
In figura: il farmaco può adottare una conformazione
energeticamente instabile per legarsi al recettore.
ISOMERIA CONFIGURAZIONALE
Gli isomeri sono convertibili l’uno
nell’altro per rottura e ricostruzione di un
legame
Possiamo avere:
ISOMERIA GEOMETRICA o cis-trans
Isomeria geometrica interessa quei composti in cui siano presenti doppi legami tra atomi
di carbonio, e consiste in una diversa disposizione degli atomi o dei gruppi a essi legati; a
seconda che gruppi uguali si trovino dalla stessa parte o da parti opposte rispetto all’asse
individuato dagli atomi di carbonio, si parla di composto cis- o trans-; nella nomenclatura
più recente, a questi due prefissi si preferiscono le etichette E e Z. In genere, due isomeri
di questo tipo presentano proprietà chimiche anche molto diverse l’uno rispetto all’altro
ISOMERIA OTTICA
L’isomeria ottica riguarda quei composti che risultano l’uno l’immagine speculare
dell’altro. Una coppia di stereoisomeri ottici (enantiomeri), quindi, sono asimmetrici, in
quanto non sovrapponibili; l’atomo di carbonio su cui fa perno la molecola si dice
asimmetrico o “chirale” e, per estensione, l’isomeria ottica stessa si indica anche con il
termine chiralità
Isomeria geometrica
La rotazione di una molecola attorno al doppio legame non
è possibile, perché causerebbe la rottura del legame p
quindi questi due composti sono diversi
H3 C
H3 C
H
H3 C
H
C
C
C
C
H
H
CH3
CIS
TRANS
il composto con i gruppi
ingombranti dallo stesso lato
il composto con i gruppi
ingombranti dallo lato opposto
L’isomeria geometrica è detta anche isomeria cis-trans
ISOMERIA GEOMETRICA
H
H
C
C
H3C
C
CH3
cis-2-butene
CH3
H
C
H
H3C
trans-2-butene
esempio
ACIDO MALEICO
TOssico Irritante per gli occhi, le vie
respiratorie e la pelle]
ACIDO FUMARICO
Presente nel nostro
organismo Importante
intermedio di molte reazioni
biochimiche
Il carbonio 1 ha due sostituenti uguali e perciò
non può aversi stereoisomeria geometrica
H
H
C
H
C
CH3
H
H
CH3
H
CH3
C
C
C
CH2
C
CH2 H
CH3
CH3
cis-2-pentene
trans-2-pentene
o asimmetrici
ma solo in parte
Isomeria ottica
Un atomo di carbonio ibridato sp3 è asimmetrico quando è legato a
quattro atomi o gruppi di atomi differenti
Se una molecola c’è un carbonio asimmetrico,
deve esistere una seconda molecola simmetrica alla prima
Le due molecole, apparentemente identiche, sono due
isomeri configurazionali
Isomeria ottica
2 isomeri specularmente uguali - non sovrapponibilienantiomeri
C*
asimmetrico
Distinti per il verso di deviazione
legato a quattro atomi della luce polarizzata
o gruppi diversi
destrogiro levogiro
I sistemi biologici sintetizzano solo
La sintesi artificiale produce
entrambi gli enantiomeri
Miscela racemica
a
d
c
L’atomo di Carbonio centrale
è ibridato sp3 ed è legato
a quattro sostituenti diversi
b
Questo è un carbonio asimmetrico
L’atomo centrale ha ibridazione sp3 ed è legato a quattro sostituenti
diversi.
Esiste, di conseguenza, un’altra molecola nella quale gli stessi atomi
sono legati all’atomo centrale in maniera speculare.
Le due molecole, l’una immagine speculare dell’altra, sono definite
enantiomeri.
d
d
c
a
b
c
a
b
c
a
b
c
a
4
2
1
1
3
3
4
2
a
4
2
1
1
3
La molecola b è sovrapponibile
alla immagine speculare della
molecola a.
Quando si verifica questa
condizione, le molecole a e b
sono definite enantiomere.
4
3
2
b
3
1
4
2
H3C
H Cl
R
Cl
H CH3
S
enantiomeri
R
S
H
CH3
H
Br
Br
CH3
diastereoisomeri
diastereoisomeri
H Cl
H CH3
H3C
Cl
R
S
enantiomeri
R
H
Br
S
CH3
H
CH3
Br
-3
-1
0
+1
+3
+ ossidato
- ossidato
Nomenclatura stereoisomeri ottici
E’ importante, in riferimento ad un particolare
enantiomero o diastereoisomero ottico poterne
indicare la configurazione senza doverne ogni
volta scrivere la struttura.
Esistono convenzioni che lo consentono
•Sistema R-S o di Cahn-Ingold-Prelog (CIP)
•È una nomenclatura razionale che prende in
esame tutti i centri chirali della molecola
•Sistema D,L o di Fisher
•Si utilizza per alcune molecole di importanza
biologica
Es biologico
La stabilità del legame tra farmaco e recettore dipende dal bilancio delle forze attrattive
e di quelle repulsive che intercorrono tra le due specie interagenti.
L’intensità di queste forze dipende in gran parte dalla struttura tridimensionale del
farmaco.
Uno degli aspetti più importanti che riguarda la struttura dei farmaci è la
stereoisomeria.
La formula di struttura della meticillina metilestere riportata in basso non fornisce
sufficienti informazioni per ricavare la sua struttura tridimensionale poiché in essa non è
specificata la configurazione dei centri chirali.
La formula di struttura della stessa molecola riportata al centro fornisce, invece,
sufficienti informazioni per costruire un suo modello tridimensionale.
Noi abbiamo il D glucosio e gli L amminoacidi
ANALISI
DELL’ATTIVITÀ
OTTICA DI UNA
SOSTANZA
Luce polarizzata
A) Polarizzatore e analizzatore sono paralleli
Non è presente alcuna sostanza otticamente attiva
La luce polarizzata passa attraverso l’analizzatore
B) Polarizzatore e analizzatore sono ortogonali
Non è presente alcuna sostanza otticamente attiva
La luce polarizzata non emerge dall’analizzatore
C) Una sostanza otticamente attiva è presente tra
polarizzatore e analizzatore
L’analizzatoreè stato ruotato 40° a sinistra per permettere
l’emissione di luce polarizzata. LA sostanza è LEVOGIRA,
Attività ottica degli enantiomeri
• Quando un raggio di luce polarizzata attraversa un
enantiomero, il piano della luce ruota .
• L’enantiomero opposto ruota il piano della luce polarizzata di
un identico valore, ma in senso opposto.
• Soluzioni equimolari di enantiomeri hanno POTERE
ROTATORIO SPECIFICO uguale, ma di senso opposto (uno sarà
levogiro, l’altro destrogiro)
c = concentrazione soluzione g/ml
l = lunghezza del tubo (dm)
t = temperatura
l = lunghezza d’onda
Riassunto