CELLULE STAMINALI
Gigliola Sica
Direttore dell’Istituto di Istologia ed Embriologia
della Facoltà di Medicina e Chirurgia
Università Cattolica del Sacro Cuore
Roma, Italia.
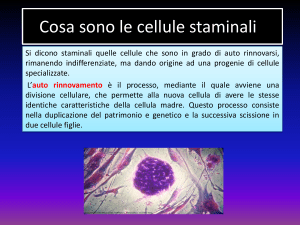
Cellule staminali
L’aggettivo “staminale” deriva dal latino
“stamen” (stame) che significa letteralmente
“ordito del telaio – filo”.
In botanica lo stame è il filamento la cui parte
terminale contiene il polline.
Il greco “stemon” riconduce alla radice di “stare”
nel senso di “essere ritto”.
L’inglese “stem” indica la parte
principale di una pianta, che ne
costituisce l’asse portante che
supporta foglie, fiori e frutti.
L’aggettivo “staminale” sta a
significare, pertanto, “ancestrale”,
che precede, nel caso specifico delle
cellule, altri elementi cellulari.
Le cellule staminali sono elementi provvisti di due
caratteristiche principali:
1) la capacità di autorinnovamento illimitato o
prolungato e cioè di riprodursi senza differenziarsi;
2) la capacità di dare origine a cellule progenitrici di
transizione con attitudine proliferativa limitata,
dalle quali discendono popolazioni di cellule
altamente differenziate.
Le cellule staminali e quelle progenitrici
specifiche sono morfologicamente e
citochimicamente indistinguibili.
Sono cellule rotonde, con una sottile
rima di citoplasma basofilo e nucleo con
2 o più nucleoli.
Le cellule staminali possono essere
distinte da quelle progenitrici sulla
base dei livelli di espressione di
alcuni geni e di alcune proteine.
Nel corso della differenziazione la progenie
delle cellule progenitrici di alcune linee
cellulari procede attraverso una serie di fasi
intermedie morfologicamente distinguibili in
base alle dimensioni, alla configurazione
nucleare, alle proprietà tintoriali e alla
presenza o assenza di granulazioni
citoplasmatiche.
Cellule staminali
Sorgenti:
1)
embrioni nei primi stadi dello sviluppo ottenuti
mediante fecondazione in vitro a scopi
riproduttivi o specificamente per la ricerca;
2)
embrioni ottenuti inserendo il nucleo di una cellula
adulta in una cellula uovo, privata del suo nucleo;
3)
organi di un feto abortito;
4)
cordone ombelicale;
5)
liquido amniotico;
6)
tessuti adulti.
Le cellule staminali sono
caratteristiche degli embrioni, ma
sono presenti anche negli organi di
individui adulti in piccola quantità.
Le cellule staminali embrionali possono derivare:
a) dalle cellule germinative primordiali, che alla
fine si differenziano in spermatozoi e ovociti.
b) dalla blastocisti.
La preparazione di cellule staminali embrionali umane
implica:
1) la produzione di embrioni umani e/o l’utilizzazione
di quelli soprannumerari da fecondazione in vitro
o crioconservati;
2) il loro sviluppo fino allo stadio di blastocisti;
3) il prelievo della massa cellulare interna, il che
implica la distruzione dell’embrione.
4) la messa in coltura di tali cellule su uno strato di
fibroblasti irradiati (feeder layer) e in un terreno
di coltura adatto, dove esse si moltiplicano fino
alla formazione di colonie che poi confluiscono;
5) ripetuti passaggi, fino alla formazione di linee
cellulari capaci di moltiplicarsi, conservando le
caratteristiche delle cellule staminali.
Questo è, tuttavia, solo il punto di partenza
per la preparazione di linee cellulari
differenziate, ossia di cellule le quali
possiedono le caratteristiche che assumono
nei diversi tessuti, es. muscolari, nervose,
ematiche, etc.
Lo step successivo è l’orientamento in
coltura del differenziamento, mediante
fattori di crescita. Questa operazione non è
facile, visto che non conosciamo
completamente i meccanismi
che lo sottendono.
"Human embryonic stem cells that are becoming epithelial cells, as
indicated by the presence of a protein called cytokeratin (in green).
The nuclei are stained blue." From: Growing Stem Cells (Genome News
Network) Research by Daniel G Anderson, Shulamit Levenberg
& Robert Langer at the Massachusetts Institute of Technology.
Per quel che riguarda le cellule ottenute da
feti abortiti, il loro uso equivarrebbe a quello
di organi prelevati da cadavere.
Le cellule così ottenute non hanno fornito
dati conclusivi sulla loro capacità di dare vita
a diversi tessuti.
Le cellule staminali ottenute dai vasi del
cordone ombelicale permetterebbero
teoricamente di creare banche personalizzate
per ciascun neonato, una riserva biologica da
utilizzare anche a distanza di tempo per
curare malattie. Ad oggi queste cellule hanno
dato origine solo a cellule del sangue; non è
dimostrata la capacità di dare vita ad
altri tessuti.
Prelievo di cellule staminali da cordone ombelicale
Caratteristiche delle cellule staminali ottenute
dal liquido amniotico
Clonal human AFS cells have a normal karyotype and retain long telomeres.
(a) Giemsa band karyogram showing chromosomes of late passage (>250 p.d.)
cells. (b) Flow cytometry of late passage cells showing DNA stained with
propidium iodide. G1 and G2/M indicate 2n and 4n cellular DNA content,
respectively. S indicates cells undergoing DNA synthesis, intermediate in DNA
content between 2n and 4n. (c) Conserved telomere length of AFS cells
between early passage (20 p.d., lane 3) and late passage (250 p.d., lane 4).
Short length (lane 1) and high length (lane 2) telomere standards are provided
in the assay kit. Marker lengths are indicated. p.d., population doubling.
Nature Biotechnology - 25, 100 - 106 (2007).
Cellule staminali adulte
In molti tessuti sono presenti cellule staminali
capaci, sostanzialmente, di dare origine solo a
cellule del tessuto da cui provengono.
Tuttavia, in vari tessuti umani (midollo osseo,
cervello, mesenchima) si trovano cellule staminali
pluripotenti capaci di dare origine a più tipi di
cellule, in maggioranza ematiche,
muscolari e nervose.
Nel midollo le cellule staminali da cui
derivano le varie linee di cellule ematiche,
che hanno come marcatore il CD34, ove
purificate, possono ricostituire l’intera
popolazione ematica in pazienti trattati
con chemioterapia o radioterapia.
Cellule staminali emopoietiche
Le cellule emopoietiche pluripotenti corrispondono
a meno dello 0,2% della popolazione totale delle
cellule nucleate del midollo.
La maggior parte di esse è in fase quiescente e
riprende a dividersi solo in risposta a richieste di
nuove cellule sanguigne.
Le cellule germinative primordiali danno
origine agli spermatogoni che sono di
due tipi:
A, che si dividono per mitosi e forniscono
una riserva continua di cellule staminali;
B, che danno origine agli spermatociti
primari.
Alcune cellule di tipo A abbandonano la
popolazione di cellule staminali e danno origine
a generazioni successive di spermatogoni,
progressivamente più differenziate.
Al termine dell’ultima divisione delle cellule A
si formano gli spermatogoni di tipo B e da essi
derivano gli spermatociti primari.
Fra le cellule del colletto delle ghiandole
gastriche è presente un modesto numero di
cellule staminali che governano il rinnovamento
continuo della mucosa.
Esse migrano verso l’alto per rimpiazzare le
cellule mucose superficiali e verso il basso per
formare cellule ossintiche e cellule principali.
L’epitelio cilindrico pseudostratificato
ciliato dell’apparato respiratorio presenta
cellule basali. Sono considerate cellule
staminali destinate a rimpiazzare le cellule
ciliate e le cellule caliciformi.
Il tessuto adiposo rappresenta una
ulteriore fonte di cellule staminali che
possono dar vita a cellule ossee e
muscolari.
Cellule staminali sono presenti nel
tessuto nervoso dei mammiferi in via
di sviluppo e nel sistema nervoso dei
mammiferi adulti, incluso l’uomo.
Le cellule staminali ottenute dal tessuto
nervoso fetale e dal tessuto nervoso
adulto del topo, del ratto o anche
dell’uomo crescono bene in coltura e,
quando introdotte nell’encefalo di animali
da esperimento, mostrano capacità di
migrazione e sostituzione di
aree danneggiate.
Neoregulina e proteina 2
osteomorfogena guidano lo sviluppo di
cellule staminali nervose
neuroni e
glia o cellule muscolari lisce.
L’impiego di cellule staminali pone, tra
gli altri, il problema della
tumorigenicità e quello della
incompatibilità immunologica.
Per superare il problema della
incompatibilità immunologica si è arrivati
alla clonazione terapeutica.
Il termine “clone” indica la produzione di
copie tutte uguali di una cellula o di un
tratto di DNA.
La locuzione “clonazione terapeutica”
indica il potenziale uso della tecnica del
trasferimento nucleare per ottenere
cellule, tessuti ed organi per pazienti che
necessitino della sostituzione di un
tessuto o di un organo
malato o danneggiato.
Sono state proposte tre vie di clonazione
terapeutica, atte ad ottenere cellule
staminali umane pluripotenti con una ben
definita informazione genetica, cui far
seguire la differenziazione desiderata:
1) trasferimento del nucleo di una cellula somatica
umana in un ovocita umano privato del proprio nucleo,
seguito dallo sviluppo embrionale (blastocisti);
prelievo della massa cellulare interna e derivazione da
questa delle cellule staminali e quindi delle cellule
differenziate desiderate;
2) trasferimento del nucleo di una cellula somatica
umana in un ovocita di altro animale;
3) riprogrammazione del nucleo di una
cellula somatica fondendolo con il citoplasma di
una cellula staminale embrionale.
Dati recentissimi della letteratura
(Letters di Nature on line) riportano i
risultati di esperimenti effettuati nel
topo per ottenere cellule staminali
embrionali mediante nuclear transfer
con delle modifiche rispetto a quanto
illustrato precedentemente.
Questi lavori avrebbero lo scopo di
conciliare gli interessi scientifici e le
istanze etiche nella speranza di
generare anche un ampio
consenso sociale.
a) Alterazione del nucleo del donatore
per ottenere una blastocisti incapace di
impiantarsi in utero ma capace di
generare cellule staminali embrionali;
b) derivazione di cellule staminali da un
singolo blastomero di un embrione allo
stadio di 8 cellule senza alterare lo
sviluppo dell’embrione stesso.
a, b, Clump of GFP-positive mES cells
48 h after aggregation with single
blastomeres; arrow shows a protruding
cluster of GFP-negative cells. c, d,
Outgrowth of GFP-negative cells
aggregated with GFP-positive mES
cells, after being plated on MEFs;
arrows point to GFP-negative cells. e, f,
Passage 1 of the outgrowth; arrows
show remaining GFP-positive mES cells.
g, h, Single blastomere outgrowth on
MEFs for 4 days without ES cells,
stained with Troma-1 and DAPI. a, c, e,
Green fluorescence; b, Hoffman
modulation optics; d, f, phase contrast.
Scale bar, 100 m.
PARADIGMA STANDARD DELLA
DIFFERENZIAZIONE
Il differenziamento è la comparsa di
differenze morfologiche, biochimiche e
funzionali tra le cellule. Alcune di queste
differenze sono visibili con comuni mezzi
di osservazione (microscopio).
La comparsa di differenze visibili è
preceduta da quella di differenze invisibili
con le tecniche tradizionali (determinazione).
Per ogni tipo di cellula è possibile individuare
un periodo critico prima del quale le cellule
possono cambiare il loro destino, ma dopo il
quale esse sono determinate a differenziarsi
in un certo modo.
La determinazione implica anche il
concetto di memoria cellulare: le cellule si
ricordano di ciò che è avvenuto nel periodo
della determinazione e rispondono agli
stimoli ambientali non solo in base al loro
patrimonio genetico, ma anche in base alla
loro storia.
Il differenziamento può essere
indipendente (determinanti citoplasmatici)
o dipendente
induzione.
Le sostanze induttrici naturali sono
molecole specifiche come i fattori di
crescita trasformanti (TGF-b) o la famiglia
dei fattori di crescita dei fibroblasti
(FGF).
Il differenziamento si verifica sostanzialmente
nel corso dello sviluppo embrionale.
Tuttavia, esso si continua nel normale turnover
cellulare e nei processi riparativi.
Complesse interazioni si estrinsecano
tra le cellule adiacenti.
Le cellule vanno incontro a una graduale
restrizione del potenziale differenziativo.
Lo sviluppo è accompagnato da una gerarchia di
processi di differenziamento che va dalla
formazione dei 3 foglietti germinativi alla
produzione nell’uomo di oltre 200 tipi di
cellule diverse.
Durante lo sviluppo si osservano peraltro numerosi
cambiamenti di forma che avvengono attraverso
migrazioni, ripiegamenti, tubulazioni, invaginazioni,
collettivamente noti con il termine morfogenesi.
Nella proliferazione e nel differenziamento
cellulare sono coinvolti diversi fattori di
crescita:
EGF, TGFs, FGFs, fattore BIG,
interleuchine, sostanza morfogenetica
dell’osso, etc.
Nel differenziamento degli arti sono
anche implicati i fattori Wnt, che a loro
volta inducono l’espressione di alcuni
geni della famiglia Lim.
L’acquisizione delle caratteristiche del
blastema metanefrico richiede
l’espressione del gene per il fattore di
trascrizione chiamato WT1. La crescita
del blastema richiede l’espressione del
gene per il fattore di trascrizione
chiamato c-ret.
Mutazioni di WT1 danno origine ad
anomalie dello sviluppo del rene,
dell’apparato genitale e a
tumori renali dell’infanzia.
Questi tumori (di Wilms) sono rari
(8/1.000.000 di individui).
Per la differenziazione del nefrone e
la formazione del glomerulo sono
importanti: Mox 1, n-myc, Pax 2,
Hoxc-9.
La decisione di una cellula dello strato
germinativo di rimanere a far parte del
contingente delle cellule che proliferano o di
spostarsi nello strato spinoso e proseguire nel
differenziamento dipende da un
gran numero di fattori:
EGF, TGFs, HGF, calcio, acido retinoico, fattore
BIG (ligando del recettore ECK),
IL-1, IL-6.
Eccessivi livelli di questi fattori possono
causare disordini proliferativi
dell’epidermide: TGF-a
psoriasi.
Il differenziamento è talvolta legato a
induzioni interattive specifiche che si
esercitano tra gemme di
organi differenti.
Il differenziamento non spiega però tutto
quello che accade: si originano delle diversità
dovute esclusivamente al fatto che gli stessi
tipi di cellule vanno a disporsi nello spazio in
maniera diversa.
Esiste dunque il problema dell’organizzazione
spaziale (pattern).
In realtà, le cellule ricevono due tipi di
informazioni diverse:
1) destino istologico
2) destino spaziale (geni del pattern)
Il pattern è il progetto architettonico
dell’individuo, mentre la morfogenesi è
l’insieme dei processi che realizzano il
progetto.
Geni omeotici: controllano il piano di
formazione del corpo.
Omeogeni sono stati scoperti anche nei
vertebrati: essi sono riconoscibili dalla
presenza dell’omeobox, sequenza di 183
nucleotidi contenuta nei geni.
Esiste una certa proprietà di
correzione dalle deviazioni
(regolazione) e si pensa che l’embrione
sia diviso in aree organogenetiche o
campi morfogenetici.
Totipotenza del germe
Possibilità di formare sia i tessuti embrionali che
quelli extraembrionali (persa allo stadio di 8
blastomeri).
Totipotenza embrionale
Capacità di formare tutti i tessuti dell’embrione
rimane più a lungo; è presente allo stadio di
blastocisti.
Gemelli monozigoti: 1/3 totale
1/3 ha 2 placente (bicoriali),
la separazione è avvenuta precocemente quando
entrambi i gruppi avevano la capacità di formare il
trofoblasto (primi 3 giorni);
gli altri 2/3 hanno una placenta sola (monocoriali).
La grande maggioranza ha due amnios.
Una piccola minoranza (1-2%) dei gemelli identici
ha un solo amnios.
La separazione è avvenuta dopo la formazione
dell’amnios: II settimana dello sviluppo.
Quanto esposto a proposito delle cellule
staminali tende a modificare il paradigma
standard della differenziazione !
Si mira alla
TRANSDIFFERENZIAZIONE !
The hepatocyte-to-beta cell transdifferentiation paradigm
Date le proprietà delle cellule staminali è
ovvio che esse siano importanti durante lo
sviluppo e il mantenimento dell’omeostasi
dell’organismo.
Due fenomeni biologici significativi
coinvolgono le cellule staminali:
1. L’invecchiamento
2. Il cancro
In condizioni fisiologiche le cellule
staminali presiedono al
rinnovamento cellulare e, quando la
capacità replicativa tende ad
esaurirsi, il tessuto invecchia.
A causa della lunga vita e della loro
storia replicativa le cellule
staminali sono soggette a danni
indotti da fattori intra- o
extra-cellulari.
Alcuni errori dovuti alla
duplicazione del DNA possono
essere riparati, ma, a lungo andare,
i meccanismi di riparazione possono
rivelarsi inefficaci.
Modelli di Tumorigenesi:
a) Modello semplificato a partire dalla
cellula staminale:
sviluppo tumorale clonale unidirezionale.
Tutte le cellule tumorali derivano dalla cellula
staminale e contengono mutazioni riscontrabili
in questa cellula.
Modelli di Tumorigenesi:
b) Modello di differenziazione dinamica:
sviluppo tumorale clonale multidirezionale.
Anche in questo caso si trovano mutazioni nella
cellula staminale, ma il differenziamento può
estrinsecarsi in forme diverse e le cellule
possono andare incontro ad una fluttuazione
lungo la via differenziativa riesprimendo le
caratteristiche delle cellule progenitrici.
Modelli di Tumorigenesi:
c) Modello di reclutamento:
sviluppo tumorale non clonale multidirezionale.
Il tumore, non solo contiene cellule staminali mutate,
ma recluta anche cellule normali che sono necessarie
al suo stesso sviluppo. Le cellule reclutate possono
avere mutazioni differenti da quelle espresse nelle
cellule staminali e possono essere ingaggiate a
differenti stadi della differenziazione del “cell
lineage” a cui appartengono.
Stem cell model of mammary carcinogenesis
Si ringraziano le Dott.sse:
Cristiana Angelucci
Fortunata Iacopino
Silvia Ferracuti
Cecilia Giannitelli
Per la collaborazione offerta alla realizzazione di
questa presentazione.